增强UV-B辐射对拟南芥叶片微管蛋白的影响
2013-12-03程娜娜刘福霞马爱珍
程娜娜,刘福霞,马爱珍,韩 榕
(山西师范大学生命科学学院,临汾041004)
随着人类社会的不断进步,工业化进程的快速发展,人类对大自然的影响日趋频繁,与此同时对大气环境造成了严重的破坏。大量污染物如氯氟烃、氯气、硫化物、NO和N02被不加处理地排放到大气中,对臭氧层造成一定的破坏[1]。大气臭氧层遭到破坏,导致到达地表的中波紫外线(即紫外线B,UV-B)辐射增强,并有持续增强的趋势[2-4]。由三个氧原子组成的臭氧(O3)虽然在大气中所占比例很小,却是重要的微量气体。由于O3可吸收大量的紫外线辐射,因此平流层和对流层的温度在很大程度上是由O3决定的[5]。近年来由于臭氧层的破坏,使得到达地面的UV-B辐射逐渐增强,因此对人类的健康以及动植物的生长发育都产生了极大的威胁。因此研究增强UV-B辐射对植物的影响成了近几年的热点[6]。
韩榕等[7]在研究增强UV-B辐射对小麦细胞染色体畸变及分裂的影响的研究中发现了一种特殊的体细胞分裂方式“分束分裂”。微管骨架均匀分布于整个细胞质基质中,结构完整;发生“分束分裂”现象的小麦根尖细胞的微管结构被破坏,在细胞中分布极不均匀。因此,经增强的UV-B辐射后,细胞骨架体系会发生较大差异。而在有丝分裂过程中微管是形成纺锤体的主要成分,染色体的分离是通过纺锤体的牵拉发生的。因此,推测“分束分裂”的发生可能与微管结构、形态及组成有关。微管是所有真核生物细胞骨架的重要成分。微管主要由微管蛋白α、β亚基聚合形成直径为25 nm的中空管状结构[8]。微管两端的动态变化表现在微管踏车现象[9]。微管参与细胞形态的发生和维持、细胞内物质运输、细胞运动和细胞分裂等过程[10]。本文初步以拟南芥为材料,研究了增强UV-B辐射对其叶片微管蛋白的影响,以期探讨微管蛋白在增强UV-B辐射后的植物中所发挥的功能。
1 材料与方法
1.1 供试材料
哥伦比亚生态型(Columbia-0)拟南芥(Arabidopsis thaliana)种子由本实验室保存。
1.2 材料培养
拟南芥种子4℃避光春化2~3 d。然后用1.5%次氯酸钠消毒3-5次,并用无菌水漂洗干净,加入0.1%的琼脂水使种子悬浮后用移液枪点种在MS培养基上,置于培养室中培养,温度(20±2)℃,湿度60%-80%,光照周期为16 h光照/8 h黑暗。
1.3 UV-B辐射处理
拟南芥在MS培养基中培养17 d后,移栽到蛭石及珍珠岩的小花盆中盖膜培养5 d,揭膜后7、8、9、10 d分别进行UV-B处理。UV-B处理用UV-B灯,将其垂直悬于花盆上方,采用不同的辐射剂量(12.96 KJ·m-2·d-1、17.28 KJ·m-2·d-1、21.60 KJ·m-2·d-1)处理8 h。辐射处理后立即转入暗处25℃培养。未经UV-B处理的植株作为对照[11],次日上午取材。
1.4 拟南芥叶片微管蛋白提取
提取方法参照郭爱华等[12],并略有改动。
称取拟南芥叶片0.1 g,在研钵中加入少量石英砂及适量微管蛋白提取缓冲液(50 mM PIPES-KOH,2 mM MgCl2,2 mM EGTA,1 mM DTT,1 mM PMSF,50 μg/mL TPCK,50 μg/mL TAME,pH 值 6.9),冰浴充分研磨,用超高速离心机(100000 r/min,4℃,20 min),取上清。
1.5 微管蛋白含量的测定
参考李合生[13]方法,略有改动。
取样品提取液20 μL,加入蒸馏水 980 μL,使总体积为1 mL,加入5 mL考马斯亮蓝G-250溶液,充分混匀,放置2 min,在595 nm下比色,测定吸光值,并通过标准曲线查得蛋白质的含量。样品中蛋白质的含量计算公式:

C——查得的标准曲线值,μg;VT——提取液总体积,mL;
VS——测定时加样量,mL;WF——样品鲜重,g 。
1.6 SDS-PAGE凝胶电泳和免疫印迹
1.6.1 SDS-PAGE凝胶电泳
采用SDS-PAGE凝胶电泳,垂直平板电泳槽,制备厚度为1.5 mm的胶,并采用5%的浓缩胶和12.5%的分离胶。上样前在蛋白溶液中按1:1(v/v)加入上样缓冲液,沸水中热处理3~5 min,样品上样量为20 μL。
1.6.2 免疫印迹
参考章静波[14]方法,略有改动。
切胶在转移缓冲液中平衡30 min,转膜过程中根据膜大小选择电压(小于25 V),转膜30 min,取出膜后TBST洗3次,丽春红染色,看到条带后用蒸馏水洗膜至完全褪色,封闭1 h,TBST洗膜3次,加一抗(sigma产品)过夜孵育,TBST洗膜3次,加二抗孵育1 h,TBST洗膜3次,ECL试剂盒显影(以Rubisco蛋白作为内参蛋白)。
1.7 图像采集及数据分析
使用凝胶成像分析系统采集图像。使用spss17.0软件分析数据,并进行t检验,比较差异的显著性。利用Quantity One凝胶软件对SDS-PAGE凝胶进行分析。
2 结果与分析
2.1 增强UV-B辐射后拟南芥7、8、9、10日龄微管蛋白含量变化

图1 不同处理组对不同日龄拟南芥叶片蛋白含量的影响Fig 1 The effects of different treatment on protein content in different day age Arabidopsis thaliana leaves
由图1可以看出,经过UV-B辐射处理后7、8、9日龄拟南芥中微管蛋白含量都表现为先增加后减少的趋势。9日龄含量最高,变化也最为显著。而10日龄的含量虽高于9日龄但UV-B辐射后变化规律为先增加后减少并处于缓慢变化状态,所以确定9日龄为最佳研究材料。
2.2 拟南芥微管蛋白的含量
由图2可以看出,9日龄拟南芥对照组及不同UVB辐射(B1、B2、B3组)处理组蛋白含量变化,不同UVB辐射剂量对拟南芥叶片微管蛋白造成不同程度的影响。与对照组相比,B1、B2组蛋白含量分别增加6.00%、6.82%(P<0.05),且差异显著;与对照组相比,B3组蛋白含量下降2.72%(P>0.05),但差异不显著。与B1组相比,B2组蛋白含量仅增加0.88%(P>0.05),差异不显著;与B1组相比,B3组蛋白含量明显减少8.49%(P<0.05),差异显著,且低于对照组。与B2组相比,B3组蛋白含量也明显减少9.29%(P<0.05),且差异显著。
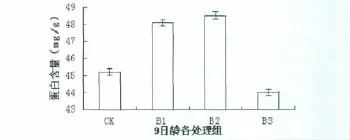
图2 不同处理组拟南芥叶片微管蛋白的含量变化Fig 2 The content change of tubulin in Arabidopsis thaliana leaves with different treatment
2.3 拟南芥微管蛋白的SDS-聚丙烯酰胺凝胶电泳


图3为对照组和不同UV-B处理组拟南芥叶片微管蛋白的电泳图谱,M为标准蛋白分子量,从上到下依次为 170、130、95、72、55、43、34、26、17 和 10 KD,通常纯化的微管蛋白应当是a、β亚基以1:1二聚体存在,其分子量为110 KD[15],但利用 Quantity One软件对电泳图谱分析得到的分子量为53 KD,推测可能是由于非共价键破坏导致微管蛋白解聚,此时电泳图谱中为单体的分子量。经Western-Blot鉴定电泳图谱中为目的条带(图A)。图4为不同处理组内参蛋白Rubisco蛋白的含量,与CK组相比,B1、B2的蛋白含量分别增加0.02%、0.23%(P<0.1),B3的蛋白含量降低0.19%(P<0.1),差异不显著,因此可以证明本次实验中上样量基本相同,对后续实验结果无较大影响。由图5可以看出,通过Quantity One软件对电泳条带进行灰度分析,以CK组为1作对照,其他处理组与CK组的比值则为其相对含量。与对照组相比,经UV-B辐射的处理组 B1、B2的蛋白含量分别显著增加6.85%和9.30%(P<0.05),B2最为明显;但随着辐射剂量的增加,B3组分别低于 B1、B2组12.74%、14.70%(P<0.05),且低于对照组6.76%(P<0.05)。另外,从电泳图谱分析B3组与其他组相比,大部分条带消失(图3,B)。
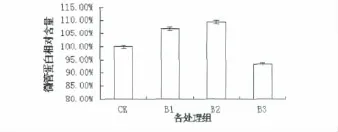
图5 不同处理组拟南芥叶片微管蛋白相对含量的变化Fig 5 Changes in the relative content of tubulin in Arabidopsis thaliana leaves with different treatment
3 讨论
与动物微管相比,植物微管的研究相对比较落后,主要原因就是难以从植物细胞中提取微管蛋白。Morejohn等首次从玉米、烟草、胡萝卜、玫瑰悬浮细胞中分离纯化得到微管蛋白,并体外聚合成功[15]。Sutherland等报道大豆叶片内的环丁嘧啶二聚体率在UVB辐射后会增加,认为高剂量的UV-B辐射能诱导产生较多的二聚体(DNA损伤),说明高剂量UV-B辐射会破坏其遗传代谢体系[6]。高素娟等[16]的研究表明,体内外有许多因素调控微管组织,其中光是一种对微管有多重调控作用的影响因素。
在受到胁迫时,包括化学试剂及环境胁迫,体内胞质微管会迅速组装或解聚[17]。郭爱华等[18]研究表明,增强UV-B辐射后,小麦叶片中的微管骨架发生了解聚,形成短棒状或点状结构,微管束呈弥散分布状态且荧光强度减弱。安旭亮等[19]研究表明,在增强UV-B辐射后,小麦幼苗的Rop GTPase含量会降低,LCSM扫描细胞原生质体显示原生质体的形状发生了改变,同时细胞骨架也被破坏,标记后的原生质体荧光变暗,强度减弱。本实验使用不同剂量UV-B辐射处理不同日龄的拟南芥,并对叶片微管蛋白进行提取,在对微管蛋白浓度进行测定时,选用考马斯亮蓝法。采用最常用的SDS-PAGE及Western Blot鉴定微管蛋白。
微管骨架主要由微管蛋白和微管结合蛋白组成,并且通过其亚单位不断延伸和缩短改变它的存在状态。微管通过改变其存在状态维持细胞形态、参与细胞运动等,在植物中发挥着重要作用[20]。本文选取 7、8、9、10日龄的拟南芥幼苗进行辐射,7、8、9日龄的幼苗中微管蛋白在三种不同UV-B辐射剂量下都呈现先增加后减少的趋势,可能是由于低剂量辐射后,幼苗中微管发生了解聚,使体系中的微管蛋白的单体含量增加,从而测得的微管蛋白的含量增加,微管解聚可能是拟南芥幼苗在低剂量的辐射下形成的自我保护功能,然而在高剂量UV-B辐射下,拟南芥幼苗的自我保护不足以抵抗其造成的损伤,因此,可能是微管发生聚合,从而使测得的体系中微管蛋白的含量减少。而10日龄幼苗微管蛋白含量的变化趋势不同于7、8、9日龄的变化趋势可能是由于随着辐射天数的增加,在高剂量UV-B辐射下拟南芥幼苗自我保护功能已失去作用,一部分微管聚合后,幼苗趋于死亡,不再发生变化,因此在体系中测得的微管蛋白含量处于缓慢变化状态。
增强UV-B辐射后,本实验结果与郭爱华[18]的微管蛋白含量变化趋势一致,郭爱华的UV-B剂量为10.08 KJ·m-2·d-1,本文采取三种不同的UV-B剂量对9日龄的拟南芥叶片进行辐射,在低剂量(12.96 KJ·m-2·d-1)和中剂量(17.28 KJ·m-2·d-1)UV-B辐射处理时,微管蛋白含量逐渐增加。高剂量(21.6 KJ·m-2·d-1)UV-B辐射处理时,微管蛋白含量明显降低。随着UV-B胁迫程度的增强,拟南芥叶片微管蛋白含量呈现先增加后减少的趋势。这表明,本文所施加的低剂量和中剂量的UV-B辐射使微管解聚,考马斯亮蓝法测含量的体系中微管解聚形成大量单体,从而使测得的蛋白含量增加,这与电泳图谱得出的结论一致。然而,高剂量的UV-B辐射使考马斯亮蓝法测得的蛋白含量明显下降,从电泳图谱可以看出,微管蛋白单体含量也明显减少,并且大部分的蛋白条带消失,说明高剂量(21.6 KJ·m-2·d-1)UV-B辐射对植物是致死的。在增强UV-B辐射后,蛋白含量的增减,取决于辐射强度和植物对UV-B辐射的敏感程度差异。关于增强UV-B辐射如何影响拟南芥叶片微管蛋白还有待进一步研究。
[1]罗丽琼,陈宗瑜.紫外线-B辐射对植物DNA及蛋白质的影响[J].生态学杂志,2006,25(5):572-576.
[2]姚银安,杨爱华,徐 刚.两种栽培荞麦对日光UV-B辐射的响应[J].作物杂志,2008.6,69-74.
[3]Valkama E,Kivimaenpaa M,Hartikainen H,et al.The combined effects of enhanced UV-B radiation and selenium on growth,chlorophyll fluorescence and ultra structure in strawberry(Friaries anamosa)and barley(Horde vulgar)treated in the field[J].Agricultural and Forest Meteorology,2003,120:267-268.
[4]Taalas P,Kaurola J,Kylling A,et al.The impact of greehouse gases and halogenated species on future solar UV radiation doses[J].Geophys Res Lett,2000,27:1127-1130.
[5]吴鲁阳.UV-B辐射增强对葡萄幼苗生长和生理生化影响的研究[D].西安:西北农林科技大学,2006.
[6]颜 安.增强UV-B辐射及盐胁迫对拟南芥表皮毛突变体的影响[D].兰州:兰州大学,2010.
[7]韩 榕,王勋陵,岳 明,等.增强UV-B辐射对小麦体细胞分裂的影响[J].遗传学报,2002,29(6):537-541.
[8]欧光朔.一种植物微管结合蛋白的特性和功能分析[D].北京:中国农业大学,2001.
[9]张运刚.微管骨架在拟南芥根响应渗透胁迫中的作用[J].重庆:重庆大学,2012.
[10]翟中和,王喜忠,丁明孝.细胞生物学第三版[M].北京:高等教育出版社,2007,8(2008 重印).
[11]王 超.UV-B诱导拟南芥β-1,3-葡聚糖酶基因表达和DNA损伤的研究[D].重庆:华南师范大学,2008.
[12]郭爱华.He-Ne激光和增强UV-B辐射对小麦幼苗微管蛋白及微管骨架的影响[D].山西:山西师范大学,2010.
[13]李合生.现代植物生理学[M].北京:高等教育出版社,2002:415,419.
[14]章静波,黄东阳,方 瑾.细胞生物学实验技术[M].北京:化学工业出版社,2006.4.
[15]廖俊杰,吴英杰,阎隆飞.萱草花粉中微管蛋白生物化学性质[J].云南植物研究,2006,28(4):425 ~428.
[16]高素娟,张丽丽,王小菁.微管动态不稳定性及其微管排向的光调控[J].天水师范学院学报,2009,29(5):16-19.
[17]Dhonukshe P,Gadella Jr T W J.Alteration of microtubule dynamic instability during preprophase band formation revealed by yellow fluorescent protein-CLIP170 microtubule plus-end labeling[J].The Plant Cell,2003,15:597-611.
[18]郭爱华,高丽美,李永锋,等.增强UV-B辐射和He-Ne激光对小麦原生质体微管骨架的影响[J].广西植物,2010,30(2):250-255.
[19]安旭亮,韩 榕.He-Ne激光对小麦ROP GTPase经增强UV-B辐射造成的损伤的修复研究[J].植物研究,2010,30(6):725-730.
[20]洪兴福,李宝赛,孙震晓.去甲斑蝥素对体外微管蛋白聚合的抑制作用[J].中国药理学与毒理学杂志,2012,26(5):630-635.
