可口革囊星虫不同组织同工酶的比较
2013-12-03雷世勇丁理法黄福勇竺俊全
雷世勇,丁理法,黄福勇,竺俊全
(1.宁波大学教育部应用海洋生物技术重点实验室,宁波315211;2.温岭市水产技术推广站,浙江温岭317500)
可口革囊星虫(Phascolosoma esculenta)属星虫动物门、革囊星虫科、革囊星虫属,自然分布于浙江、福建、广东、广西和海南等省沿海。可口革囊星虫栖息于潮间带泥质或泥沙质滩涂,营穴居生活,以底栖硅藻和有机腐殖质为食。由于其风味独特、营养经济价值及药用价值较高[1-3],且生长快、利用自然苗种养殖一年便能收获,因此,是非常理想的优良增养殖种。近年来由于沿海环境污染的加剧以及过度采捕,加之大面积滩涂被围垦,减少了星虫的栖息地,造成资源的严重衰退。因此,可口革囊星虫的资源保护、人工育苗与增养殖引起重视[4]。迄今,有关可口革囊星虫的基础研究已经涉及到了营养学[2,3]、繁殖生物学[5-9]、分子生物学[10-12]等方面。同工酶技术作为一种成熟的实验手段,已在动物的生化遗传和遗传多样性等多方面的研究中得到广泛应用。本研究用聚丙烯酰胺凝胶电泳法对可口革囊星虫5种组织中的10种同工酶进行了检测分析,以了解可口革囊星虫基因表达的特异性,为进一步研究可口革囊星虫的遗传多样性、各组织的生理机能以及种质鉴定提供参考。
1 材料和方法
1.1 材料
试验用可口革囊星虫采自浙江省温岭市坞根镇潮间带滩涂,挑选活力好、健壮的成体,个体重2.5~3.5 g,每种同工酶检测均取30条。
1.2 方法
1.2.1 样品制备
活体解剖可口革囊星虫,取吻、肠和体壁组织各0.3 g,收吻肌和肾管取全部,用生理盐水清洗后,加重蒸水600 μL,4℃冰浴匀浆,移入离心管,15 000 r/min离心15 min,取上清液,按1:1的比例加入40%甘油和0.1%溴酚蓝指示剂,用于电泳分析。
1.2.2 电泳、染色
同工酶电泳采用聚丙烯酰胺凝胶(PAGE)电泳法,分离胶浓度为6.7%,浓缩胶浓度为2.5%,电极缓冲液为Tris-甘氨酸(TG,pH值8.3);采用DYY-2C型稳压稳流电泳仪,DYCZ-24D型垂直板电泳槽;用25 μL微量进样器点样,每空点样量为15 μL,然后,将电泳槽移至4℃冰箱中进行电泳。电泳时,指示剂在浓缩胶内时用150 V电压,当指示剂完全进入分离胶后,将电压升高到180 V,总电泳时间约4 h。凝胶制备及染色参照文献[13]。
1.2.3 结果记录与酶谱分析
凝胶用7%醋酸溶液脱色固定后进行酶谱分析,利用FR复日紫外/可见光分析生物凝胶成像系统观察、拍照,对凝胶测量后按酶带迁移率手工记录。各位点命名以各酶谱的相对Rf迁移率由小到大依次命名,即向阳极运动的酶谱带开始依次命名为1,2,3……,Rf=l/L,l为阴极端至各谱带中点的距离,L为阴极端至指示剂终点的距离。
2 结果
5种组织中的同工酶谱及活性强弱见图1及表1。
2.1 醇脱氢酶(ADH,E.C.1.1.1.1)
肠组织中没有检测到有活性的ADH同工酶酶带;吻中ADH同工酶由4个基因座位编码,ADH-1活性较强,ADH-2、ADH-3、ADH-4活性较弱;ADH-1在收吻肌、吻、肾、体壁中均表达且活性较强;ADH-2只在体壁中表达、活性较弱。
2.2 D-葡糖脱氢酶(GCDH,E.C.1.1.1.118)
GCDH同工酶在收吻肌中有1条谱带,活性很强;在吻中有5条谱带;在肠中不显示有活性的谱带;在肾管中只有1条谱带,活性弱;体壁中有2条谱带。
2.3 山梨醇脱氢酶(SDH,E.C.1.1.1.14)
SDH同工酶在收吻肌中显示有SDH-1、SDH-2两条谱带,在其它4种组织中只有一条谱带。SDH-2在肠中酶活性强。
2.4 酯酶(EST,E.C.3.1.1.1)
EST同工酶酶谱较复杂,在5种组织中均有表达。EST-1仅在收吻肌中表达,活性强;EST-2在收吻肌、吻及体壁中表达,收吻肌中活性强;EST-3在5种组织中均有表达,肠与肾中活性强;EST-4只在肾管中表达,活性强;EST-5在肠和体壁中表达,活性强;EST-6和EST-7在吻和肠中表达,吻中活性弱、肠中活性强;EST-8和EST-9在吻和体壁中表达,且EST-9的活性强;EST-10只在吻中表达,活性强;EST-11在除肾管外的4种组织中均有表达,活性弱;EST-12在收吻肌、吻和肠中表达活性较弱。
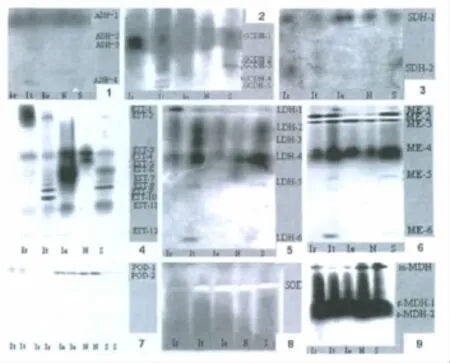
图1 可口革囊星虫同工酶电泳图谱Fig 1 Electrophoretic patterns of isozymes on Phascolosoma esculenta
2.5 乳酸脱氢酶(LDH,E.C.1.1.1.27)
LDH同工酶在收吻肌中仅有LDH-1和LDH-4两条酶带,LDH-1活性强;在吻中有5条酶带,LDH-4活性强;在肠和肾管中只有LDH-4一条酶带,且活性弱;体壁中有4条酶带,LDH-4活性强。

表1 可口革囊星虫5种组织中9种同工酶的表达和活性Table 1 The expression and activity of 9 isozymes in 5 tissues of Phascolosoma esculenta
2.6 苹果酸酶(ME,E.C.1.1.1.40)
ME同工酶具有复杂而清晰的酶谱。ME-1仅在吻中存在;ME-2、ME-3和 ME-4在5种组织中均存在,ME-2在收吻肌、吻及体壁中活性强,而在肠和肾管中活性较弱,ME-3、ME-4在5种组织中活性强;ME-5和ME-6仅在吻和体壁表达。
2.7 过氧化物酶(POD,E.C.1.11.1.7)
过氧化物酶共有2条酶带,其中POD-1仅在吻中表达,但活性较弱;POD-2在吻、肠、肾管及体壁中表达,肠和肾管中活性较强。
2.8 超氧化物歧化酶(SOD,E.C.1.15.1.1)
SOD同工酶仅有一条酶带,SOD酶带在5种组织中均有表达,在收吻肌中活性弱,在其它组织中活性强。
2.9 苹果酸脱氢酶(MDH,E.C.1.1.1.37)
MDH同工酶有电泳移动较快的s(胞质型)-MDH和移动较慢的m(线粒体型)-MDH两种类型,m-MDH靠近阴极,s-MDH靠近阳极。m-MDH由一个基因座位编码,s-MDH由s-MDH-1和s-MDH-2两个基因座位编码,互相之间不杂合,其中s-MDH-2在各组织中活性很强。
3 讨论
在所检测的10种同工酶中,除CAT没有检测到酶活性外,其它9种同工酶得到了相应的酶谱。从图1和表1可以看出,从同工酶酶谱的表型来看,SOD和MDH在各组织中的表型较为一致,SOD由一个基因座位编码,在收吻肌中活性较弱,在其它4种组织中活性较强,MDH由3个基因座位编码,3个基因座位(m-MDH、s-MDH-1和s-MDH-2)在5种组织中均有表达,除m-MDH在5种组织中的活性有差异外,s-MDH-1和s-MDH-2在5种组织中活性都很强。在可口革囊星虫的5种组织中,SDH-2、EST-1、LDH-1及 POD-1为收吻肌所特有;ADH-3、ADH-4、GCDH-2、GCDH-4、GCDH-5、EST-10及LDH-6为吻所特有;EST-4为肾管所特有;在肠中,ADH和GCDH均没有检测到活性。不同组织中同工酶表达的差异是受不同的遗传基因控制的结果,以适应各组织器官不同的生理需要。
同工酶在生物体各组织中的表达、分布及活性与各组织的生理机能密切相关。如酯酶和食物的消化有密切关系,同时还有解毒的作用[13];醇脱氢酶、D-葡糖脱氢酶、山梨醇脱氢酶、乳酸脱氢酶、苹果酸脱氢酶和苹果酸酶和能量的产生有密切关系[14-17];过氧化物酶和超氧化物歧化酶和机体的防御机能密切相关[18]。
可口革囊星虫的5种组织具有较为丰富的酶系统,它们以同工酶的形式参与机体的代谢和调节。收吻肌的运动需要大量的能量,与此相适应,收吻肌中D-葡糖脱氢酶、苹果酸酶和苹果酸脱氢酶表现出较强活性;吻中D-葡糖脱氢酶、酯酶、乳酸脱氢酶、苹果酸酶、超氧化物歧化酶和苹果酸脱氢酶均有表达,且大多具有复杂酶谱并表现出较强活性,这不仅与吻作为星虫动物重要运动器官、需要大量能量供应相适应,还说明它可能对摄取的食物进行初步消化,并担负着机体防御的功能;肠中,有些酯酶活性强,超氧化物歧化酶和过氧化物酶活性较强,说明肠除了担负消化功能之外,还起着解毒和防止氧化损伤等作用[14];体壁运动耗能多,苹果酸酶和苹果酸脱氢酶活性强,因机体防御机能的需要,有些酯酶和超氧化物歧化酶活性也较强。可口革囊星虫为低等无脊椎动物,各组织功能的分化程度较低,收吻肌、吻及体壁在机体运动中相互配合,吻、肠、体壁同时在完成机体的防御功能中担负重要使命,吻和肠还具有消化、吸收的功能,这从同工酶酶谱中得到了很好反映。
[1]蒋定文,沈先荣,贾福星,等.海洋星虫提取物的营养分析及免疫调节作用的初步观察[J].中国生化药物杂志,2004,25(2):96-97.
[2]周迎松,丁理发,徐继林,等.可口革囊星虫主要营养要素的分析[J].营养学报,2007,29(4):413-414.
[3]周迎松,严小军,李广宇,等.可口革囊星虫多肽在运动中抗自由基作用的实验研究[J].中国运动医学杂志,2008,27(1):55-60.
[4]徐敏娴,丁理法,周敏华.可口革囊星虫人工繁育及增养殖技术的研究[J].水产养殖,2011,32(11):39-41.
[5]竺俊全,王 武,许式见,等.可口革囊星虫的精子发生及精子结构[J].动物学报,2007,53(4):733-741.
[6]竺俊全,王 武,应雪萍,等.可口革囊星虫受精过程及早期卵裂的细胞学变化[J].动物学报,2008,54(2):290-298.
[7]金春华,竺俊全,许式见,等.可口革囊星虫(Phascolosoma esculenta)胚胎及幼虫发育研究[J].海洋与湖沼,2011,42(1):94-100.
[8]顾晓英,竺俊全,许式见,等.可口革囊星虫(Phascolosoma esculenta)卵子发生的组织学研究[J].海洋与湖沼,2009,40(3):283-288.
[9]竺俊全,王 伟,丁理法.可口革囊星虫(Phascolosoma esculenta)卵黄合成期卵母细胞发育及卵黄发生与卵膜形成的超微结构[J].海洋与湖沼,2012,43(3):1-7.
[10]王孟前,李 晔,苏秀榕,等.可口革囊星虫cDNA文库的构建及蚯蚓血红蛋白基因序列的分析[J].台湾海峡,2010,29(1):20-26.
[11]Su X R,Du L L,Li Y Y,et al.Cloning and expression of HSP70 gene of sipuncula Phascolosoma esculenta[J].Fish& Shellfish Immunology,2010,28(3):461-466.
[12]Wang M Q,Su X R,Li Y,et al.Cloning and expression of the Mn-SOD gene from Phascolosoma esculenta[J].Fish & Shellfish Immunology ,2010,29(5):759-764.
[13]胡能书,万贤国.同工酶技术及其应用[M].长沙:湖南科学技术出版社,1985.86-126.
[14]李太武,苏秀榕.中国对虾和日本对虾6种同工酶的比较研究[J].海洋学报,1997,19(2):85-88.
[15]张锦芳,籍小涛,杜连祥.D-葡萄糖脱氢酶活力测定方法的研究——短小芽孢杆菌在D-核糖生产中的应用[J].天津轻工业学院学报,2001,38(3):37-40.
[16]任雪峰,陈载融,孙春洪.连续监测法测定血清山梨醇脱氢酶[J].临床检验杂志,1997,15(2):76-79.
[17]李广丽,朱春华.月鳢不同组织中乳酸脱氢酶和酯酶同工酶的比较[J].湛江海洋大学学报,1999,19(1):1-3.
[18]方允中,李文杰.自由基与酶[M].北京:科学出版社,1989,111-133.
