2010年—2011年山东近海石莼属绿潮藻的种类鉴定
2013-12-03高姗姗段维军陈先锋张慧丽朱水芳
高姗姗,段维军,陈先锋,张慧丽,陈 炯,朱水芳
(1.宁波大学海洋学院宁波315211;2.宁波出入境检验检疫局检验检疫技术中心,宁波315012;3.中国检验检疫科学技术研究院植物检疫研究所,北京100121)
石莼属(Ulva sp.,以往称为石莼属和浒苔属)隶属于绿藻门 (Chlorophyta)、绿藻纲(Chlorophyceae)、石莼目(Ulvales)、石莼科(Ulvaceae)[1,2]。广泛分布在世界各大洋中,常生长在高低潮间带的岩石上或石沼中,有时也可附生在大型海藻的藻体和船舶的外壳之上。绿潮(Green tides)是绿藻门大型海藻暴发性增殖或高度聚集,从而导致多方面次生危害的一种生态异常现象,绝大部分该类绿潮是由石莼属绿藻所造成的,现已成为一种世界性的海洋环境问题。
近年来,中国山东近海连续发生大规模绿潮灾害,对海洋生态系统、环境、资源与沿海经济造成了不同程度的影响。2008年夏季,中国山东青岛地区经历了世界上迄今为止规模最大的一次绿潮灾害。绿潮覆盖面积13000平方公里,绿潮清理工作动用了过万人员和1400余艘船只,清理出超过100余万吨的绿潮藻[3,4]。2009年7月,青岛再次爆发大规模绿潮灾害,覆盖面积达19000平方公里,持续时间超过一个月[5]。2010年7月初绿潮最大覆盖面积和分布面积分别达到了530平方公里和29800平方公里[6]。2011年7月,绿潮最大覆盖面积和分布面积分别达到了560平方公里和26400平方公里[7]。山东近海绿潮灾害爆发面积大,持续时间长,大量涌入近岸海域,对渔业、水产养殖、海洋环境、景观和生态服务功能产生了严重影响。
绿潮藻的种类鉴定是解决该类问题的首要步骤。然而,石莼属绿藻,特别是漂浮石莼属绿藻,由于其高度形态可塑性以及缺少可用于形态鉴定的特征,非常难于鉴定。近年来,根据 internal transcribed spacer(ITS)片段或者large subunit of the ribulose-bisphosphate carboxylase(rbcL)等片段序列分析结果,对石莼属内种类划分方面已经取得了长足进展[1]。在以往对2008年—2009年绿潮藻种类鉴定研究中,根据漂浮绿潮藻高度分枝和中空的形态特征,绿潮藻被鉴定为U.prolifera[8],根据系统进化分析研究,有研究报告指出该绿潮藻属于 U.linza-procera-prolifera(LPP)分枝[9],也有结合形态学观察或杂交试验结果报道其为U.prolifera[10],但是Kim等的研究却指出该绿潮藻为U.linza[11]。山东近海绿潮灾害连年爆发,其2010年和2011年种类组成是否发生变化,对此尚未有研究予以解决。准确地绿潮种类组成鉴定对于其防控工作开展以及追溯其来源具有重要意义,为此我们开展了本项研究。
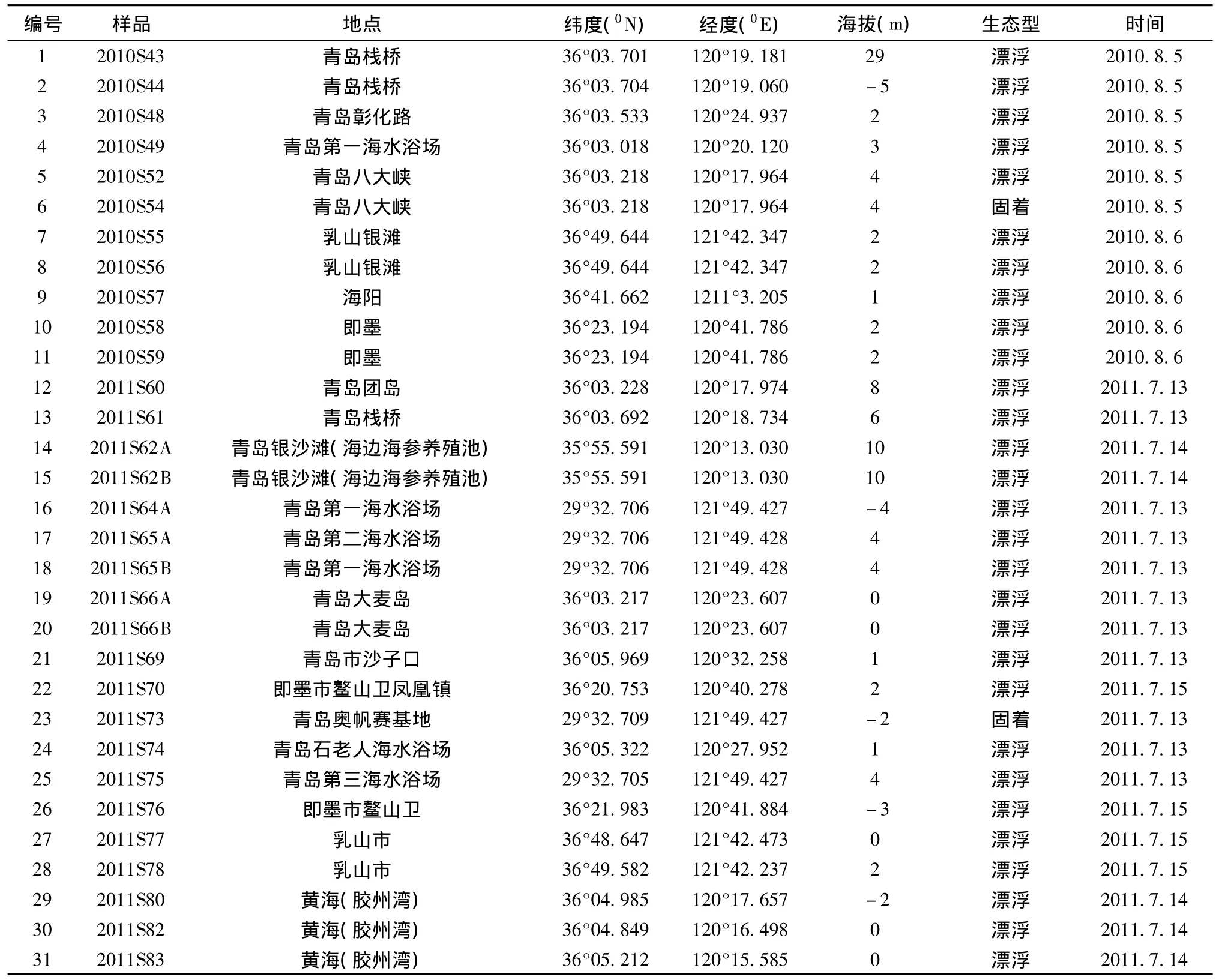
表1 采集石莼属样品信息Table 1 The information of collected Ulva samples
1 材料与方法
1.1 材料
1.1.1 样品的采集与处理
于2010年—2011年在山东近海绿潮发生地采集石莼属样品,样品信息见表1。采用无菌水仔细清洗新鲜藻体,洗去泥砂和其它附着物,用吸水纸吸干表面水分,储存于4℃条件下,用于形态学观察和DNA提取。
1.1.2 试剂
Taq 酶、MgCl2、10 × PCR buffer、DL2000 Marker、DNA片段纯化试剂盒和凝胶纯化试剂盒、pMD19-T载体均购自宝生物(Takara);Plant Genomic DNA Kit试剂盒购自天根公司;实验用引物由上海英俊合成;其他试剂均为分析纯。
1.2 方法
1.2.1 形态特征观察
形态学观察的标准参照Duan等[12]方法进行。
1.2.2 基因组DNA的提取
利用天根Plant Genomic DNA Kit(TIANGEN.,China)试剂盒,按照试剂盒说明书进行基因组DNA的提取。
1.2.3 ITS、rbcL和5S rDNA间隔序列的扩增及克隆
用于ITS、rbcL和5S rDNA间隔序列扩增的引物、PCR反应体系及反应条件参照Duan等[12]方法进行。PCR扩增产物通过1.5%琼脂糖凝胶电泳分离后,进行ITS、rbcL和5S rDNA间隔序列的基因克隆,挑选阳性克隆送上海英俊生物技术有限公司测序。
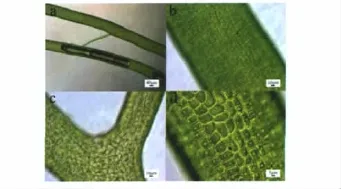
图1 浒苔样品2011S62A的形态特征Fig 1 Microscopic details of Ulva prolifera,2011S62A
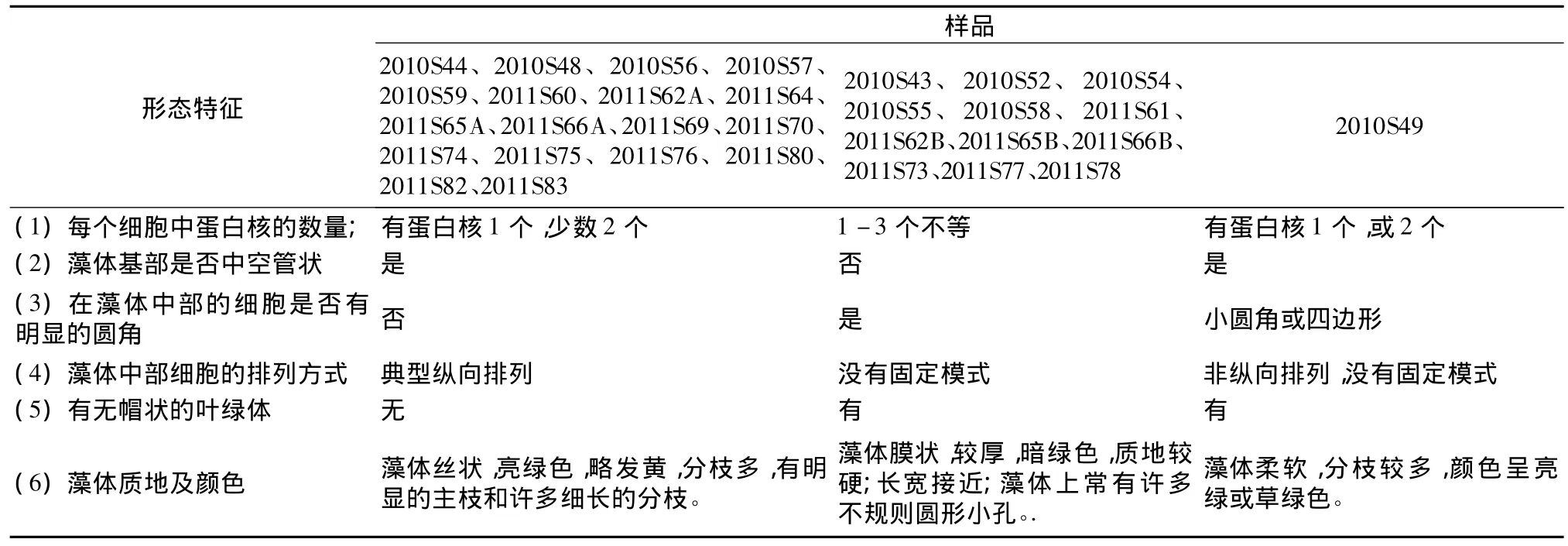
表2 根据形态特征31株黄海采集石莼属样品分属于3种不同形态类群Table 2 Based on morphology,the 31 samples of Ulva spp.from the Shangdong Coast can be divided into three groups

图2 孔石莼样品2011S65B的形态特征Fig 2 Microscopic details of Ulva pertusa,2011S65B
1.2.4 系统发育分析
从NCBI数据库中下载用于石莼属ITS、rbcL和5S rDNA间隔序列分析的序列。将测得的序列与Genbank中下载的序列用CLUSTAL X程序进行同源性分析,使用MEGA5.0软件[13]中的邻接法(NJ)构建系统进化树,重复1000次计算Bootstrap值。
2 结果
2.1 形态学特征
样品2010S44等,共计18个,占供试样品的58%,其形态特征与 Tseng 等[14]、Heesch 等[15]描述的浒苔(U.prolifera)的形态特征基本一致(表2,图1)。样品2010S43等,共计12个,占供试样品的38.7%,其形态特征与 Tseng 等[14]、Heesch 等[16]、Aguilar-Rosas 等[17]描述的孔石莼(U.pertusa)的形态特征基本一致(表2,图2)。样品2010S49,共计1个,占供试样品的3.2%,形态特征与 Tseng 等[14],Blomster等[18]描述的扁浒苔(U.compressa)的形态特征基本一致(表2,图3)。

2.2 分子系统发育分析
2.2.1 ITS和rbcL系统进化发育分析
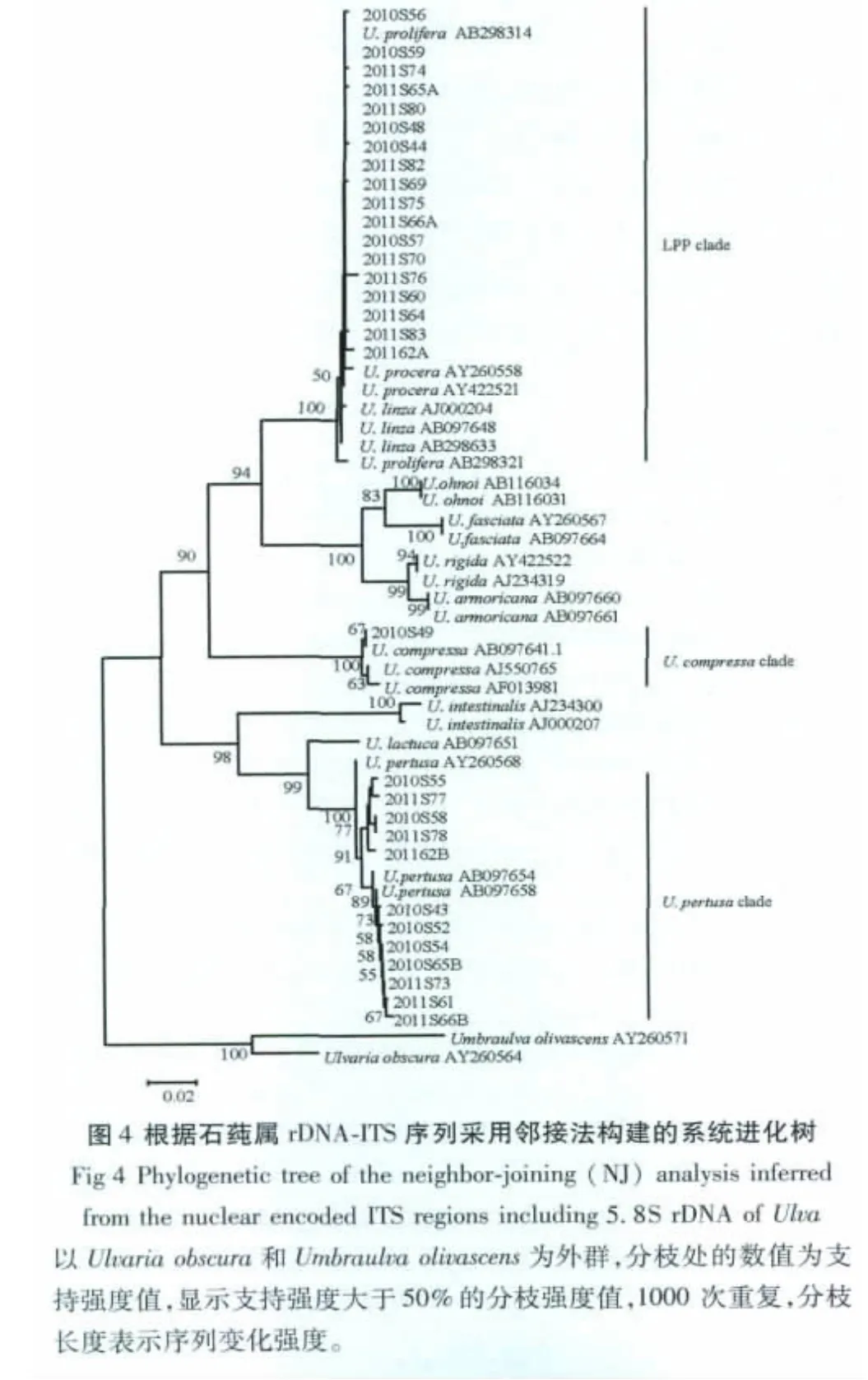
ITS片段由870 bp左右碱基构成,而rbcL片段长度约为1270 bp。31株山东近海收集的石莼属样品被划分到3个不同的分枝。最大的一个分枝包括18个样品,包含2010年绿潮藻样品5株和2011年绿潮藻样品13株,它所获得的 bootstrap值分别为100/100(ITS/rbcL);12株样品属于 U.pertusa分枝,bootstrap值分别为100/100(ITS/rbcL);样品2010S49属于U.compress分枝,bootstrap值分别为100/100(ITS/rbcL)(图4、图5)。
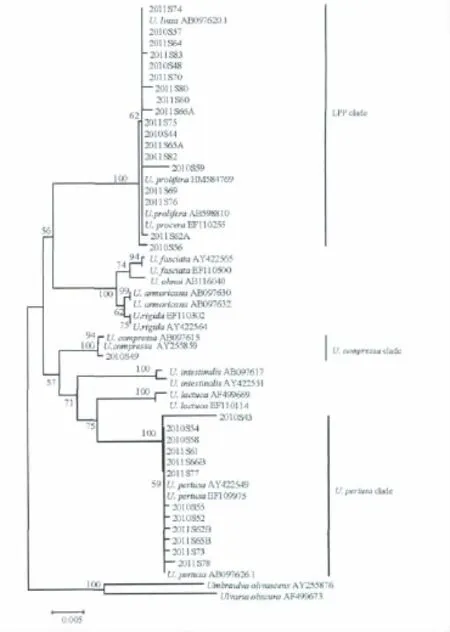
图5 根据石莼属rbcL序列采用邻接法构建的系统进化树Fig 5 Phylogenetic tree of the neighbor-joining(NJ)analysis inferred from the nuclear encoded rbcL regions of Ulva
2.2.2 5S rDNA间隔序列的系统进化发育分析
5S rDNA间隔序列片段由445 bp左右碱基构成,根据5S rDNA间隔序列片段的分析构建了系统进化树。18株属于LPP分枝的样品均被划分到了U.prolifera分枝,其bootstrap支持值为100,在所采集的漂浮样品中没有发现缘管浒苔U.linza(图6)。
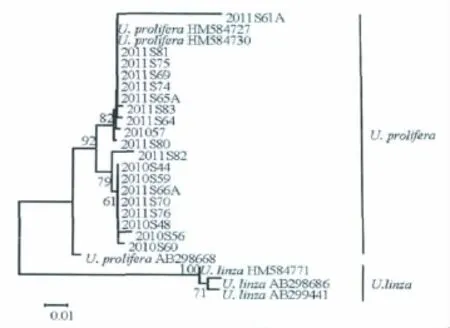
图6 根据石莼属5S rDNA间隔区序列采用邻接法构建的无根系统进化树Fig 6 Unrooted neighbor-joining(NJ)tree of the 5S rDNA spacer region of the LPP clade
3 结论与讨论
对于石莼属物种鉴定,仅使用形态学方法面临一些问题。石莼属形态特征复杂,少数形态特征会随环境的变化而变化,如U.intestinalis通常没有分枝,而U.compressa有分枝,但是低盐或盐休克可以诱导U.intestinalis形成分枝[18]。同时,传统分类学家数量在逐渐减少,针对某一特定类群专家相对更少。目前对于石莼属种类的鉴定已经越来越多的借助于分子生物学的方法,通过使用DNA序列分析的方法推断类群间系统发育关系,结合形态学特征,完成物种鉴定,这一技术弥补了传统分类方法的不足。
尽管ITS和rbcL序列能够将石莼属内大多数种类区分开,表现出其在石莼属种类划分中的重要作用,但对于LPP(U.linza-procera-prolifera)分枝中的U.linza、U.procera(现已被划分为 U.linza 的同物异名)[2]和U.prolifera却无法起到很好的辨别作用。为此我们采用了一个更加灵敏的分子标记——5S rDNA间隔序列标记,Shimada等人的研究证实了5S rDNA间隔区对于石莼属中LPP分枝中浒苔和缘管浒苔的准确划分有着重要作用[19]。结合本实验的结果,5S rDNA间隔序列成功地将缘管浒苔和浒苔区分开来,明确了本研究中采集的18株漂浮样品均为浒苔U.prolifera,浒苔仍然是2010年—2011年间山东近海漂浮绿潮的优势种群。
绿潮的发生通常都是由一种或几种石莼属绿藻构成,更好的对绿潮藻种类组成进行研究对于解决绿潮问题至关重要。在本研究中,我们采用形态学观察结合分子生物学的方法对2010年—2011年山东近海黄海海域绿潮藻的种类进行了鉴定。通过ITS和rbcL的序列分析,我们发现从山东近海19个不同地点收集的31株石莼属样品可以划分为3个不同的分枝:LPP分枝、孔石莼分枝和扁浒苔分枝,固着藻和漂浮藻样品中均有孔石莼的存在。为确定LPP分枝中18株漂浮藻的最终分类地位,我们进一步进行了5S rDNA间隔序列的序列分析,结果发现18株漂浮藻均为浒苔U.prolifera。因此,2010年—2011山东近海绿潮种类组成包括浒苔 U.prolifera、孔石莼 U.pertusa和扁浒苔 U.compressa。本研究表明多种石莼属绿藻共同构成了2010年—2011年山东近海的绿潮灾害,其不同种类所占比例也有所不同,该结果为进一步查明山东近海绿潮来源提供了重要信息。绿潮藻种类组成对于绿潮发生发展起到何种作用尚需进一步研究。
为查明本国石莼属资源,防范外来有害生物或绿潮灾害的发生,一些发达国家,如新西兰[15]、日本[19]等已经对其周边海域内石莼属绿藻进行了详尽的调查与分析,明确了具体种类。石莼属绿藻迄今全世界已报道种类约有100种[2],但中国有文献报道记载的石莼属绿藻种类仅有10余种[14]。中国海岸线辽阔,气候多变,地理跨度大,海洋资源对国家发展意义重大,很有必要开展石莼属绿藻资源调查工作。
[1]Hayden H,Blomster J,Maggs C,et al.Linnaeus was right all along:Ulva and Enteromorpha are not distinct genera[J].European Journal of Phycology,2003,38:277-294.
[2]Guiry M D,Guiry G M.Algae base.world-wide electronic publication,National University of Ireland,Galway.http://www.algaebase.org;searched on 14 February 2012.
[3]李 杰.青岛浒苔变身纪念品[N].中国海洋报,20080822期,http://epaper.oceanol.com/shtml/zghyb/20080822/56946.shtml.
[4]王秋蓉,唐少曼.青岛打捞浒苔超过18万吨[N].中国海洋报,20080704期,http://epaper.oceanol.com/zghyb/20080704/index.htm.
[5]唐少曼.黄海浒苔陆续在威海、烟台和青岛登岸[N].中国海洋报,20090724 期,http://epaper.oceanol.com/shtml/zghyb/20090724/61771.shtml.
[6]国家海洋局.2010年中国海洋灾害公报[R].2011,http://www.soa.gov.cn/soa/hygbml/zhgb/ten/webinfo/2011/04/1303019794623623.htm.
[7]国家海洋局.2011年中国海洋灾害公报[R].2012,http://www.soa.gov.cn/soa/hygbml/zhgb/eleve/webinfo/2012/07/1341188579657459.htm.
[8]牛建峰,范晓蕾,潘光华,等.青岛海域大面积聚集漂浮浒苔的显微观测[J].海洋科学,2008,32(8):30-33.
[9]Leliaert F,Zhang X,Ye N,et al.Research note:identity of the Qingdao algal bloom[J].Phycological Research,2009,57(2):147-151.
[10]Hiraoka M,Ichihara K,Zhu W,et al.Culture and hybridization experiments on an Ulva clade including the Qingdao strain blooming in the Yellow sea[J].PLoS ONE,2011,6(5):e19371.
[11]Kim J H,Kang E J,Park M G,et al.Effects of temperature and irradiance on photosynthesis and growth of a green-tide-forming species(Ulva linza)in the Yellow Sea[J].Journal of Applied Phycology,2011,23(3):421-432.
[12]Duan W,Guo L,Sun D,et al.Morphological and molecular characterization of free-floating and attached green macroalgae Ulva spp.in the Yellow Sea of China[J].Journal of Applied Phycology,2012,24(1):97-108.
[13]Tamura K,Peterson D,Peterson N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Molecular Biology and Evolution,2011,28:2731-2739.
[14]Tseng C K.Common seaweeds in China[M].1983,Beijing:Science Press.
[15]Heesch S,Broom J E S,Neill K F,et al.Ulva,Umbraulva and Gemina:genetic survey of New Zealand taxa reveals diversity and introduced species[J].European Journal of Phycology,2009,44(2):143-154.
[16]Heesch S,Broom J,Neill K,et al.Genetic diversity and possible origins of New Zealand populations of Ulva[R].Biosecurity New Zealand Technical Paper No:2007/01,2007.
[17]Aguilar-Rosas R,Aguilar-Rosas L E,Shimada S.First record of Ulva pertusa Kjellman(Ulvales,Chlorophyta)in the Pacific Coast of Mexico[J].Algae,2008,23(3):201-207.
[18]Blomster J,Maggs C A,Stanhope M J.Molecular and morphological analysis of Enteromorpha intestinalis and E.compressa(Chlorophyta)in the British Isles[J].Journal of Phycology,1998,34(2):319-340.
[19]Shimada S,Yokoyama N,Arai S,et al.Phylogeography of the genus Ulva(Ulvophyceae,Chlorophyta),with special reference to the Japanese freshwater and brackish taxa[J].Journal of Applied Phycology,2008,20(5):979-989.
