基于BP神经网络和析因设计的土壤中EE2和BPA超声辅助生物降解模型
2013-12-03周长志
李 鱼,张 琛,周长志,孟 冲
(华北电力大学 资源与环境研究院,北京 102206)
雌激素(endocrine disrupting chemicals,EDCs)是一类通过影响内分泌系统功能,破坏生物体维持机体稳定性和调控作用的物质[1].乙炔基雌二醇(EE2)和双酚A(BPA)均为人工合成雌激素,在工业生产、畜牧业和医药业中应用广泛.EE2是养殖业饲料、口服避孕药和激素补充用药的主要成分,在ng/L量级即具有较强的内分泌干扰性[2-3].EE2进入自然水体后,可诱导雄性鱼类体内蛋白的合成,从而影响鱼类的繁殖能力[4].BPA作为化工原料广泛用于食品包装和塑料器具,在微量水平下即可表现雌激素效应,影响人类和动物的生殖及内分泌系统[5].雌激素化合物进入环境后,在自然水体、沉积物、地下水以及土壤中均有不同程度的残留[6-8].
生物降解可在保证不引入二次污染物的前提下有效去除环境中有机污染物.本文选取恶臭假单胞菌(Pseudomonasputida)对人工合成雌激素EE2和BPA进行超声辅助生物降解.将碳源添加量、氮源添加量、接种量、超声时间和降解时间作为输入,EE2和BPA的降解率作为输出,分别构建超声辅助生物降解EE2和BPA的BP神经网络模型[9-12].利用BP神经网络预测不同25-1析因设计[13]条件下对应的生物降解率(响应值),并分析了影响因子的主效应和交互作用,进而求解土壤-水体系中EE2和BPA的最优生物降解条件.针对EE2和BPA的生物降解差异性,结合污染物自身的移动性和持久性探讨其降解机理.
1 实 验
1.1 试剂与仪器
17α-乙炔基雌二醇(质量分数>97%,德国Sigma公司);双酚A(质量分数>99%,美国Aldrich公司);甲醇(色谱纯,美国Burdick &Jackson公司);氯化钙和氢氧化钠(优级纯,北京化工厂);用甲醇配制雌激素的混合储备液(20 mg/L)于4 ℃冰箱中保存,标准曲线溶液由混合储备液稀释配制而成.
高效液相色谱仪(Agilent 1200型,美国Agilent公司);分析天平(FA1004型,上海海鸥仪器有限公司);回旋式振荡器(HY-5型,江苏金坛市环宇科学仪器厂);数控超声波清洁器(KQ3200DE(0~150 W)型,昆山市超声仪器有限公司);Milli-Q超纯水系统(美国Millipore公司).
1.2 恶臭假单胞菌培养基的制备材料
富集培养基的制备:酵母浸粉5.0 g,蛋白胨10.0 g,氯化钠10.0 g,蒸馏水1.0 L,调节pH≈7.0.无机盐培养基的制备:磷酸氢二钾4.35 g,磷酸二氢钾1.70 g,硫酸镁0.20 g,氯化铵2.10 g,硫酸锰0.05 g,七水合硫酸亚铁0.01 g,结晶水氯化钙0.03 g,蒸馏水1.0 L,pH=6.8~7.0.
1.3 恶臭假单胞菌的富集培养
将实验室保存完好的斜面培养基在37 ℃恒温条件下活化24 h后,在超净工作台中采用接种环挑取菌落,接种于500 mL富集培养基的锥形瓶中,瓶口用8层纱布和报纸包扎,置于37 ℃培养箱中培养24 h.重复富集细菌两次,第二次接种液取自第一次培养液.
1.4 雌激素生物降解
在盛有50 mL无机盐培养基的锥形瓶中加入定量的雌激素溶液后,接入不同体积的菌液,于37 ℃培养箱中避光培养7 d,每24 h取样一次,考察恶臭假单胞菌对雌激素的生物降解规律.同时在50 mL具有一定浓度雌激素的无机盐培养基中接入8.0 mL菌液(OD600≈0.8,处于对数生长期),在功率为30 W,分别超声1,5,10,15 min,每隔24 h取样一次,取样后即对溶液进行超声作用,并置于37 ℃培养箱中避光培养7 d,设两个平行样.实验将未接入恶臭假单胞菌菌液的雌激素溶液设置为空白对照.考察超声波作用对恶臭假单胞菌生物降解雌激素的影响.根据上述实验方法,分别考察以碳源添加量、氮源添加量、恶臭假单胞菌接种量、超声辅助时间和降解时间为降解影响因子的单因素实验,共60组.随机选取30组数据作为BP神经网络建模的训练集,20组数据作为建模的验证集和测试集,10组作为预测集以检验模型精度.
1.5 雌激素的检测条件
采用高效液相色谱对雌激素进行分离.流动相为甲醇和纯净水.EE2和BPA检测的洗脱程序为:0~4 min内V(甲醇)∶V(水)由0.8降至0.7,4~10 minV(甲醇)∶V(水)=0.7,后运行时间设定为8 min;流速:1.0 mL/min.采用Agilent ZORBAX SB-C18 (250 mm×4.6 mm,5 μm),柱温为30 ℃;可变波长紫外检测器的检测波长λ=280 nm.
2 结果与讨论
2.1 EE2和BPA降解的BP神经网络模型建立
2.1.1 BP神经网络模型结构 将影响EE2和BPA生物降解的因素:碳源添加量(X1)、氮源添加量(X2)、底物浓度(X3)、超声时间(X4)和降解时间(X5)作为5个输入变量,EE2和BPA的生物降解率(Y)作为1个输出变量,表达式为
Y=f(X1,X2,X3,X4,X5),
隐层节点数设为9,构建三层前向反馈5×9×1结构模型.训练目标设为5.0×10-5,学习效率为0.01.将30组数据用于模型的训练集,20组数据用于验证集和测试集,以验证模型的泛化能力.通过对模型的反复网络训练,确定能正确反映雌激素EE2和BPA在土壤-水系统中降解的BP神经网络模型.
2.1.2 EE2和BPA降解的BP神经网络模型精度分析 为验证建立模型的准确性和有效性,本文随机选取10组实验数据作为预测集样本用于检验模型的预测能力.采用相关系数(R2)和模拟效率系数(NSC)考察建立模型的预测能力和精度,结果如图1所示.
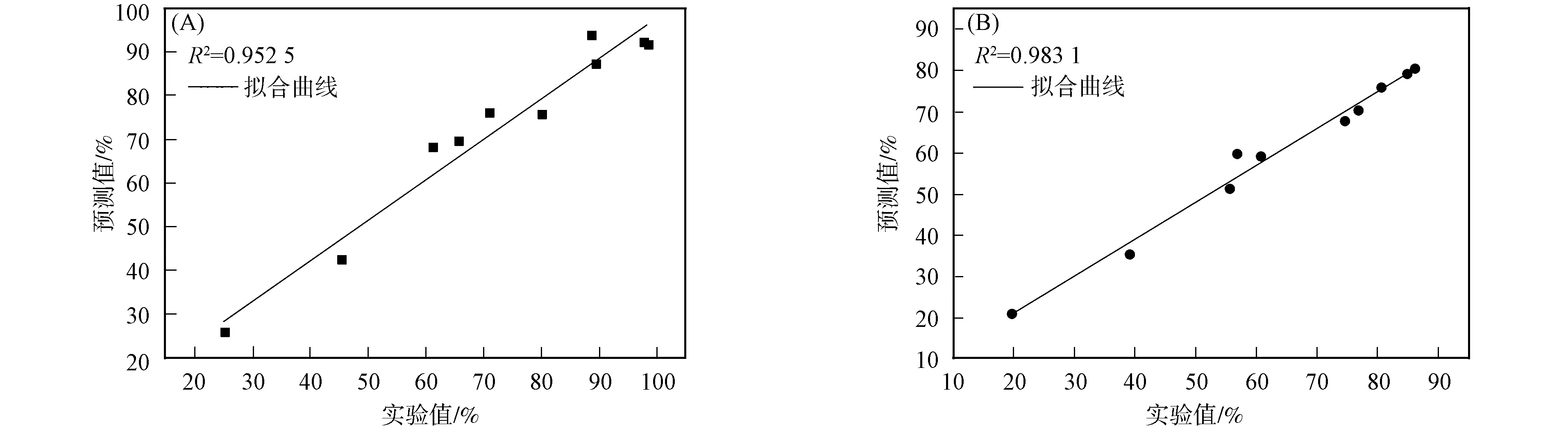
图1 EE2(A)和BPA(B)生物降解率检验样本的相关性分析Fig.1 Correlation analysis between experimental and predictive degradation rates of EE2 (A) and BPA (B)
若BP神经网络模型输出的预测值和实验值的R2>0.90,则模型的预测能力较高;若R2<0.90,则模型的预测能力具有局限性[14].由图1可见,散点均匀分布于直线两侧,表明模型的预测值和实验值具有较高的契合度.EE2和BPA在土壤-水体系中降解率的实验值和预测值的R2分别为0.952 5和0.983 1.
本文考察了EE2和BPA在土壤-水体系中生物降解的模拟效率系数(NSC)取值,表达式为
(1)
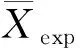
NSC值越接近1,预测值和实验值的匹配程度越高.结果表明,土壤-水体系中EE2和BPA生物降解模型的NSC分别为0.956 5和0.957 2,即模型具有较高的精度.EE2和BPA神经网络模型的验证集、测试集和预测集均方差分别为0.007 0,0.445 6,0.101 4和0.006 9,0.500 6,0.718 5,表明模型预测值和实验值的吻合度较高.
2.2 EE2和BPA降解的析因设计
本文将影响生物降解的条件(X1,X2,X3,X4,X5)设置为自变量,EE2和BPA的生物降解率(Y1和Y2)设置为响应值,采用25-1分式析因设计雌激素降解实验,析因设计因素水平列于表1.

表1 25-1析因设计因素水平Table 1 Factors and levels of 25-1 factorial design
利用已建立的BP神经网络模型预测25-1分式析因设计的响应值,降解实验数据列于表2.基于BP神经网络模型对降解率的预测结果,对影响生物降解的各因素进行分析.当显著性水平p<0.05时,选取主要影响因子作为回归方程的自变量,EE2的降解率作为回归方程的因变量,其多元回归方程表达式为
其中:一元自变量系数的正负表示与降解率成正比或反比;二元自变量系数的正负表示二阶交互作用对生物降解效果的协同作用或拮抗作用.

表2 25-1析因设计实验Table 2 Experimental arrangement of 25-1 factorial design
EE2影响因子的Pareto分布如图2所示.由图2可见,主因子X3,X4和X5以及交互作用X1×X2和X1×X3的Pareto百分比平方和均大于10,即上述因子对EE2降解率的影响较大.由式(2)可见:主因子X3和X5与Y1成正比,X4与Y1成反比;交互作用X1×X2和X1×X3在EE2降解过程中具有协同作用.
当显著性水平p<0.05时,建立以BPA降解率为因变量的多元回归方程,其表达式为
BPA影响因子的Pareto分布如图3所示.由图3可见,主因子X2,X4以及交互作用X1×X2,X1×X3和X2×X3的百分比平方和均大于10,即上述因子对BPA降解率的影响较大.由式(3)可见:主因子X2与Y2成正比,X4与Y2成反比;在降解过程中,二元交互作用X1×X2,X1×X3具有协同作用,X2×X3具有拮抗作用;X4在EE2和BPA的降解过程中均为负效应.

图2 EE2影响因子的Pareto分布Fig.2 Pareto distribution of EE2 factors

图3 BPA影响因子的Pareto分布Fig.3 Pareto distribution of BPA factors
2.3 雌激素生物降解条件优化
本文考察了各影响因子对EE2和BPA降解效果影响的趋势,结果如图4所示.

图4 EE2和BPA的因素影响趋势Fig.4 Influence tendency of factors for EE2 and BPA
由图4可见:影响因子X1~X5对Y1和Y2的影响趋势基本一致.随着X1,X2,X3和X5水平取值的增大,Y1和Y2呈增大趋势并在高水平处达到最大值;随着因子X4水平取值的增大,Y1和Y2呈下降趋势.因此在降解过程中为微生物提供充足的碳源和氮源,可使恶臭假单胞菌处于生长对数期,选择适宜的超声时间可促进恶臭假单胞菌的生物活性,提高细菌的代谢作用,从而增强EE2和BPA的降解效果.
通过对EE2和BPA影响因子趋势的对比分析可获得土壤-水体系中EE2和BPA的最优降解条件为:10%的碳源添加量;10%的氮源添加量;接种量为20 mL;超声时间为1 min;降解时间为168 h.各因子对EE2和BPA在土壤-水体系中降解的影响趋势与文献[15]结果一致.在最优降解条件下,利用已建立的多元回归模型预测EE2和BPA的最大降解率分别为87.13%和69.27%.
2.4 雌激素降解机理分析
在相同生物降解条件下,EE2和BPA在土壤-水体系中的降解效果差异较大.EE2和BPA的有机碳标化系数(lgKoc)和半衰期列于表3.

表3 EE2和BPA的化学参数Table 3 Chemical parameters of EE2 and BPA
lgKoc-降解率和半衰期-降解率的线性方程表达式分别为:
DR=255.14 lgKoc-1 099.27,
(4)
DR=-0.72HL+90.87,
(5)
其中:DR为EE2和BPA的降解率;lgKoc和HL分别表示EE2和BPA有机碳标化系数和半衰期.由表3可见,EE2的lgKoc大于BPA的lgKoc,EE2的半衰期小于BPA的半衰期.由式(4)和式(5)可见,EE2和BPA的lgKoc与其降解率成正比,半衰期与降解率成反比.因此,EE2和BPA的降解效果存在差异是由于雌激素在土壤-水体系中的移动性强弱不同及雌激素在环境中的持久性不同所致.
[1] Snyder S A,Westerhoff P,Yoon Y,et al.Pharmaceuticals,Personal Care Products,and Endocrine Disruptors in Water:Implications for the Water Industry [J].Environ Eng Sci,2003,20(5):449-469.
[2] Puma G L,Puddu V,Tsang H K,et al.Photocatalytic Oxidation of Multicomponent Mixtures of Estrogens (Estrone (E1),17β-Estradiol (E2),17α-Ethynylestradiol (EE2) and Estriol (E3)) under UVA and UVC Radiation:Photon Absorption,Quantum Yields and Rate Constants Independent of Photon Absorption [J].Appl Catal B:Environ,2010,99(3/4):388-397.
[3] Edelman A B,Cherala G,Munar M Y,et al.Prolonged Monitoring of Ethinyl Estradiol and Levonorgestrel Levels Confirms an Altered Pharmacokinetic Profile in Obese Oral Contraceptives Users [J].Contraception,2013,87(2):220-226.
[4] Reyhanian N,Volkova K,Hallgren S,et al.17α-Ethinyl Estradiol Affects Anxiety and Shoaling Behavior in Adult Male Zebra Fish (Daniorerio) [J].Aquat Toxicol,2011,105(1/2):41-48.
[5] CHEN Min-yu,Ike M,Fujita M.Acute Toxicity,Mutagenicity,and Estrogenicity of Bisphenol-A and Other Bisphenols [J].Environ Toxico,2002,17(1):80-86.
[6] Fent G,Hein W J,Moendel M J,et al.Fate of14C-Bisphenol A in Soils [J].Chemosphere,2003,51(8):735-746.
[7] LIU Ze-hua,Kanjo Y,Mizutani S.Urinary Excretion Rates of Natural Estrogens and Androgens from Humans,and Their Occurrence and Fate in the Environment:A Review [J].Sci Total Environ,2009,407(18):4975-4985.
[8] Staples C A,Dome P B,Klecka G M,et al.A Review of the Environment Fate,Effect,and Exposures of Bisphenol A [J].Chemosphere,1998,36(10):2149-2173.
[9] ZHU Shun-quan.The Application of BP Neural Network in the Cash Flow Analysis Based on Matlab [J].China Management Informationization,2008,11(6):39-40.(朱顺泉.基于Matlab的BP神经网络在现金流量分析中的应用 [J].中国管理信息化,2008,11(6):39-40.)
[10] LI Yu,ZHENG Shuang,WANG Jiang-ling,et al.Reaction Condition Optimization of Butyric Acid under Catalytic Wet Air Oxidation Based on BP Artificial Neural Network Model [J].Journal of Jilin University:Science Edition,2009,47(2):397-402.(李鱼,郑爽,王江玲,等.基于BP神经网络模型的催化湿式氧化正丁酸反应条件的优化 [J].吉林大学学报:理学版,2009,47(2):397-402.)
[11] GAO Qian,WANG Qian,WANG Zhi-zeng,et al.Modeling of Atrazine Adsorption on Sediments in Ternary System of Cadmium-Copper-Atrazine [J].Advances in Science and Technology of Water Resources,2011,31(1):37-41.(高茜,王倩,王志增,等.镉-铜-阿特拉津三元复合体系中沉积物吸附阿特拉津过程的模型研究 [J].水利水电科技进展,2011,31(1):37-41.)
[12] ZHANG Chen,LIU Jian-lin,HU Yan,et al.Application of BP Neural Network to the Adsorption of Bisphenol A onto Surfacial Sediments and Their Non-residual Fractions [J].Scientia Geographica Sinica,2010,30(3):435-440.(张琛,刘建林,胡艳,等.BP神经网络模型在表层沉积物及其非残渣态组分吸附双酚A研究中的应用 [J].地理科学,2010,30(3):435-440.)
[13] Ven P M,Van de,Bucchianico A D.On the Equivalence of Definitions for Regular Fractions of Mixed-Level Factorial Designs [J].J Stat Plan and Infer,2009,139(7):2351-2361.
[14] 雷英杰.MATLAB遗传算法工具箱及应用 [M].西安:西安电子科技大学出版社,2005.
[15] LIU Jian-lin.Study on the Adsorption Behaviors and Biodegradation of Estrogen Chemicals in Soil System [D].Beijing:North China Electric Power University,2012.(刘建林.雌激素化合物在土壤中的吸附行为及生物降解的研究 [D].北京:华北电力大学,2012.)
[16] Lee L S,Strock T J,Sarmah A K,et al.Sorption and Dissipation of Testosterone,Estrogens,and Their Primary Transformation Products in Soils and Sediment [J].Environ Sci Technol,2003,37(18):4098-4105.
[17] Lim S J,Fox P.Estimating the Persistence of Organic Contaminants in Indirect Potable Reuse Systems Using Quantitative Structure Activity Relationship (QSAR) [J].Sci Total Environ,2012,433:1-7.
[18] YING Guang-guo,Kookana R,Waite T D.Australian Water Conservation and Reuse Research Program:Endocrine Disrupting Chemicals (EDCs) and Pharmaceuticals and Personal Care Products (PPCPs) in Reclaimed Water in Australia [M].Sydney:CSIRO &AWA,2004.
