5种杀菌剂对沙打旺黄矮根腐病菌的室内毒力测定
2013-12-01李兴龙李彦忠
李兴龙,李彦忠
(草地农业生态系统国家重点实验室 兰州大学草地农业科技学院, 甘肃 兰州 730020)
5种杀菌剂对沙打旺黄矮根腐病菌的室内毒力测定
李兴龙,李彦忠
(草地农业生态系统国家重点实验室 兰州大学草地农业科技学院, 甘肃 兰州 730020)
沙打旺黄矮根腐病(Embellisiaastragali)是我国近年发现的沙打旺(Astragalusadsurgens)上最严重的病害,其病菌生活在植株体内,至今尚无有关其化学防治的研究报道。本研究选择了百菌清、甲霜灵、代森锰锌、甲基硫灵菌和三唑酮5种杀菌剂,采用菌落生长抑制法和孢子萌发抑制法测定了对该病菌的防治效果。供试杀菌剂对沙打旺埃里砖格孢的菌落生长、孢子萌发和菌丝伸长均产生一定影响,在3个指标测定中EC50由小到大的顺序均为百菌清lt;甲霜灵lt;代森锰锌lt;甲基硫灵菌lt;三唑酮,其中百菌清在菌落生长、孢子萌发和菌丝伸长试验中的EC50分别为0.028、0.03和0.04 g·L-1,而三唑酮的为0.46、0.48和0.21 g·L-1。
杀菌剂;沙打旺埃里砖格孢;抑制作用;菌落生长; 孢子萌发;菌丝伸长
沙打旺(Astragalusadsurgens)是黄芪属多年生豆科牧草,不仅具有适应性广、抗逆性强、适口性好和蛋白质含量高等优良特性[1],而且还可以起到保持水土、改良土壤和涵养水源等作用,对改善环境、开展退化植被恢复和发展农牧业生产均具有重要意义[2]。
病害是造成沙打旺产量、品质降低和草地利用年限缩短的主要原因之一[2-7],沙打旺埃里砖格孢引起的沙打旺黄矮根腐病(Embellisiaastragali)是沙打旺上发生的一种毁灭性病害,使草地建植不良,并引起早衰,不仅严重缩短草地利用年限,还大大降低草地生产力、种子产量和牧草品质[8-10]。该病菌可以寄生于植株全株,种带病菌为该病的初侵染来源,以休眠菌丝广泛分布于种皮内部,并随着种子萌发扩展到幼苗根颈部、下胚轴、子叶和真叶中。菌丝在种皮内部、病株的茎基部、根部以及在死亡植株表面越冬,茎基部越冬菌丝随着枝条的伸长到达叶柄、叶片、穗轴和子房中。病菌通过种子带菌远距离传播,在死亡植株表面产生的大量分生孢子随着气流和雨水飞溅传播。孢子遇水萌发可以侵染寄主植物的任何部位,在田间主要通过茎基部入侵[11-13]。病害一旦入侵,寄主植物则终生带菌,引起植物连年发病直至死亡,且土壤水分越高、草地建植年限越久、植株密度越大,病害发生越严重[13-14]。
控制植物病害的方法主要有抗病品种的选育[14-15]、改善和优化农艺措施、物理方法防治、生物方法防治和化学药剂防治[16]。抗病品种选育费时费力、选育的时间周期较长,而且存在着种质退化和遗传变异的不确定性。化学防治因其作用迅速、效果显著和方法简便等优点,在目前的各种防治方法中发挥着重要的作用,尤其是在病害已经严重发生或是即将大面积流行的时候[17]。在农业生态系统中,长时间连续使用同一类杀菌剂,容易诱发病菌产生抗药性,降低杀菌剂的杀菌效果。因此,掌握杀菌剂的安全用药知识,科学、合理地选择多种作用机理不同的杀菌剂,能够更好地发挥作用,有效防治病害的发生和发展[18]。
然而,自该病害发生至今,尚无化学药剂防治该病的相关报道。因此,筛选出数种抑菌效果较佳的化学药剂,施用于病害发生的不同阶段对于沙打旺黄矮根腐病的预防和治理具有重要意义。本研究在实验室条件下,通过研究不同药剂对沙打旺黄矮根腐病的病原菌沙打旺埃里砖格孢的菌落生长、孢子萌发和菌丝伸长的抑制作用,旨在筛选出抑菌效果较好的杀菌剂,以期为沙打旺黄矮根腐病的田间防治提供理论依据。
1 材料与方法
1.1试验材料
1.1.1供试菌种 菌种沙打旺埃里砖格孢分离自甘肃环县(37°07′ N、106°49′ E,海拔1 650 m)的沙打旺黄矮根腐病病株,在麦秆煎液琼脂培养基(WHDA)上纯化后置于25 ℃培养箱恒温培养2~3个月[10](称取小麦秸秆20 g用自来水冲洗干净后置于锅内注水加热煮沸约40 min后,取其浸出液加入17 g琼脂定容至1 L制成培养基)。
1.1.2供试杀菌剂 供试的5种杀菌剂购自兰州市安宁区农药市场,均为可湿性粉剂(表1)。
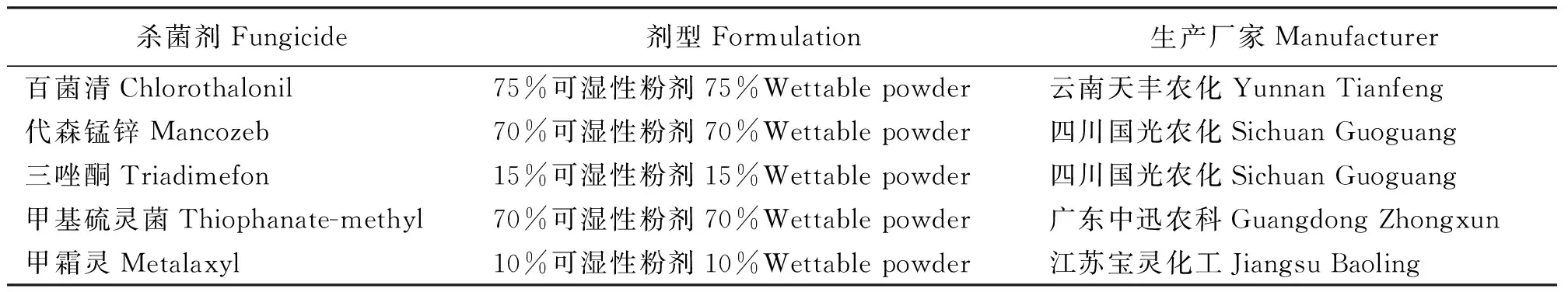
表1 供试杀菌剂的剂型和生产厂家Table 1 Information of fungicide used in this study
1.2试验方法
1.2.1含药平板的制备 根据每种参试杀菌剂的有效成分,计算配制所需浓度杀菌剂的用药量,在精度为0.001 g的电子天平上称取所需药量溶于无菌水中,充分溶解后用移液器移入灭菌培养皿,而后将灭菌后冷却至50 ℃的WHDA培养基倒入含药培养皿中,轻微振荡,使药液与培养基均匀混合[19-20]。预实验中,5种杀菌剂均设置3个不同浓度梯度(0.1、0.5和1.0 g·L-1),其中百菌清、代森锰锌和甲霜灵抑菌效果过强,菌落几乎无法扩展,而三唑酮和甲基硫灵菌抑菌效果相对较弱,菌落生长过快,故在正式实验中将药剂设置为5个浓度梯度(百菌清、代森锰锌和甲霜灵3种药剂均设置为0.01、0.02、0.05、0.08和0.10 g·L-1;三唑酮和甲基硫灵菌两种药剂均设为0.10、0.50、0.80、1.00和1.50 g·L-1)共25个处理,每个处理设4个重复,以不含药的等量无菌水处理的平板作为空白对照。
1.2.2菌饼接种 取培养两个月的沙打旺埃里砖格孢真菌纯培养物,用灭过菌的直径为6 mm的打孔器在菌落边缘钻取菌饼,接种于含有杀菌剂的WHDA培养基的中央,每皿接一个菌饼[21],以无药培养基作为对照,而后移入20 ℃黑暗恒温培养箱培养。
1.2.3菌落直径的测量 用游标卡尺采用十字交叉法测量菌落的直径,每7 d测量一次,连续测量2~4次。
1.2.4孢子悬浮液的制备 对沙打旺埃里砖格孢真菌纯培养物进行镜检,选取大量产孢的纯培养物,用灭过菌的载玻片将菌丝从培养基表面轻轻刮下,用无菌水冲洗,双层无菌纱布过滤,用血球计数板调至浓度为每毫升1×106个孢子[13]。
1.2.5孢子萌发与菌丝生长的抑制 用移液器吸取孢子悬浮液与药液各0.05 mL,加入灭过菌的双凹片使其混合均匀,凹槽上面覆盖洁净盖玻片。在灭过菌的直径为90 mm的培养皿底部铺两张无菌滤纸,加入无菌水使滤纸充分浸透,将双凹片放入培养皿于25 ℃恒温箱内黑暗保湿培养,每个处理设4个重复[20-22]。
分别于恒温黑暗培养12 h和24 h后,置于100倍显微镜下观察分生孢子的萌发情况(芽管长度超过孢子直径的1/2即为萌发),随机观察300个左右的孢子,统计孢子总数及萌发的孢子总数[23]。
在恒温黑暗条件下培养24 h后,用经校准的带有测微尺的显微镜于100倍镜头下随机测量50个孢子萌发后伸出的菌丝的长度[23]。
菌落生长的相对抑制率=[(对照菌落直径-处理菌落直径)/(处理菌落直径-菌饼直径)]×100%;
孢子萌发率=(萌发的孢子数/孢子总数)×100%;
孢子萌发的相对抑制率=[(对照孢子萌发率-处理孢子萌发率)/对照孢子萌发率]×100%;
菌丝生长的相对抑制率=[(对照菌丝长度-处理菌丝长度)/对照菌丝长度]×100%。
以药剂浓度的对数为自变量,查阅抑制率-机率值表,以相对抑制率对应的机率值为因变量,进行线性回归,根据回归方程求得EC50[24]。
1.3统计分析 采用SPSS 17.0 统计分析软件进行差异显著性分析和相关性分析。
2 结果与分析
2.1杀菌剂对菌落生长的抑制 与对照相比,5种杀菌剂均显著地抑制了埃里砖格孢菌落的生长(Plt;0.05),且随着药剂浓度的增大相对抑制率增加,且同种杀菌剂对菌落生长的抑制作用在不同浓度之间差异显著(Plt;0.05)。
杀菌剂浓度在0.01~0.10 g·L-1内,百菌清、甲霜灵和代森锰锌对埃里砖格孢菌落生长的相对抑制率分别为28.40%~85.45%、13.60%~95.50%和16.05%~92.05%。同一浓度的百菌清、甲霜灵和代森锰锌对菌落生长的抑制作用差异显著(Plt;0.05)(表2)。
杀菌剂浓度在0.10~1.50 g·L-1内,三唑酮和甲基硫灵菌对埃里砖格孢菌落生长的相对抑制率分别为11.25%~88.70%和8.50%~94.50%。同一浓度的三唑酮和甲基硫灵菌对菌落生长的抑制作用差异显著(Plt;0.05)(表2)。
5种杀菌剂对埃里砖格孢菌落生长抑制作用的EC50值大小排列顺序为百菌清lt;甲霜灵lt;代森锰锌lt;甲基硫灵菌lt;三唑酮(表3)。
2.2杀菌剂对孢子萌发的抑制 与对照相比,5种杀菌剂均显著地抑制了埃里砖格孢孢子的萌发(Plt;0.05),且随着药剂浓度的增大相对抑制率增加,同种杀菌剂对孢子萌发的抑制作用在不同浓度之间差异显著(Plt;0.05)(表4)。
杀菌剂浓度在0.01~0.10 g·L-1内,百菌清、甲霜灵和代森锰锌对埃里砖格孢孢子萌发的相对抑制率分别为35.40%~63.30%、24.20%~50.20%和20.10%~41.60%。同一浓度的百菌清、甲霜灵和代森锰锌对孢子萌发的抑制作用差异显著(Plt;0.05)(表4)。
杀菌剂浓度在0.10~1.50 g·L-1内,三唑酮和甲基硫灵菌对埃里砖格孢孢子萌发的相对抑制率分别为33.80%~56.80%和24.20%~65.20%。同一浓度的三唑酮和甲基硫灵菌对孢子萌发的抑制作用差异显著(Plt;0.05)(表4)。
5种杀菌剂对埃里砖格孢孢子萌发抑制作用的EC50值大小排列顺序为百菌清lt;甲霜灵lt;代森锰锌lt;甲基硫灵菌lt;三唑酮(表5)。
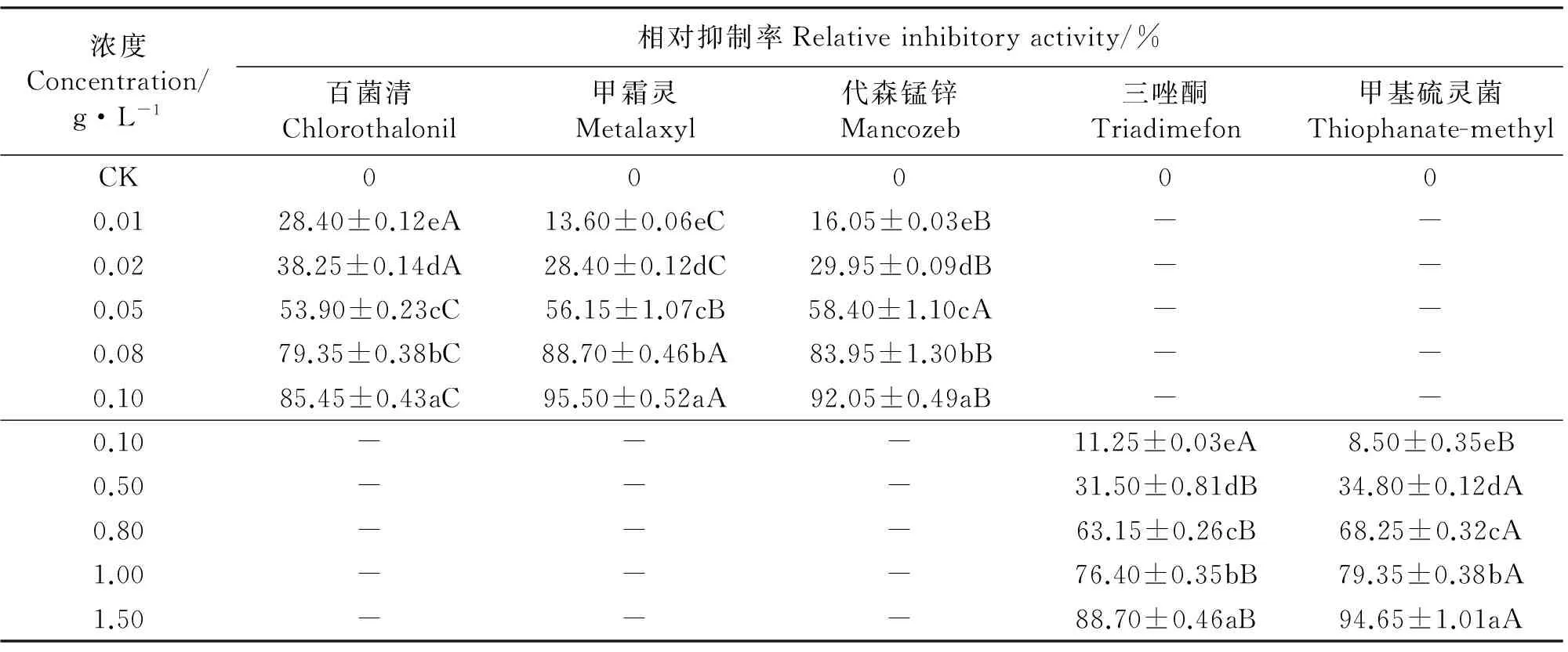
表2 杀菌剂对菌落生长的影响Table 2 Effects of of fungicides on colonal growth
注:表中数据为平均值±标准误。同列不同小写字母表示同一药剂不同浓度间差异显著(Plt;0.05),同行不同大写字母表示同一浓度不同药剂间差异显著(Plt;0.05)。表4、表6同。
Note:Data in table are Mean±SE. Different lower case letters within a column indicate significant difference among different concentration treatments of the same fungicide at 0.05 level. Different capital letters within a row indicate significant difference among different fungicides with the same concentration at 0.05 level. The same in Table 4 and Table 6.

表3 菌落生长试验得到的供试杀菌剂的毒力回归方程Table 3 Regrssion equations obtained from colonial growth test
注:Y为相对抑制率对应的机率值,X为药剂浓度的对数。下表同。
Note:Y,possibility of relative inhibitory activity;X,logarithm of fungicide concentration.The same below.
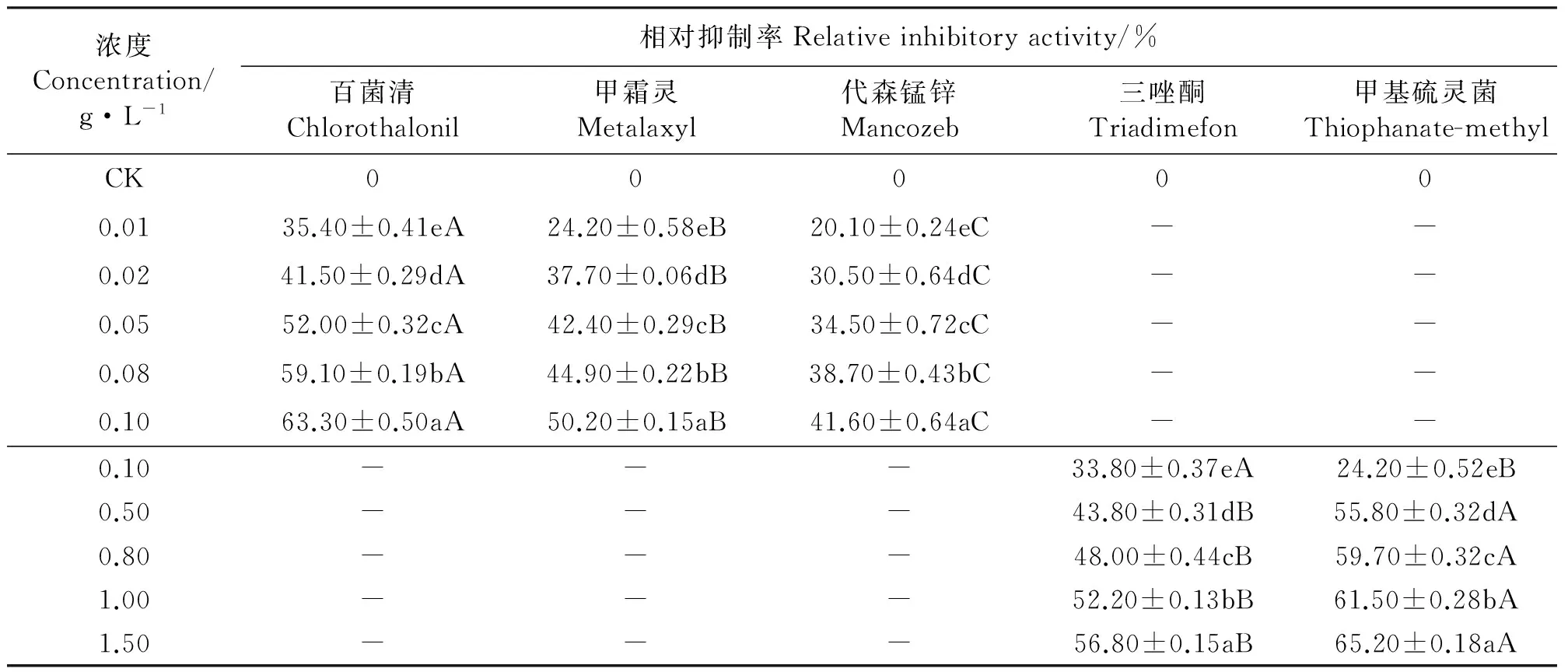
表4 杀菌剂对孢子萌发的影响Table 4 Effects of of fungicides on spore germination
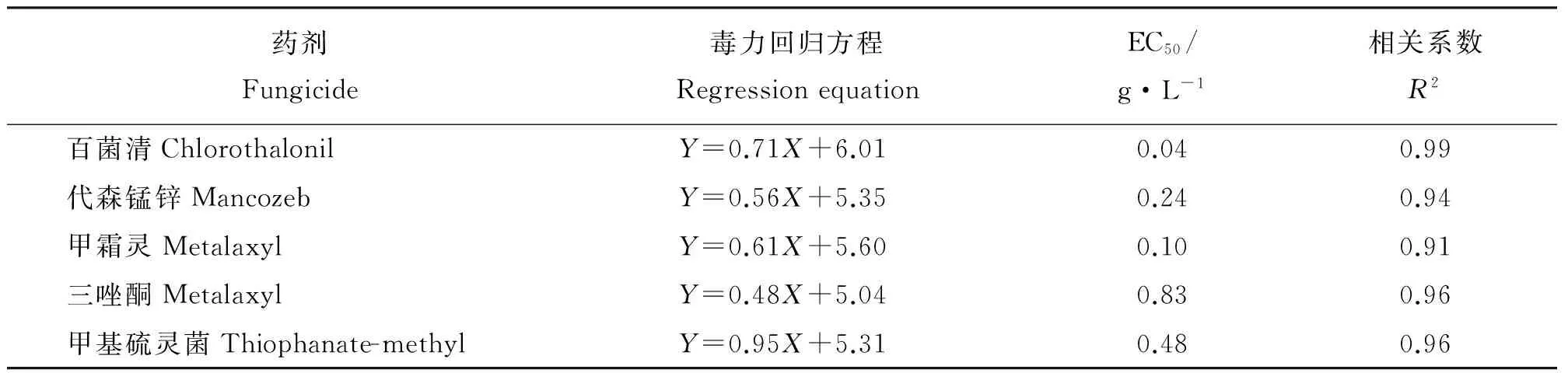
表5 孢子萌发试验得到的供试杀菌剂的毒力回归方程Table 5 Regrssion equations obtained from spore germination test
2.3杀菌剂对菌丝伸长的抑制 与对照相比,5种杀菌剂均显著地抑制了埃里砖格孢菌丝的伸长(Plt;0.05),且随着药剂浓度的增大相对抑制率增加,同种杀菌剂对菌丝伸长的抑制作用差异显著(Plt;0.05)(表6)。
杀菌剂浓度在0.01~0.10 g·L-1内,百菌清、甲霜灵和代森锰锌对埃里砖格孢菌丝伸长的相对抑制率分别为23.92%~69.74%、10.82%~58.09%和16.14%~53.23%。同一浓度的百菌清、甲霜灵和代森锰锌对菌丝伸长的抑制作用差异显著(Plt;0.05)(表6)。
杀菌剂浓度在0.10~1.50 g·L-1内,三唑酮和甲基硫灵菌对埃里砖格孢菌丝伸长的相对抑制率分别为4.67%~70.95%和39.40%~84.34%。同一浓度的三唑酮和甲基硫灵菌对菌丝伸长的抑制作用差异显著(Plt;0.05)(表6)。
5种杀菌剂对埃里砖格孢菌丝伸长抑制作用的EC50值大小排列顺序为百菌清lt;甲霜灵lt;代森锰锌lt;甲基硫灵菌lt;三唑酮(表7)。
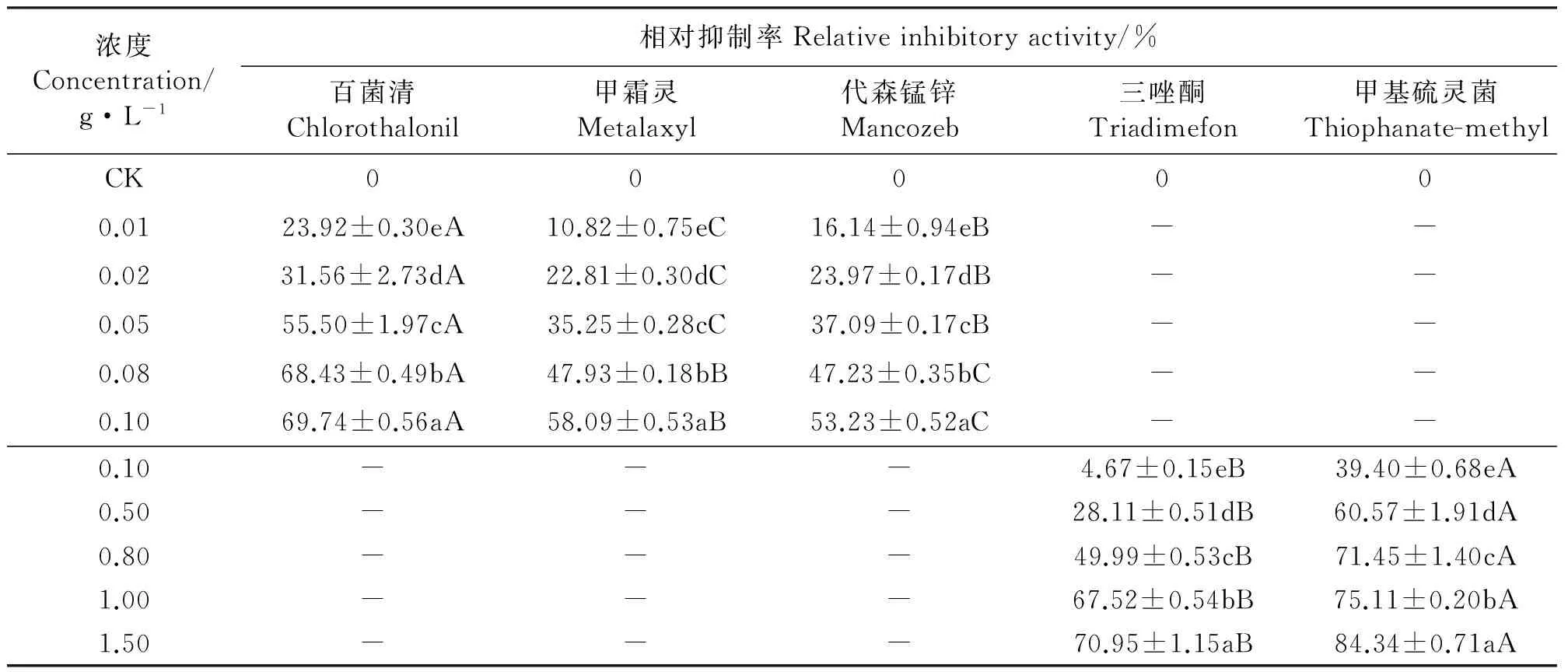
表6 杀菌剂对菌丝伸长的影响Table 6 Effects of of fungicides on hypha elongation
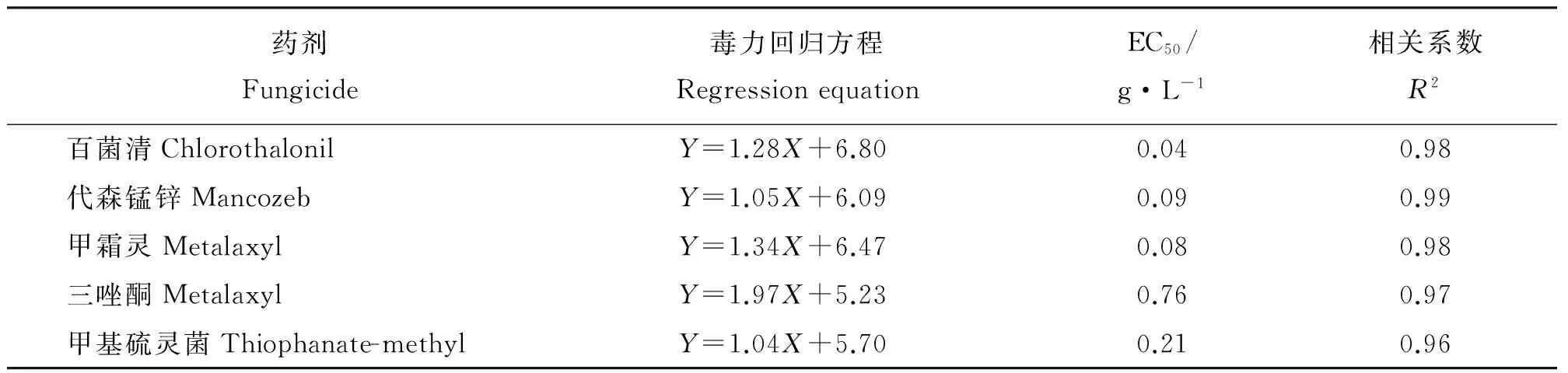
表7 菌丝伸长抑制试验得到的供试杀菌剂的毒力回归方程Table 7 Regrssion equations obtained from hypha elongation test
3 讨论
百菌清、甲霜灵、代森锰锌、甲基硫灵菌、三唑酮这5种供试杀菌剂对埃里砖格孢菌的菌落生长、孢子萌发和菌丝伸长均具有不同程度的抑制作用。其中,对菌落生长的抑制作用、抑菌效果最好的为0.10 g·L-1的甲霜灵,其相对抑菌率高达95.50%,其次为代森锰锌和百菌清,这3种药剂对埃里砖格孢菌菌落生长抑制作用的有效中浓度(EC50)接近,约为0.030 g·L-1,抑菌效果较差的药剂为甲基硫灵菌,最差的为三唑酮。对埃里砖格孢菌孢子萌发的抑制作用、抑菌效果最佳的百菌清,其次为代森锰锌和甲霜灵,效果最差的为甲基硫灵菌和三唑酮。对菌丝伸长的抑制作用最好的为百菌清,其次为甲霜灵和代森锰锌。
百菌清的作用机理是通过与磷酸甘油醛脱氢酶的-SH结合,使其失去催化3-磷酸甘油醛/磷酸二羟丙酮形成1,3-二磷酸甘油醛的功能,从而使病原菌的能量供应受阻,孢子不能萌发。甲霜灵属苯基酰胺类内吸性杀菌剂,在植物体内具有双向输导的性能,其作用机理是抑制病原菌rRNA的生物合成,进而阻止菌丝生长和孢子形成。代森锰锌属二硫代氨基甲酸盐类广谱保护性杀菌剂,其作用机理是抑制菌体内丙酮酸的氧化使病原菌的能量供应受阻[25]。
有研究表明,百菌清能有效降低菜豆炭疽病的发生,提高产量[26]。本研究中百菌清对埃里砖格孢菌孢子萌发的抑制作用最强,这与前人测定咖啡炭疽病对杀菌剂敏感性的结果相似[27],但在对咖啡树疱状斑病的田间防效研究中,百菌清的防治效果较好,代森锰锌的防治效果较差[28],这可能是因为田间药效的发挥与气象、病原和杀菌剂剂型等多种因素有关。前人在对桃树叶部病害的防治研究中发现,百菌清、代森锰锌、甲基硫灵菌均能有效降低桃树的锈病和落叶病,其中百菌清对叶部病害的防治效果最佳,而代森锰锌和甲基硫灵菌对穿孔病的防治效果较好[29]。在本研究中,甲霜灵、代森锰锌和百菌清的抑菌效果较好,甲基硫灵菌和三唑酮效果不佳,这与前人对紫花苜蓿褐斑病、天堂草叶疫病、香荚兰根腐病、匍匐翦股颖褐斑病和柱花草炭疽病药剂筛选研究的结果一致[30-34],但与季延平等[35]、张金林等[36]研究不同杀菌剂对草坪草病原菌毒力测定的研究以及张翠玲和刘爱琴[37]对香草兰根(茎)腐病杀菌剂筛选研究的结果不同,这可能与不同病原菌对不同药剂的敏感性不同有关。
相关研究表明,甲霜灵能有效防治葡萄霜霉病[38]和柑橘炭疽病的发生,而且树龄越小,防治效果越好[39]。有人用杀菌剂对高粱种子进行药剂拌种,结果表明,杀菌剂能有效降低种带真菌的侵染,其中甲霜灵对青霉、链格孢、茎点霉、新月弯孢和内脐蠕孢均有较好的抑制作用[40]。前人将代森锰锌和戊唑醇混合施用,有效地防治了由刺盘孢炭疽菌引起的苹果叶斑病的为害,极大减少了叶片的脱落[41]。相关研究结果还表明,代森锰锌能有效减轻大豆锈病[42]和由链格孢引起的橘柚褐斑病的发生[39],农田混作结合代森锰锌喷施可以有效防治蚕豆赤斑病的发生[43]。
埃里砖格孢菌的气生菌丝较少,而基质内的菌丝较多,基质内菌丝的扩展比其在基质表面菌丝的扩展速度快,因此菌落直径的增加主要是基质内菌丝的生长引起的[13]。菌丝作为真菌生长的营养体,可以直接从环境中吸收养分,具有输送和贮存养分的功能,并为无性繁殖和有性生殖做准备[16]。因此,在埃里砖格孢菌侵入以后至寄主植物发病之前可使用甲霜灵等内吸性杀菌剂,终止或解除病原物与寄主的寄生关系,抑制或杀死植物体内外的病原物,阻止发病。甲霜灵具备被植物吸收和输导的内吸性,不仅能治疗已经被病菌侵染的组织,还能保护植物新生组织免遭病菌侵害。同时,甲霜灵具备高度选择性,因此可以用于处理沙打旺种子,从而防治黄矮根腐病的发生。
孢子是植物病原真菌生存、越冬、传播和侵染的主要形式,在播种当年秋季的死亡幼苗和病株上,发病植株的叶片、叶柄和茎秆上产生的埃里砖格孢菌的分生孢子将作为次年初侵染来源。分生孢子随着气流和雨水或灌溉传播到邻近植株的茎基部土壤表面,孢子萌发后直接侵入茎秆基部,这是造成植株发病的主要原因[13]。百菌清和代森锰锌对埃里砖格孢菌孢子萌发的抑制作用最强,因此在埃里砖格孢菌侵染寄主植物之前,施用百菌清和代森锰锌等保护性药剂,可阻止真菌孢子的萌发,或干扰病菌与寄主的互作,从而阻止病菌的侵染,保护植物免遭病害。在供试的5种杀菌剂中,百菌清和代森锰锌两种杀菌剂对此病菌的毒力最强,可用于此病发生前控制病菌孢子的萌发与侵染,而甲霜灵、三唑酮和甲基硫灵菌等3种内吸性杀菌剂可用于植株发病后抑制体内菌丝的进一步扩展。
病原菌的不同生长发育期对能量的需要量不同,真菌孢子萌发比维持菌丝生长所需的能量多,因此抑制或干扰病菌能量生成的杀菌剂对孢子萌发的毒力一般也显著高于对菌丝生长的毒力[25]。本研究中百菌清对菌丝伸长抑制作用的EC50大于对孢子萌发抑制作用的EC50值,这一结果与前人研究结果相似。有研究表明,百菌清能有效地防治芒果茎腐病的发生,但不同浓度药剂的防治效果无显著差异[44]。在本研究中,杀菌剂对于埃里砖格孢菌菌落生长、菌丝伸长和孢子萌发的抑制作用随着药剂浓度的增大而增强,且各供试药剂的不同浓度之间抑制作用差异显著,这与前人的研究结果不同,可能是由于供试病原物以及供试药剂所设置的浓度梯度不同而导致的结果。同一药剂对埃里砖格孢菌菌落生长、菌丝伸长和孢子萌发抑制作用的EC50不同,这可能是因为不同测定方法测得的结果不同,也可能与杀菌剂各自的作用机理不同有关,有待进一步研究验证。
[1] 于福科,黄新会,马永清,等.不同生长时期沙打旺不同部位及其植株的化感作用研究[J].草业学报,2008,17(5):76-83.
[2] 尹亚丽,南志标,李春杰.沙打旺根部入侵真菌的研究[J].草原与草坪,2006(1):45-53.
[3] 赵明轩.庆阳地区沙打旺病害调查报告[J].草与畜杂志,1995(1):33-34.
[4] 南志标.沙打旺种带真菌——环境、致病力及防治[J].草业学报,1998,7(1):12-18.
[5] 南志标,刘若.我国五省(区、市)的沙打旺病害及其分布特征[J].草业科学,1997,14(6):30-34.
[6] 聂素梅,孙启忠,闫志坚,等.影响沙打旺生长衰退诸因素试验研究[J].内蒙古草业,2002,14(3):36-38.
[7] 孙启忠,桂荣.科尔沁沙地沙打旺草地衰退规律与恢复技术研究[J].草地学报,2000,8(4):254-261.
[8] Li Y Z,Nan Z B.A new species,Embellisiaastragalisp.nov.,causing standing milk-vetch disease in China[J].Mycologia,2007,99(3):406-411.
[9] Li Y Z,Nan Z B.Symptomology and etiology of a new disease,yellow stunt,and root rot of standing milkvetch caused byEmbellisiasp. in northern China[J].Mycopathologia,2007,163(6):327-334.
[10] Li Y Z,Nan Z B.Nutritional study onEmbellisiaastragali,a fungal pathogen of milk vetch (Astragalusadsurgens)[J].Antonie Van Leeuwenhoek International Journal of General and Molecular Microbiology,2009,95(3):275-284.
[11] Li Y Z,Nan Z B,Hou F J.The roles of anEmbellisiasp causing yellow stunt and root rot ofAstragalusadsurgensand other fungi in the decline of legume pastures in northern China[J].Australasian Plant Pathology,2007,36(4):397-402.
[12] 李彦忠,南志标,张志新,等.沙打旺黄矮根腐病在我国北方5省区的分布与危害[J].草业学报,2011,20(2):39-45.
[13] 李彦忠.沙打旺黄矮根腐病的研究[D].兰州:兰州大学,2007.
[14] 俞斌华,南志标,李彦忠.沙打旺苗期对黄矮根腐病菌的抗性评价[J].草业科学,2011,28(7):1301-1306.
[15] Yu B H,Nan Z B,Li Y Z.Resistance of standing milkvetch (Astragalusadsurgens) varieties toEmbellisiaastragali[J].Crop amp; Pasture Science,2012,63(4):351-359.
[16] 许志刚.普通植物病理学[M].北京:中国农业出版社,2003:344-357.
[17] 张兴,王兴林,冯纪年.西北地区农作物病虫草害药剂防治技术指南[M].西安:陕西科学技术出版社,1992:1.
[18] 薛福祥.草地保护学(第三分册)牧草病理学病理学[M].第三版.北京:中国农业出版社,2008:89-90.
[19] 李健强,刘洪斌,刘西莉,等.5种药剂对小麦光腥黑穗病菌的毒力和孢子萌发形态结构的影响[J].农药学学报,2000(1):41-46.
[20] 方中达.植病研究方法[M].第三版.北京:农业出版社,1998:151-154.
[21] 康天芳.几种杀菌剂对甜瓜蔓枯病的室内毒力测定[J].甘肃农业大学学报,2002(1):78-81.
[22] 张红玉,杨斌,何月秋.毒素诱导挥发物对紫茎泽兰致病菌孢子萌发和菌丝生长的影响[J].草业科学,2010,27(5):101-105.
[23] 杨松,李春杰,黄玺.被内生真菌侵染的禾草提取液对真菌的抑制作用[J].菌物学报,2010,29(2):234-240.
[24] 王治江,刘中元,贾改秀,等.杀菌剂对串珠廉孢亚粘团变种菌丝生长、产孢、孢子萌发及芽管生长的影响[J].西北农业学报,2008,17(4):168-172.
[25] 徐汉虹.植物化学保护学 [M].第四版.北京:中国农业出版社,2007:117-167.
[26] Garcia A,De Souza P E,Pozza E A,etal.Influence of the environmental variables in the progress of anthracnose of bean and efficiency of thiophanate methyl plus chlorothalonil in the control of the disease[J].Ciência e Agrotecnologia,2007,31(6):1709-1715.
[27] Ferreira J B,De Abreu M S,Pereira I S,etal.Sensibility ofColletotrichumgloeosporioides(coffee blister spot) to different fungicide concentrations[J].Ciência e Agrotecnologia, 2009,33:2052-2058.
[28] Ferreira J B,De Abreu M S,Pereira I S,etal.Effect of fungicides and influence of climatic factors on the blister spot of coffee trees[J].Ciência e Agrotecnologia,2009,33(2):417-424.
[29] Alves G,Ferreira G M,de Mio L L M.Temporal progress of peach rust and fungicides to control the foliar diseases of peach tree[J].Revista Brasileira De Fruticultura,2011,33(1):436-440.
[30] 陈申宽,姚国君.紫苜蓿褐斑病药剂防治试验[J].草业科学,1993,10(6):27-29.
[31] 向梅梅,钟晓平.惠州高尔夫球场天堂草叶疫病菌鉴定及防治药剂的初步筛选[J].草业科学,1999,16(2):58-61.
[32] 孔琼,朱春燕,王廷美,等.四种杀菌剂对香荚兰根腐病菌的室内毒力测定[J].广西农业科学,2005,36(5):458-459.
[33] 孙晓燕,王兆龙,陈雅君.华东地区匍匐翦股颖褐斑病杀菌剂的田间防治效果[J].草业科学,2008,25(6):89-92.
[34] 张伟丽,刘凤民,张雅君,等.3种不同杀菌剂对柱花草炭疽病的室内及盆栽防治效果[J].广东农业科学,2009(8):14-17.
[35] 季延平,吴玉柱,刘殷,等.几种药剂对几种草坪草病害病原菌毒力测定[J].山东林业科技,2002(1):19-22.
[36] 张金林,庞民好,刘颖超,等.不同杀菌剂对草坪草病原菌毒力的作用测定[J].草业学报,2006,15(1):58-61.
[37] 张翠玲,刘爱勤.香草兰根(茎)腐病室内有效杀菌剂的筛选[J].热带作物研究,1998(2):9-12.
[38] Duker A,Kubiak R.Stem application of metalaxyl for the protection ofVitisviniferaL.(‘Riesling’) leaves and grapes against downy mildew (Plasmoparaviticola)[J].Vitis,2009,48(1):43-48.
[39] Alvarez L A,Vicent A,Soler J M,etal.Comparison of application methods of systemic fungicides to suppress branch cankers in clementine trees caused byPhytophthoracitrophthora[J].Plant Disease,2008,92(9):1357-1363.
[40] de Almeida Pinto N F J.Evaluation of the efficiency of the fungicides fludioxonil plus metalaxyl-M in the treatment of sorghum seeds[J].Ciência e Agrotecnologia,2004,28(2):450-453.
[41] Kowata L S,Strapasson M,Challiol M A,etal.Glomerella leaf spot in apple:Validation of proposed diagrammatic scale and efficiency of fungicides[J].Ciência Rural,2010,40(7):1502-1508.
[42] Duarte H D S,Zambolim L,Rodrigues F D,etal.Potassium silicate,acibenzolar-S-methyl and fungicides on the control of soybean rust[J].Ciência Rural,2009,39(8):2271-2277.
[43] Sahile S,Fininsa C,Sakhuja P K,etal.Effect of mixed cropping and fungicides on chocolate spot (Botrytisfabae) of faba bean (Viciafaba) in Ethiopia[J].Crop Protection,2008,27(2):275-282.
[44] Júnior R S,Nunes G H S,De Lima L L,etal.Chemical control stem roe caused by lasiodiplodia theobromae on mangoes fruist[J].Revista Brasileira de Fruticultura,2009,31(3):907-910.
EfficacytestingoffivefungicidesagainstthepathogenofyellowstuntandrootrotofAstragalusadsurgensinlaboratory
LI Xing-long, LI Yan-zhong
(State Key Laboratory of Grassland Agro-ecosystems, College of Pastoral Agriculture Science and Technology, Lanzhou University, Lanzhou 730020, China)
Embellisiaastragaliis a stong and virulent pathogen that develops within milk vetch (Astragalusadsurgens).So far no research had been conducted on chemical controlling for this serious disease. This study assessed the efficacy of five fungicides onE.astragalusthrough inhibitory tests for colonal growth, spore germination and hypha elongation. The results showed that five tested fungicides all had reflected the colonal growth, spore germination and hypha elongation ofE.astragaluspartly. The order of concentration for 50% of maximal effect (EC50) was chlorothalonillt;metalaxyllt;mancozeblt;Thiophanate-methyllt;triadimefon within above 3 tests, the EC50of chlorothalonil on colonal growth, spore germination and hypha elongation was 0.028, 0.03 and 0.04 g·L-1respectively, the EC50of triadimefon was 0.46, 0.48 and 0.21 g·L-1respectively.
fungicide; embellisia astragalus; inhibitory effect; colonal growth; spore germination; hypha elongation
LI Yan-zhong E-mail:liyzh@lzu.edu.cn
S543+.908;S482.2
A
1001-0629(2013)10-1523-08
2013-01-14 接受日期:2013-02-27
全国优秀博士学位论文资助项目(201068);教育部博士点基金(20100211110013);国家自然科学基金(31272496公益性行业(农业)科研专项(201303057)作者简介:李兴龙(1987-),男,甘肃武威人,在读硕士生,研究方向为草地植物病害与治理。E-mail:lixinglong11@lzu.edu.cn
李彦忠(1969-),男,甘肃会宁人,教授,博士生导师,博士,主要研究方向为草地植物病理学。E-mail:liyzh@lzu.edu.cn
