人血小板生成素基因的克隆及CHO稳定细胞系的建立
2013-12-01马倩倩宋玲玲王红梅方永志王立群何洪彬
马倩倩,宋玲玲,王红梅,方永志 ,王立群,何洪彬
(1.东北农业大学 生命科学学院,黑龙江 哈尔滨 150030;2.山东省农业科学院 奶牛研究中心,山东 济南 250100;3.济南军区军犬训练大队,山东 济南 250100)
血小板生成素(Thrombopoietin,TPO)是刺激巨核细胞生长[1]及分化的内源性细胞因子,对巨核细胞生成的各阶段均有刺激作用[2],包括前体细胞的增殖和多倍体巨核细胞的发育及成熟,从而升高血小板数目。另外,TPO可直接作用于多功能造血干细胞,提高其分化和自我复制的能力[3];而当与红细胞生成素联合作用时,可促进幼红细胞系前体细胞的分化和增殖[4];还可以抑制造血干细胞和幼稚巨核细胞的细胞凋亡,因此TPO具有类“细胞生存因子”的作用。
TPO主要表达在肝和肾中[5],在正常情况下,肝细胞(可能包括肾脏)持续低水平分泌TPO以有效地维持血清中TPO的浓度,保证血小板止血功能[6]。血小板减少症是临床上治疗中遇到的重要问题之一,血小板减少症见于血小板减少性紫癜,脾功能亢进,血小板减少伴桡骨缺失综合症[7],再生障碍性贫血和恶性血液疾病和肿瘤等症。当肿瘤患者受到集中的化疗[8]和放疗后,骨髓将受到不同程度的抑制。骨髓抑制及其并发的贫血,粒细胞减少和血小板减少是造成患者死亡的主要因素,也是临床上限制放化疗计量,提高疗效的主要障碍。TPO是目前发现的唯一全程性参与巨核细胞增殖和分化的最基本的生长因子。因此为了治疗不同病因所引起血小板减少症,研究TPO具有很重要的临床意义。
1 材料与方法
1.1 材 料
1.1.1 菌株﹑质粒和菌种 人肝cDNA﹑pcDNA3.1(+)表达质粒、293T细胞、中国仓鼠卵巢细胞(CHO)均为山东省农业科学院奶牛研究中心保存,pEASY-T3,大肠杆菌感受态DH5α﹑BL21(DE3)均购自北京全式金生物技术有限公司。
1.1.2 工具酶和主要试剂 LA Taq酶﹑T4 DNA连接酶﹑限制性内切酶Hind Ⅲ和EcoRⅠ﹑dNTP﹑Marker DL10 000﹑质粒DNA纯化试剂盒﹑DNA胶回收试剂盒及均购自宝生物工程(大连)有限公司产品;低分子量蛋白Marker为Fermentas公司产品;转染试剂Lipofectamine2000、Dulbecco`s modified medium(DMEM)培养基、胎牛血清、G418购自Invitrogen公司;细胞基因组提取试剂盒(BioFlux);鼠抗人血小板生成素单克隆抗体购自Sino Biological Inc公司;辣根过氧化物酶标记羊抗鼠IgG、β-actin抗体均购自Sigma公司。
1.2 方 法
1.2.1 引物设计与合成 根据GenBank(U59493.1)上公布的人TPO mRNA完整的CDS基因序列设计一对特异性引物P1、P2,上游引物为:5'-CCAAGCTTGCCACCATGGAGCTGACTGAATTGCTCCTCG-3';下游引物为:5'-CGGAATTCTTACCCTTCCTGAGACAGATTCTGG-3'。P1含有酶切位点Hind Ⅲ(AAGCTT)及Kozark(GCCACC)序列;P2含有EcoR I(GAATTC)酶切位点。引物由上海生工生物工程技术服务公司合成。
1.2.2 hTPO基因克隆 以人肝cDNA为模板通过PCR扩增hTPO基因(50 μL体系):TaKaRa LA Taq(5 U/μL)0.5 μL﹑10×LA PCR BufferⅡ(Mg2+plus)5 μL﹑dNTP Mixture(2.5mM)8 μL﹑目的基因上下游引(20 μM)各2 μL﹑模板2 μL;灭菌ddH2O 30.5 μL。反应条件为:预变性94 ℃ 3 min﹑变性94 ℃ 30 s﹑退火60 ℃ 30 s﹑延伸72 ℃ 2 min﹑循环30次﹑72 ℃延伸8 min。取PCR产物5 μL于1%的琼脂糖凝胶电泳检测结果。
回收上述PCR产物后,克隆到载体pEASY-T3,转化感受态DH5α,次日筛选蓝白斑。挑取白色单克隆,用LB(+Amp)进行扩增培养,然后提取质粒进行PCR及单酶切鉴定。将鉴定正确的菌液送往上海生工生物技术有限公司测序,测序结果用DNAstar软件进行比对。
1.2.3 hTPO真核表达载体的构建和鉴定 测序正确的pEASY-T3-hTPO质粒和pcDNA3.1(+)分别用HindⅢ和EcoR I双酶切后回收目的片段,应用T4 DNA Ligase连接,转化感受态细胞DH5a。次日挑取单克隆,用LB(+Amp)扩增培养,提取质粒进行双酶切,将经酶切初步鉴定正确的质粒送往上海生工生物技术有限公司进行测序,用DNAstar软件分析测序结果。将测序正确的阳性质粒命名为pcDNA3.1(+)-hTPO。
1.2.4 pcDNA3.1(+)-hTPO转染293T细胞 将pcDNA3.1(+)-hTPO质粒及pcDNA3.1(+)空载分别转染293T细胞,转染步骤参照LipofectamineTM 2000转染说明书。经转染后的细胞培养48 h后,收集细胞,用鼠抗人TPO单抗进行Western blot检测,以判断重组质粒是否能够表达。
1.2.5 CHO细胞的G418浓度的确定 将正常培养的CHO细胞,稀释到48孔板中培养,细胞贴壁后其中一列(6孔平行)加入正常DMEM(含10%胎牛血清),另7列分别加入含有不同浓度的G418的DMEM(含10%胎牛血清),G418浓度分别为100、200、300、400、500、600、700 μg/mL。每三天换一次与之前相同的培养液,选择在第七天细胞全部死亡的最低G418浓度,作为下一步克隆筛选的浓度。
1.2.6 pcDNA3.1(+)-hTPO转染CHO细胞构建稳定表达细胞系 将pcDNA3.1(+)-hTPO转染CHO细胞。具体步骤参照1.2.4。细胞转染24 h后,加入含有G418的选择性培养液,每三天换液1次,直至长出清晰且相对较大的克隆,显微镜下挑单克隆于24孔板中继续培养,4 d后消化传代,取部分细胞留做作PCR验证及Western blot验证,根据Western blot结果确定真阳性。
2 结果与分析
2.1 hTPO基因的PCR扩增结果
以人肝cDNA为模板,用PCR获得hTPO的编码序列,经1%琼脂糖凝胶电泳检测,获得与预期结果一致的1 074 bp左右特异性片段 (图1)。
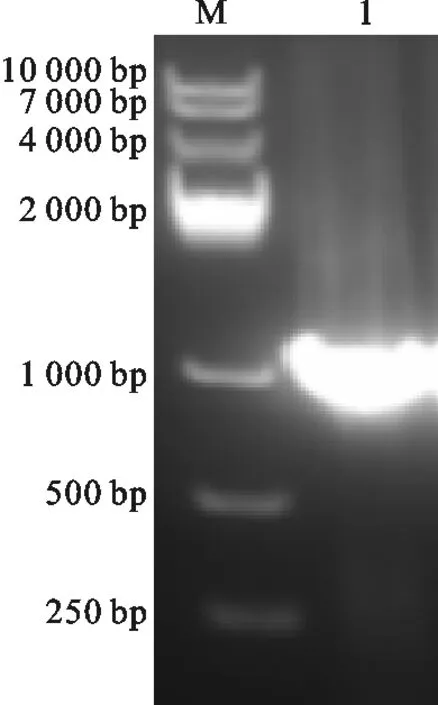
图1 hTPO基因的PCR扩增产物M.DNA 标记;1.hTPO基因的PCR产物Fig.1 PCR product of hTPO geneM.DNA Marker DL 10 000;1. PCR product of hTPO gene
2.2 hTPO真核表达载体的构建和鉴定
将PCR扩增的hTPO基因克隆到pEASY-T3载体上,测序正确后,经过双酶切和T4连接酶连接亚克隆到pcDNA3.1(+)载体上,用质粒提取试剂盒提取pcDNA3.1(+)-hTPO重组表达质粒,经Hind Ⅲ和EcoR I双酶切鉴定。可见在约1 074 bp(hTPO基因)和约5 400 bp处〔pETcDNA3.1(+)〕各出现一条特异性条带与预期目的条带大小基本一致(图2)。将酶切鉴定正确的重组质粒测序后,经BLAST比对正确。
2.3 转染293T细胞及Western blot检测
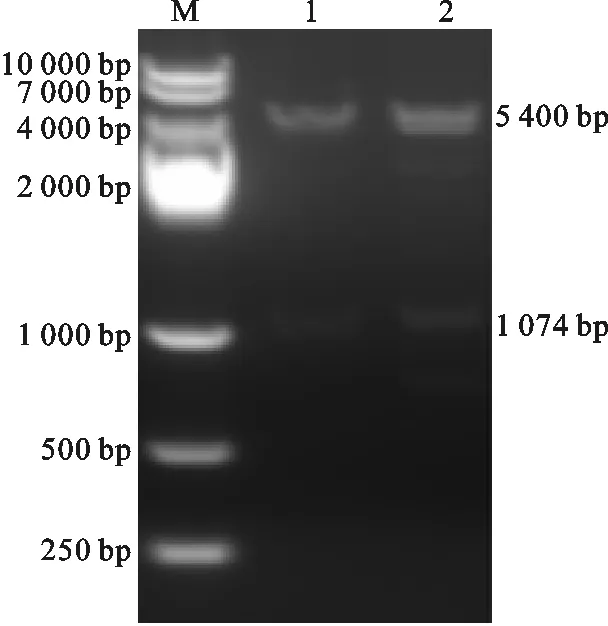
图2重组表达质粒pcDNA3.1(+)的双酶切鉴定
M.10 000 bp 的DNA标记;1,2. 21 074 bp的为hTPO,5 400左右大小的为pcDNA3.1(+)
Fig.2 Identification of recombinant ppcDNA3.1(+)-hT-PO plasmid digested by Hind Ⅲ/EcoR I
M.DNA Marker DL 10 000;1,2. Band 1 074 bp was hTPO gene,band 5 400 bp was pcDNA3.1(+)
将pcDNA3.1(+)-hTPO及pcDNA3.1空载分别转染293T细胞,应用鼠抗人TPO单抗Western blot检测蛋白是否表达。结果(图3)显示该重组质粒能够在293T细胞中表达hTPO蛋白,且大小在50~90 kD之间符合预期。
2.4 CHO细胞G418浓度的确定
经过试验确定CHO细胞的G418最低致死浓度为400 μg/mL。

图3 pcDNA3.1(+)-hTPO转染293T细胞Western blot1.pcDNA3.1(+)表达的蛋白;2. pcDNA3.1(+)-hTPO表达的蛋白Fig.3 The Western blot result of pcDNA3.1(+)-hTPO expressed in 293T1.expressed pcDNA3.1(+) protein;2.expressed pcDNA3.1 (+)-hTPO protein
2.5 转染CHO细胞构建稳定表达细胞系
挑取的克隆提取基因组经过PCR验证及测序确定阳性的克隆,用鼠抗人TPO单克隆抗体Western blot验证筛选出的CHO细胞株是否能够表达hTPO蛋白。由图4、图5知,3株细胞均能表达hTPO蛋白,且表达蛋白大小与预期一致,在50~90 kD之间。通过内参β-actin抗体检测3株细胞系表达蛋白水平有所差异,其中1株和4株β-actin蛋白表达量相当,但hTPO蛋白1株表达量大于4株。
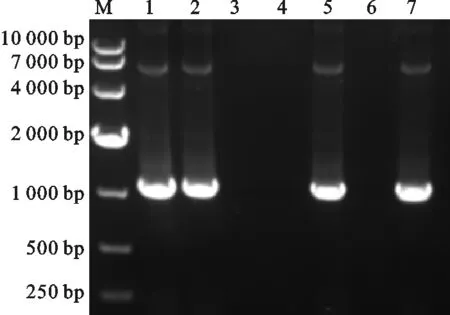
图4挑取克隆的PCR验证
M.10 000 marker;1.阳性对照;2.阴性对照;3.克隆 1;4.克隆 2;5.克隆 3
Fig.4 PCR identification of clones
M.10 000 marker; 1.positive control; 2.negtive control;3.clone 1; 4.clone 2; 5.clone 3
3 讨 论
本研究构建了pcDNA3.1(+)-hTPO真核表达质粒,经过瞬转293T细胞的Western blot首先确认了该重组质粒能够在真核细胞中表达,且表达的蛋白是在50~90 kD之间的单一条带。本研究所表达的蛋白的分子量与氨基酸推测的分子量不符,成熟的TPO分子是由332氨基酸组成,由氨基酸推测其蛋白分子量为35 kD。这是由于TPO蛋白的氨基端含有与受体结合的活性结构域和含有6~7个潜在的N-交联糖基化位点的碳端非活性结构域组成,导致TPO高度糖基化[9]。因此无论从血清中分离获得还是重组细胞培养上清分离获得的TPO,分子量一般在20~100 kD之间,而不是根据氨基酸推测的35 kD,从而也可能导致了碳末端虽与任何已知的蛋白质无同源性,缺失这种基因不会影响蛋白质的体外活性,但会降低其生物利用度。
hTPO蛋白是高度糖基化的蛋白,若预获得具有生物活性的hTPO蛋白,选择表达体系尤为重要。本试验选择了中国仓鼠卵巢细胞(Chinese Hamster Ovary,CHO),因为CHO具有准确的转录后修饰功能,表达的糖基化蛋白在分子结构、理化特性和生物学功能方面最接近于天然蛋白分子;其次,CHO细胞具有不死性,可传代百代以上,既可贴壁生长,又可悬浮培养,是目前生物工程上广泛使用的细胞。正式应用于人类疾病治疗或疾病预防的基因工程产品中许多产品均由CHO细胞生产(如EPO等)。CHO细胞属于成纤维细胞(fibroblast),是一种非分泌型细胞,它本身很少分泌CHO内源蛋白,因此对hTPO蛋白下阶段分离纯化工作十分有利。本研究将pcDNA3.1(+)-hTPO质粒转染CHO细胞,经过G418筛选获得了3株能够表达hTPO蛋白且表达水平不同的CHO细胞系,此3株细胞系经传代培养,均能够在含G418 400 μg/mL的DMEM中稳定生长,其中稳定细胞系1和稳定细胞系3贴壁生长最好。因此为下阶段hTPO蛋白的大量纯化提供多个细胞系选择。
临床上治疗血小板减少症所采取的手段主要是血小板输入法。血小板输入法虽可暂时减少出血事故,但必须经常性输入,费用庞大,而且还存在其他限制:首先,储存的血小板的寿命短,其次,有通过血液传染其它疾病的危险,以及异体免疫等问题。一般多次输血后,近70%的病人会对输入的血小板产生抗体,使以后的输血效率大大减小。TPO它不仅能比其它造血因子更有效地增加血小板水平,还具有促进其它造血细胞系活力的能力[10]。因此在临床上为了降低感染风险和治疗费用,减轻患者痛苦,研究hTPO基因工程药物具有重要的临床意义。
参考文献:
[1] Zheng C, Yang R, Han Z,et al. TPO-independent megakaryocytopoiesis[J]. Critical Reviews in Oncology/Hematology,2008,65(3):212-222.
[2] Kaushansky K.Thrombopoietin[J].N Eng J Med,1998,10:746.
[3] Solav G P,Kerr W G, Zeigler F C, et al. Role of cmpl in early hematopoietis[J]. Blood, 1998, 92: 4.
[4] Rouleau C, Cuik, Feldman L. A functional erythropoietin receptor is vecessary for the action of thrombopoietin on erythroidcells lacking c-mpl[J]. Exper Hemat, 2004, 32: 140-148.
[5] David J Kuter, Pamela Hunt, William Sheridan, et al. Throbopoiesis and thrombopoietins: Molecular, Cellular, Preclinical, and Clinical Biology[J]. Humana Press US,1997,70(3): 246-246.
[6] Kuter D J. Future directions with platelet growth factors[J]. Semin Hematol, 2000, 37(2): 41-49.
[7] Coppola A, Simone C D, Palmieri N M, et al. Recombinant activated factor VII for hemostatic cover of orthopedic interventions in a girl with thrombocytopenia with absent radii syndrome[J]. Blood Coagul Fibrinolysis,2007,18(2):199-201.
[8] Go R S, Johnston K L. Acute myelogenous leukemia in an adult with thrombocytopenia with absent radii syndrome[J]. Eur J Haematol,2003,70(4): 246-248.
[9] Muto T, Feese M D, Shimada Y O, et al. Functional analysis of the cterminal region of recombinant human thrombopoietin[J]. J Bio Chem,2000,275:12 090.
[10] Vadlhan-Raj S, Murray L J, Bueso-Ramos C, et al. Stimulation of megakaryocyte and platelet production by a single dose of recombinant human thrombopoietin in patients with cancer[J]. Ann Intern Med,1997,126:673.
