内质网应激在Bim介导缺氧致心肌细胞凋亡中的作用*
2013-12-01李菊香孙国芳吴延庆程晓曙
夏 珍, 李菊香, 丁 浩, 孙国芳, 洪 葵, 吴延庆, 程晓曙
(南昌大学第二附属医院心内科,江西省分子医学重点实验室,江西南昌330006)
唯BH3蛋白Bim(Bcl-2-interacting mediator of cell death)是Bcl-2家族中BH3-only亚家族的成员,仅有1个BH3同源结构域,是一种重要的凋亡调节蛋白。Bim广泛分布于机体各种组织中,与调节细胞凋亡的功能密切相关,具有促凋亡的活性。Bim的促凋亡活性受到严格调控,涉及多种信号通路。有研究表明,Bim蛋白通过磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶 B(protein kinase B,PKB/Akt)、丝裂原活化蛋白激酶激酶(mitogen-activitied protein kinase kinase,MEK)/细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号通路促进非小细胞癌的凋亡[1]。在Tan等[2]的研究中,利用慢病毒载体敲除bim基因,可通过Jun氨基末端激酶(Jun N-terminal kinase,JNK)信号通路抑制海洛因介导的神经细胞凋亡,表明Bim可通过JNK途径发挥促细胞凋亡作用。
近年来内质网凋亡信号通路越来越引人注目,内质网是真核细胞中蛋白质翻译合成的场所,是细胞内的钙库,而钙参与了众多细胞信号转导通路[3-4]。低血糖、缺氧、毒素等因素均能干扰内质网功能,使内质网蛋白大量合成从而导致蛋白错误折叠或过度负荷[5-6]。适当程度的内质网应激如分子伴侣的表达尚能保护细胞避免损伤,而过度内质网应激时,保护机制不能与损伤相抗衡,则会激活三磷酸肌醇/钙 (inositol 1,4,5-triphosphate/Ca2+,IP3/Ca2+)通道蛋白、c/EBP同源蛋白(c/EBP homologous protein,CHOP)和caspase-12的表达而诱导细胞凋亡[7]。最近发现Bcl-2家族中的一些成员在内质网中也有分布,并发挥促凋亡或抗凋亡作用。那么,在缺氧致心肌细胞损伤时,内质网又是如何参与这一过程,作为Bcl-2家族的唯BH3蛋白Bim又是怎样调节内质网这一凋亡途径的呢,值得进一步研究证实。
因此,本研究将Bim-siRNA转染心肌细胞沉默bim的表达,并给与缺氧处理,观察心肌细胞凋亡及内质网应激标志分子的表达情况,探讨内质网应激在Bim介导缺氧致心肌细胞凋亡中的作用。为临床防治心肌缺血缺氧损伤提供理论和实验依据,对研发新的保护心肌的药物作用分子靶点具有重要意义和广阔的前景。
材料和方法
1 材料
1.1 动物 出生1~3 d Sprague-Dawley大鼠,由南昌大学医学院实验动物科学部提供。
1.2 试剂 培养基DMEM和胎牛血清购自Hy-Clone;MTT细胞活性检测试剂盒购自 Ameresco。Annexin V-FITC细胞凋亡检测试剂盒购自南京凯基生物有限公司。总蛋白提取试剂盒购自普利莱基因技术有限公司。脂质体LipofectamineTM2000和BimsiRNA 购自 Invitrogen。I抗 Bim、IP3、caspase-12 及β-actin购自Santa Cruz。II抗辣根过氧化物酶IgG购自北京中杉金桥公司。
2 方法
2.1 原代心肌细胞培养及鉴定 取出生1~3 d乳鼠心脏,用含双抗(青霉素+链霉素)的磷酸盐缓冲液清洗3次,剥除筋膜、脂肪等多余组织,用剪刀将心脏剪成1 mm×1 mm×1 mm大小的组织,用0.08%胰酶和1.00%Ⅱ型胶原酶消化组织,离心收集细胞以15%胎牛血清的DMEM培养基充分重悬,200目滤网过滤细胞悬液至培养皿,置37℃、5%CO2培养箱培养,经差速贴壁2 h,使成纤维细胞贴壁。然后小心吸出未贴壁心肌细胞悬液接种到放有盖玻片的培养皿中,加入0.1%BrdU抑制成纤维细胞的增殖。24 h后第1次换液,48 h后取出玻片,用37℃ PBS漂洗,4%甲醛固定,加大鼠抗α-横纹肌肌动蛋白单克隆Ⅰ抗1∶50,于4℃湿盒过夜,加FITC羊抗小鼠IgG 1∶50,孵育30 min,缓冲盐水洗2次,DAPI封片剂染核,显微镜下观察。
2.2 缺氧模型的建立及转染 配置模拟缺氧溶液,以95%N2、5%CO2预饱和1 h,置换正常培养基,放入缺氧盒中通95%N2、5%CO230 min后密闭缺氧盒,放置于37℃孵箱中缺氧。我们通过前期实验,发现Bim在心肌细胞缺氧12 h表达最高。将Bim-siRNA和阴性对照siRNA通过脂质体转染乳鼠心肌细胞。按操作说明用不含血清的DMEM培养基稀释适当量的LipofectamineTM2000和Bim-siRNA混合形成转染试剂混合液,加入心肌细胞密度为90% 的6孔板中,轻轻摇晃混合。在5%CO2培养箱中培养6 h后换有血清的培养基培养。转染48 h后,将心肌细胞置于缺氧盒中缺氧12 h。实验分为5组:(1)正常对照组;(2)缺氧组;(3)缺氧+阴性对照siRNA组;(4)缺氧+脂质体组;(5)缺氧+Bim-siRNA组。Invitrogen公司设计合成了3对Bim-siRNA序列,将3对Bim-siRNA转染心肌细胞,筛选沉默效率最高的Bim-siRNA用于后续实验。siRNA-1上游引物5’-AACAGAUGUAAGUUAACGAUUUCCG-3’,下游引物5’-UGGUCAAUACUACAUGUGAUACCUU-3’。 siRNA-2上 游 引 物 5’-AACAGUUGUAAGAUAACCAUUUGCG-3’,下游引物 5’-CGCAAAUGGUUAUCUUACAACUGUU-3’。siRNA-3 上游引物 5’-ACAGAUUGUAGAUACAACAUUUGCG-3’,下游引物 5’-CAUGGUUCGUAAUACAACUGACUUU-3’。阴性对照序列上游引物5’-GUCCUCGACCUAGUUACGUTT-3’,下游引物5’-UCUAGACACAGUCGGAGAGTT-3’。
2.3 MTT法测定细胞活性 取96孔板种植细胞,种密度为1×105cells/well,空白孔加不含细胞的培养液(每组4孔)。经实验干预后,每孔加入20μL MTT溶液(5 g/L),避光,继续温育4 h,小心吸弃上清,终止培养,然后加入150μL DMSO,摇床震摇15 min,使结晶充分溶解,酶标仪读取492 nm处吸光度(A),实验结果以细胞活性表示。细胞活性(%)=处理组A值/对照组A值×100%。
2.4 流式细胞术检测细胞凋亡率 转染48 h、缺氧12 h后用胰酶消化收集各组细胞。按Annexin VFITC试剂盒提供的操作说明,主要步骤为:用胰酶消化收集细胞,PBS洗涤细胞 2次,加入 500μL Binding Buffer重悬细胞,分别加入 Annexin V-FITC及PI各5μL混匀,室温避光反应5~15 min后,在1 h内进行流式细胞仪检测各组细胞凋亡率。
2.5 流式细胞术检测细胞内钙离子浓度 转染48 h、缺氧12 h后用胰酶消化收集各组细胞。按Fluo-3 AM(钙离子荧光探针)试剂盒提供的操作说明,主要步骤为:用500μL HEPES缓冲液重悬细胞,取1μL Fluo-3 AM溶液加入细胞悬液中(Fluo-3 AM常用浓度为0.5~5 mmol/L),在37℃、5%孵箱中孵育60 min进行荧光探针装载,HEPES缓冲液洗涤后再孵育20~30 min,已确保Fluo-3 AM在细胞内完全转变成Fluo-3。之后进行流式细胞术检测各组细胞内钙离子浓度。以平均荧光强度(mean fluorecence intensity)反映细胞内游离Ca2+浓度。
2.6 Western blotting检测各蛋白的表达水平 取各组原代心肌细胞,根据总蛋白提取试剂盒提取细胞总蛋白,用全自动生化分析仪(Beckman)测定蛋白质浓度。根据蛋白浓度取适量进行SDS-PAGE分离蛋白。将蛋白转移到硝酸纤维素膜后,将膜置于含5%脱脂奶粉的TBST中摇床上封闭2 h,用TBST洗膜10 min,共3 次,分别用 Bim、caspase-12、IP3和 β-actin的I抗按适当比例4℃孵育过夜,再洗膜3次,加入辣根过氧化物酶标记的抗兔IgG孵育2 h,最后洗膜3×10 min,进行显色,胶片曝光,结果用LabWork 3.0 软件(UVP Inc.),以目的条带/β-actin 的灰度值进行分析。
3 统计学处理
数据以均数 ±标准差(mean±SD)表示,采用SPSS 13.0统计软件包分析,多组间比较采用方差分析,组间分析采用q检验。以P<0.05为差异有统计学意义。
结 果
1 原代心肌细胞的成功培养及鉴定
于倒置显微镜下观察,心肌细胞呈放射状,不规则三角形、梭形,并伸出伪足相互接触交织成网,呈片状有节律搏动。免疫组化法结果显示,α-横纹肌肌动蛋白抗体阳性的心肌细胞胞浆内可见棕色颗粒,见图1。

Figure 1.The morphological identification of cardiomyocytes.A:inverted microscopy(×40);B:immunohistochemical staining forα-striated muscle actin(×200).图1 心肌细胞形态学鉴定
2 siRNA转染心肌细胞
将脂质体LipofectamineTM2000与带有绿色荧光蛋白报告基因的阴性对照siRNA序列转染入心肌细胞后,在荧光显微镜下可观察到细胞中绿色荧光蛋白的表达,而未转染阴性对照siRNA序列的细胞则未见绿色荧光,这表明阴性对照siRNA序列转染成功,见图2。

Figure 2.The result of fluorescence microscopy for detecting green fluorescence in cardiomyocytes(×200).A:inverted microscopy;B:blank control group;C:hypoxia+negative control siRNA group.图2 荧光显微镜检测心肌细胞中的绿色荧光
3 筛选有效Bim-siRNA
与阴性对照siRNA组比较,3对Bim-siRNA均能显著降低Bim的表达,其中以第2对沉默效率最高(P <0.01),其沉默效率达86.73%,见图 3。
4 缺氧对心肌细胞活性和凋亡率的影响及BimsiRNA的作用
与空白对照组比较,缺氧组细胞活性明显降低(P<0.05),细胞凋亡率明显增高(P<0.01);而Bim-siRNA转染后,心肌细胞活性明显增加(P<0.05),细胞凋亡率明显下降(P<0.01),而阴性对照siRNA组则于缺氧组无明显差异,见图4、表1。这说明通过RNA干扰下调Bim表达能抑制缺氧导致心肌细胞的凋亡。
5 Bim-siRNA转染和缺氧对心肌细胞钙离子的影响
因Fluo-3与钙离子结合产生的荧光强度与钙离子浓度成正比,故以平均荧光强度反映细胞内游离Ca2+浓度。检测不同条件干预后心肌细胞内钙离子荧光强度结果显示,缺氧组钙离子荧光强度显著高于对照组(P<0.05),说明缺氧损伤后细胞内钙离子浓度增加;Bim-siRNA转染组钙离子荧光强度较缺氧+阴性对照siRNA组明显降低,而缺氧+阴性对照siRNA组则与缺氧组无明显差异,见图5。这说明通过RNA干扰下调Bim表达能抑制缺氧导致钙离子浓度增加的作用。
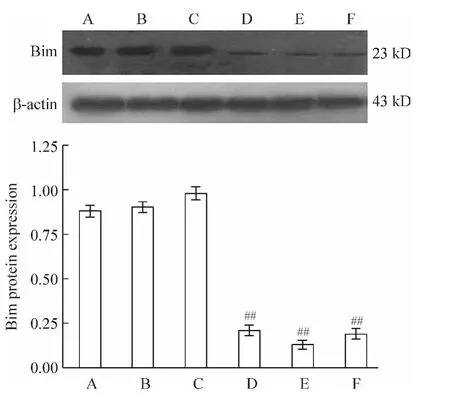
Figure 3.The effect of siRNA on expression of Bim.A:blank control group;B:hypoxia+liposome group;C:hypoxia+negative control siRNA group;D:hypoxia+siRNA-1 group;E:hypoxia+siRNA-2 group;F:hypoxia+siRNA-3 group.Mean ±SD.n=8.##P <0.01 vs C.图3 Bim-siRNA转染心肌细胞对Bim表达的影响
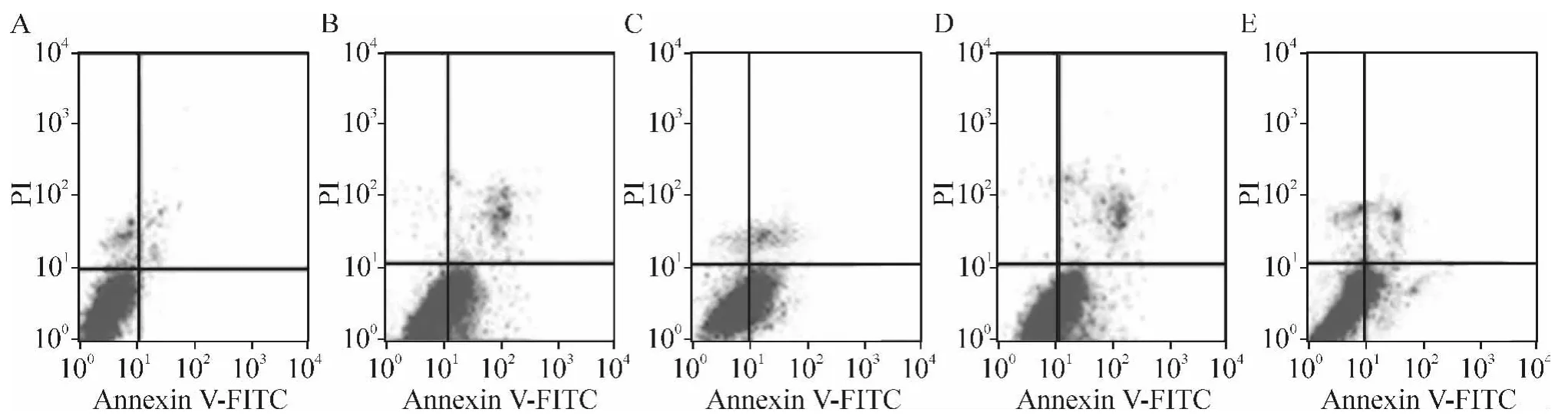
Figure 4.The changes of apoptotic rate of cardiomyocytes treated with Bim-siRNA transfection and hypoxia.A:blank control group;B:hypoxia group;C:hypoxia+liposome group;D:hypoxia+negative control siRNA group;E:hypoxia+Bim-siRNA group.图4 Bim-siRNA转染和缺氧对心肌细胞凋亡率的影响

表1 Bim-siRNA转染和缺氧后心肌细胞活性和凋亡率的变化Table 1.The changes of activity and apoptotic rate of cardiomyocytes treated with Bim-siRNA transfection and hypoxia(%.Mean±SD.n=8)
6 Bim-siRNA转染和缺氧对心肌细胞caspase-12和IP3表达的影响
Western blotting结果显示,与空白对照组比较,缺氧干预后,心肌细胞内内质网标志分子caspase-12(0.840 ±0.037 vs 0.150 ±0.029,P <0.05)和 IP3(0.700 ±0.034 vs 0.140 ±0.029,P <0.05)的表达明显增加,而通过Bim-siRNA转染下调Bim表达后,能抑制缺氧导致的这一作用(P<0.05 or P<0.01),见图6。这说明Bim-siRNA转染能显著降低Bim的表达,同时使内质网应激标志分子caspase-12和IP3的表达降低。

Figure 5.The changes of calcium fluorescence intensity of cardiomyocytes treated with Bim-siRNA transfection and hypoxia.A:blank control group;B:hypoxia group;C:hypoxia+liposome group;D:hypoxia+negative control siRNA group;E:hypoxia+Bim-siRNA group.Mean±SD.n=8.*P <0.05 vs A;#P <0.05 vs C.图5 Bim-siRNA转染和缺氧对心肌细胞内钙离子荧光强度的影响
讨 论
缺氧是一种应激因素,是临床上最常见的病理过程之一,也是引起细胞损伤,进而影响机体的功能活动的常见原因。有研究报道,在心肌缺氧损伤时,可导致心室收缩和舒张功能明显下降,左心功能障碍,严重时导致心力衰竭,其机制可能与心肌细胞内钙超载、氧自由基大量生成有关[8]。本研究结果也发现,心肌细胞缺氧培养时,在观察到细胞凋亡增加的同时,细胞存活率与对照组比较明显升高,进一步表明心肌细胞受缺氧损伤。而钙离子浓度比对照组明显升高,阐明钙离子超载可能参与了细胞损伤的过程,但其具体机制尚待进一步研究。
Qian等[9]研究发现,在小鼠心肌梗死模型中,通过抑制Bim蛋白的表达,拮抗Bim的促凋亡作用,发挥细胞保护作用。研究表明,瑞舒伐他汀可降低促凋亡蛋白Bim表达,减少心肌细胞凋亡,改善心肌梗死后的疗效[10]。综上所述,Bim蛋白具有促细胞凋亡作用,而且与心肌细胞凋亡有密切联系。在本研究中,当心肌细胞缺氧时,心肌细胞发生凋亡,细胞活性下降,Bim蛋白表达升高。而利用小干扰RNA技术沉默bim的表达可逆转缺氧导致的这一作用,使心肌细胞凋亡率减少,细胞活性增加。这表明Bim在缺氧导致心肌细胞凋亡的过程中起着重要的作用。
内质网应激是一条新发现的细胞凋亡信号转导通路。近年来有研究报道,内质网应激与高血压、心肌肥厚、心肌纤维化、心肌梗死、心脏衰竭有关[11-14]。Lakshmanan等[15]研究中发现,内质网应激在糖尿病引起心肌细胞凋亡的过程中起了重要作用。内质网应激介导细胞凋亡,其中一个重要因素是caspase-12,位于内质网胞浆面,过度内质网应激可激活caspase-12,而非内质网应激则不能激活caspase-12。这在以后的研究也得到证实[16-17]。在大鼠心肌梗死模型中,Weng等[18]报道以促红细胞生成素处理大鼠心肌细胞,抑制caspase-12活化,使其表达降低,细胞凋亡下降,进而保护心肌细胞。在离体大鼠心肌缺血再灌注损伤模型中,通过免疫组化检测caspase-12的表达,Liu等[19]发现,缺血再灌注损伤触发心肌细胞内质网应激,caspase-12表达升高与心肌细胞凋亡明显相关。IP3受体(IP3receptor,IP3R)有3种亚型,即I、II、III亚型。在发生内质网应激的细胞中,IP3R I的活化介导细胞内钙离子释放增加,导致细胞凋亡。而这一作用可被小干扰RNA沉默IP3R I所抑制。研究发现,抑制内质网应激,降低Bim蛋白的表达,可减少成纤维细胞的凋亡[20]。在小鼠神经母细胞瘤中,超氧化物歧化酶1基因突变可导致内质网应激和细胞凋亡,而敲除bim基因可抑制这一作用[21]。而关于Bim通过内质网途径介导心肌细胞凋亡的相关研究在国内外未见报道。本研究心肌细胞缺氧时,内质网标志分子 caspase-12、IP3表达升高,心肌细胞凋亡增加,存活率下降,说明缺氧损伤触发了内质网应激,进而诱导心肌细胞凋亡;而沉默bim的表达,可以下调caspase-12和IP3的表达,心肌细胞凋亡减少,存活率增加。这进一步证明下调Bim的表达可抑制缺氧导致的心肌细胞凋亡的作用,同时也说明Bim可能通过内质网途径介导缺氧致心肌细胞损伤。
综上所述,沉默bim的表达可抑制缺氧导致的心肌细胞凋亡的作用,进而发挥心肌保护作用,其机制可能与内质网信号通路有关,为以心肌细胞凋亡为基础的心血管疾病的治疗提供一种可能的治疗方向。

Figure 6.The changes of caspase-12 and IP3 levels in cardiomyocytes treated with Bim-siRNA transfection and hypoxia.A:blank control group;B:hypoxia group;C:hypoxia+liposome group;D:hypoxia+negative control siRNA group;E:hypoxia+Bim-siRNA group.Mean ±SD.n=8.*P <0.05 vs A;#P <0.05,##P <0.01 vs C.图6 Bim-siRNA转染和缺氧后心肌细胞caspase-12和IP3表达的变化
