瞬时受体电位通道C亚族和炎症在高盐饮食致左心室纤维化中的作用*
2013-12-01商黔惠石耿辉祝之明
刘 婵, 商黔惠,2△, 石耿辉, 赵 宇, 祝之明
(遵义医学院1临床医学研究所,心血管病研究所,高血压研究室,2附属医院心内科,贵州 遵义563000;3第三军医大学全军高血压代谢病中心,重庆市高血压研究所,重庆大坪医院高血压内分泌科,重庆400042)
高盐是导致心血管疾病发生的重要环境因素之一。长期高盐饮食不仅导致血压升高,而且有独立于血压之外的多重作用,可直接导致血管、心脏及肾脏等组织器官纤维化[1-2],但其机制尚未完全明了。心肌成纤维细胞胞内Ca2+浓度的上升是触发心肌纤维化及重构的重要因素,通过钙调神经磷酸酶(calcineurin,CaN)信号通路的激活,使心肌成纤维细胞增殖及胶原合成增加[3],但介导心肌成纤维细胞Ca2+内流的通道尚不明确。瞬时受体电位通道C亚族(transient receptor potential channels subfamily C,TRPCs)是一类新型的细胞膜表面通道蛋白,在心脏和血管均有表达,能介导Ca2+和Na+的内流,由于TRPC通道电导较小及可以长时程传递Ca2+信号的特性,使其成为心血管系统最具研究前景的钙内流通道[4-7]。Ohba等[8]和 Onohara 等[9]通过应用内皮素1和血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)刺激新生大鼠心肌细胞建立心肌肥大模型,发现TRPC1、TRPC3与TRPC6 mRNA和蛋白表达上调,干扰RNA抑制这些基因表达能明显抑制心肌细胞肥大时发生的肌动蛋白重组及蛋白合成,说明TRPC通道蛋白在心肌肥大发生发展过程中发挥重要作用,但TRPC在高盐诱导心肌纤维化中的作用尚不清楚。核因子 κB(nuclear factor-κB,NF-κB)是一种核蛋白因子,参与众多与免疫和炎症反应有关的基因转录。有研究发现TRPC3介导Ca2+内流增加后,也可通过CaN活化NF-κB,导致促纤维化炎症因子、血管细胞黏附因子1(vascular cell adhesion molecule-1,VCAM-1)表达升高[10-12],但炎症在高盐诱导左心室纤维化中的作用及机制是否与激活TRPC及其下游信号分子CaN、NF-κB有关,目前尚不清楚。因此,本实验通过对TRPC1、TRPC3、TRPC6及炎症分子表达的研究,进一步探讨TRPC和炎症在高盐饮食致左室纤维化中的作用及替米沙坦的干预效应。
材料和方法
1 材料
雄性Wistar大鼠由重庆第三军医大学大坪医院实验动物中心提供[许可证号为SCXK-(渝)2007-005];含NaCl分别为0.5%和8%的颗粒饲料购自广东省医学实验动物中心[许可证号为SCXK-(粤)2008-0002];替米沙坦由海南赛力克药业有限公司惠赠;TRPC1、TRPC3和 TRPC6Ⅰ抗购自 Alomone labs(第三军医大学祝之明教授馈赠),CaN、p-NF-κB p65、白细胞介素 1β(interleukin-1β,IL-1β)和转化生长因子 β1(transforming growth factor β1,TGF-β1)Ⅰ抗购自Santa Cruz,辣根过氧化物酶标记山羊抗兔IgG(江苏碧云天生物技术研究所),辣根过氧化物酶标记山羊抗小鼠IgG(江苏碧云天生物技术研究所),Trizol试剂购自 Invitrogen。
2 方法
2.1 模型的建立与分组[17]Wistar大鼠适应性饲养1周后,随机分为3组:正常对照组(C组)13只、高盐模型组(HS组)24只和替米沙坦干预组(T组)12只。C组饲以正常盐饲料(0.5%NaCl),HS组饲以8%高盐饲料,T组饲以8%高盐饲料,并给予替米沙坦灌胃,替米沙坦起始剂量2 mg/kg,随后根据血压情况每2周调整1次剂量,使血压尽量控制在正常范围内,替米沙坦最大剂量至40 mg/kg。各组大鼠均在相同标准环境下饲养,自由饮用自来水,饲养24周。
2.2 血压测定 用BESN-Ⅱ多通道动物无创测压仪测量大鼠尾动脉压,每只大鼠测量3次,取其平均值作为该大鼠该次的尾动脉压。大鼠适应性饲养1周后开始测压,作为基础压,随后每2周测量1次。高血压大鼠判定标准:处理后血压增加20~30 mm-Hg且 >120 mmHg。
2.3 左室重量指数测定 打开大鼠胸腔,沿升主动脉根部剪掉心脏,以房间隔和室间隔为界去除心房及右心室游离缘,冰生理盐水简单冲洗后滤纸吸干,使用电子分析天平准确称取左室重量(含室间隔),计算大鼠左室重量指数。
2.4 HE和Masson染色判定左心室重构
2.4.1 HE染色 组织经固定24 h后,进行脱水、透明及石蜡包埋。脱蜡至水,苏木素染液3~4 min,自来水(流水)冲洗30 s,1%盐酸乙醇分化返蓝2~3 s,自来水(流水)冲洗5 ~10 min,伊红染液 2 min,自来水(流水)冲洗30 s,95%乙醇数秒,95%乙醇数秒,无水乙醇数秒,烤箱烤干,60℃ 3~5 min,中性树胶封片。
2.4.2 Masson染色 取左心室固定24 h后,进行脱水、透明及石蜡包埋。石蜡切片脱蜡至水,苏木素染液7 min,流水冲洗,1%盐酸乙醇分化,流水冲洗,丽春红酸性复红染色30 min,0.5%冰乙酸冲洗,1%磷钼酸数秒,0.5%冰乙酸冲洗,2%亮绿染色1 min,烤箱烤干(60℃ 3~5 min),中性树胶封片。Masson染色使胶原纤维呈绿色,肌纤维和弹力纤维呈红色。每个标本随机取5个视野,拍照记录。用Image-Pro Plus 6.0软件分析,测量左心室胶原容积分数(collagen volume fraction,CVF),CVF为胶原面积与记录区域总面积的比值,每个标本取5个视野的均值作为其结果。
2.5 左心室TRPCs、NF-κB p65和促炎细胞因子实时荧光定量PCR检测 用Trizol试剂提取大鼠左心室总RNA,随后按Trizol试剂盒说明书对RNA进行纯化,紫外分光光度计测定样本在260和280 nm的吸光度值(A260和 A280),所得 A260/A280在1.80 ~ 2.20之间认为纯度符合要求。配置40μL 50 mg/L RNA逆转录液,逆转录合成cDNA后,进行PCR反应。结果以目的基因/β-actin的比值进行统计分析。
2.6 Western blotting 法检测左心室 TRPCs、CaN、p-NF-κB p65和促炎细胞因子蛋白表达 左心室心肌组织在RIPA裂解液中匀浆,冰上放置30 min以充分裂解,4℃、12 000 r/min离心10 min后分离上清,测定蛋白浓度(BCA方法)。各样本取相同的蛋白量(100μg)进行SDS-聚丙烯酰胺凝胶电泳,先用电压60 V,到达分离胶时加大电压至100 V,电泳完成后,把蛋白转移到PVDF膜上(电压110 V,电转90 min左右),TBST洗膜,5%脱脂牛奶封闭,TBST洗膜,Ⅰ抗4℃孵育过夜(Ⅰ抗的浓度:TRPC1 1∶200、TRPC3 1∶200、TRPC6 1∶200、CaN 1∶1 000 p-NF-κB p65 1∶1 000、IL-1β 1 ∶1 000、TGF-β11 ∶1 000、β-actin 1∶1 000),TBST洗膜,室温孵育相应的Ⅱ抗 2 h,TBST洗膜,将ECL化学发光试剂加在膜表面后,放入Bio-Rad凝胶成像仪中,选择化学发光,开始曝光检测蛋白表达;采用Quantity One定量分析软件系统对图像进行积分吸光度测定。通过目的蛋白的积分吸光度值除以内参照β-actin的积分吸光度值,得到各组蛋白条带相对值。
3 统计学处理
应用SPSS 13.0统计软件处理。计量数据用均数±标准差(mean±SD)表示,多组间比较采用方差分析,方差齐使用LSD法,方差不齐使用Tamhane's T2法,以P<0.05为差异有统计学意义。
结 果
1 大鼠血压和左室重量指数
与C组和T组相比,HS组尾动脉收缩压和颈动脉平均压明显升高,差异有统计学意义(P<0.05),其余各组之间比较无显著差异,见表1。HS组左室重量指数(left ventricular mass index,LVMI)与 C组相比显著增高(P<0.05),T组 LVMI降低(P<0.05),见表 1。
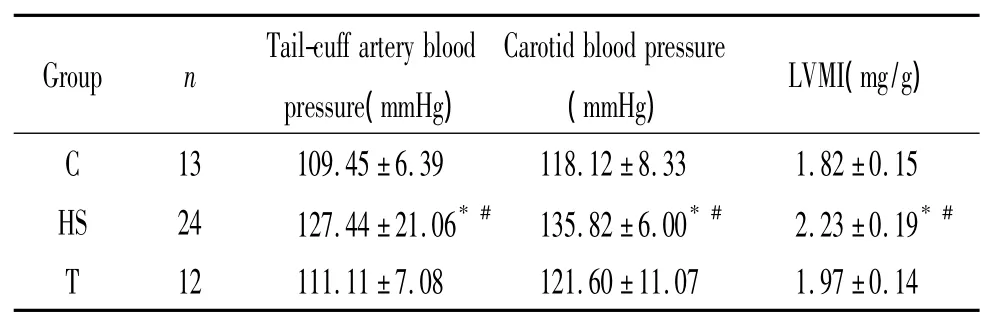
表1 各组大鼠血压及左室重量指数比较Table 1.The comparison of blood pressure and LVMI in variousgroups(Mean±SD)
2 大鼠左心室HE染色和Masson染色
2.1 HE染色 与C组比较,HS组细胞水肿,直径增大,间质细胞增多,有炎症细胞浸润;与HS组比较,T组细胞直径相对较小,间质细胞减少,炎症细胞浸润较少,见图1。
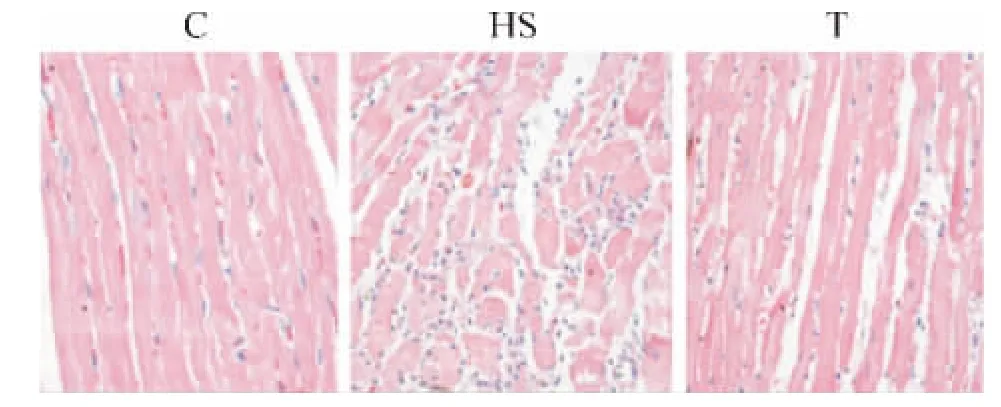
Figure 1.HE staining of left ventricular tissues from various groups(×400).图1 各组大鼠左心室Masson染色
2.2 Masson染色 心肌细胞胞浆呈红色,胶原纤维呈蓝色。与C组比较,HS组胶原容积分数增高(P<0.05);T组胶原容积分数低于 HS组(P<0.05),见图2。

Figure 2.Masson staining of left ventricular tissues from various groups(× 400).CVF:collagen volume fraction.Mean±SD.n=6.*P <0.05 vs Cgroup;#P <0.05 vs T group.图2 各组大鼠左心室Masson染色
3 大鼠左心室TRPCs、NF-κB p65和促炎细胞因子mRNA表达情况
采用real-time PCR检测大鼠左心室TRPC1、TRPC3、TRPC6、NF-κB p65、TGF-β1、VCAM-1、细胞间黏附分子 1(intercellular adhesion molecular,ICAM-1)和单核细胞趋化蛋白1(monocyte chemotactic protein-1,MCP-1)mRNA表达,结果发现:与C组比较,HS组TRPC1、TRPC3、TRPC6、NF-κB p65、TGF-β1、VCAM-1、ICAM-1和MCP-1 mRNA表达增高(P<0.05);经替米沙坦干预后,TRPC1、TRPC3、TRPC6、NF-κB p65、TGF-β1、ICAM-1 和 MCP-1 mRNA 表 达 下降(P <0.05),表 2。
4 各组大鼠左心室TRPCs蛋白表达情况
Western blotting结果表明,HS组TRPC1、TRPC3和TRPC6蛋白表达明显高于 C组(P<0.01,P<0.01,P <0.05);替米沙坦治疗后 TRPC1、TRPC3 和TRPC6蛋白表达明显减少(P <0.01,P <0.01,P <0.05),见图3。

表 2 各组大鼠左心室 TRPC1、TRPC3、TRPC6、NF-κB p65、TGF-β1、IL-1β、VCAM-1、ICAM-1 和 MCP-1 mRNA 表达Table 2.The mRNA expression of TRPC1,TRPC3,TRPC6,NF-κB p65,TGF-β1,IL-1β,VCAM-1,ICAM-1 and MCP-1 in left ventricular tissue from various groups(Mean±SD.n=6)
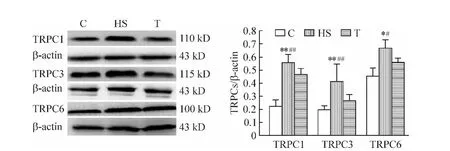
Figure 3.The protein expression of TRPC1,TRPC3 and TRPC6 in left ventricular tissues from various groups.Mean ±SD.n=6.*P <0.05,**P <0.01 vs Cgroup;#P <0.05,##P <0.01 vs T group.图3 各组大鼠左心室TRPC1、TRPC3和TRPC6蛋白表达
5 各组大鼠左心室CaN、p-NF-κB p65和促炎症细胞因子蛋白表达情况
与C组比较,HS组左心室 CaN、p-NF-κB p65、TGF-β1和 IL-1β 表达增高(P <0.05);经替米沙坦干预后,p-NF-κB 和 TGF-β1表达下降(P <0.05),CaN 和IL-1β 表达无显著差异(P >0.05),见图4、5。
讨 论
心肌纤维化是指在病理状态下心肌间质成纤维细胞增殖,细胞外基质沉积异常增加,心肌结构与功能发生重构。目前国内外研究表明,心肌纤维化的发生与其介导的肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)激活,氧化应激水平升高,炎性反应增强和内皮功能失调有关[1,13-15]。Ferreira 等[1]人发现高钠盐喂养 Wistar大鼠18周后,可引起心肌间质纤维化;高盐饮食还可引发盐敏感大鼠局部组织(心脏、肾脏、血管等)炎症反应、纤维化及器官损伤[16]。研究发现,压力负荷增加可导致心肌肥大和细胞外基质集聚,能激发心肌的炎症反应,诱导促炎细胞因子表达,介导心肌纤维化。本实验亦发现长期8%高盐饮食可导致正常Wistar大鼠心肌间质纤维化,高盐组与对照组相比左心室组织有炎症细胞浸润,并伴随促炎症细胞因子TGF-β1、IL-1β、VCAM-1、ICAM-1 和 MCP-1 mRNA 或相关蛋白表达的增高,推测局部组织炎症可能参与盐诱导的大鼠左心室纤维化发生机制。
心肌成纤维细胞内Ca2+的变化是触发心肌纤维化及重构的始动因素,根据TRPC通道电导较小及可以长时程传递Ca2+信号的特性,使其成为心血管系统最具研究前景的钙内流通道,Bush等[3]通过研究3种大鼠心肌肥大模型(自发性高血压大鼠、胸主动脉缩窄大鼠以及去甲肾上腺素刺激的大鼠)发现心脏组织TRPC3蛋白表达明显增加;将TRPC3基因转染体外培养的乳鼠心肌细胞,细胞体积增大,应用TRPC通道激动剂刺激此转染的心肌细胞后,细胞体积进一步增大[6];应用血管紧张素Ⅱ刺激新生大鼠心肌细胞建立心肌肥大模型,发现TRPC1、TRPC3与TRPC6 mRNA和蛋白表达明显增加[7-9],上述实验结果提示TRPC通道蛋白在心肌肥厚过程中扮演重要角色,但TRPC在高盐饮食致心肌纤维化中的作用知之甚少。本实验结果进一步表明高盐可使大鼠左心室TRPC1、3、6 mRNA和蛋白表达显著增加,提示TRPC的异常表达也参与了高盐饮食致左心室纤维化的过程。TRPC介导Ca2+内流增加后,可通过CaN使NF-κB活化,导致促纤维化炎症因子VCAM-1表达升高[11];NF-κB是一种多向性转录因子,参与调控多种细胞凋亡、增殖相关基因,导致促炎细胞因子、自由基等炎症介质的大量产生,引发相应的病变[10-13]。我们的结果显示高盐饮食可上调CaN和p-NF-κB p65及促纤维化炎细胞因子MCP-1、VCAM-1、ICAM-1、IL-1β和TGF-β1的表达,提示高盐饮食可能通过激活CaN及NF-κB转录促纤维化炎症因子,引发左心室组织炎症,导致纤维化。

Figure 4.The protein expression of CaN,p-NF-κB p65 in left ventricular tissues from various groups.Mean ±SD.n=6.*P <0.05 vs C group;#P <0.05 vs T group.图4 各组大鼠左心室CaN和p-NF-κB p65蛋白表达
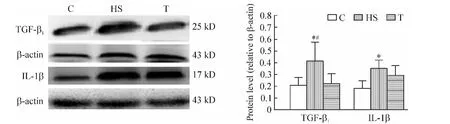
Figure 5.The protein expression of TGF-β1 and IL-1β in left ventricular tissues from various groups.Mean ± SD.n=6.*P <0.05 vs C group;#P <0.05 vs T group.图5 各组大鼠左心室TGF-β1和IL-1β蛋白表达
大量研究证实,心脏局部组织的RAAS对心肌纤维化起重要作用,其效应分子——AngⅡ和醛固酮(aldosterone,ALD)则是引起心肌纤维化最主要的活性物质。高钠盐饮食能增加WKY大鼠心肌血管紧张素Ⅱ1型(angiotensinⅡ type 1,AT1)受体mRNA表达和ALD合成[16],ALD拮抗剂螺内酯可以预防高盐饮食引起的心肌胶原合成增加和纤维化[17]。高钠盐喂养Wistar大鼠18周后,可引起心肌间质纤维化,纤维化组织中AT1受体密度明显上升[1],导致心脏、血管、肾脏的广泛纤维化[18]。AngⅡ与AT1受体结合后,可激活细胞膜TRPC通道引发Ca2+内流[19-20]。研究发现替米沙坦能通过阻断AT1受体减弱TNF-α诱导的血管平滑肌细胞炎症反应[21],在动脉粥样硬化模型中,AngⅡ与血管平滑肌细胞表面AT1受体结合,激活NF-κB,使巨噬细胞浸润,白细胞黏附因子及MCP-1高表达,应用AT1受体阻断剂或血管紧张素转化酶抑制剂可显著减少单核细胞和巨噬细胞的出现,抑制 NF-κB 介导的转录[12],提示替米沙坦可能通过影响TRPC介导的下游炎症反应,发挥疗效。本实验结果显示替米沙坦能改善左心室的炎症及纤维化,抑制 TRPC1、TRPC3、TRPC6、p-NFκB p65 及促纤维化炎症因子表达,表明替米沙坦可影响TRPCs表达与NF-κB的激活发挥抗左心室纤维化作用。
综上所述,局部组织炎症可能参与盐诱导的大鼠左心室纤维化发生机制,炎症的激活与TRPCs、NF-κB mRNA和蛋白表达上调有关,替米沙坦可通过影响TRPCs和NF-κB表达,改善左心室的炎症及纤维化。
