氧化苦参碱抑制高糖诱导的大鼠肾小管上皮-间充质转化及其机制研究*
2013-12-01刘丽荣王圆圆石明隽
刘丽荣, 李 霜, 王圆圆, 石明隽, 肖 瑛, 郭 兵△
(贵阳医学院1医学检验学院临床生化教研室,2基础医学院病理生理学教研室,贵州贵阳550004)
在糖尿病肾病(diabetic nephropathy,DN)肾小管间质纤维化发展过程中,肾组织转化生长因子β1(transforming growth factor β1,TGF-β1)表达显著上调,主要通过激活Smads信号通路,诱导肾小管上皮细胞发生上皮-间充质转化(epithelial-mesenchymal transition,EMT),促使细胞外基质(extracellular matrix,ECM)合成增加并抑制其降解而过度沉积,从而造成广泛的肾组织纤维化[1-2]。Smad7作为抑制性Smad蛋白,可以抑制 TGF-β1/Smads介导的生物学效应,在多种肾纤维化疾病过程中,Smad7的蛋白表达显著下调[3]。近年来研究发现,氧化苦参碱(oxymatrine,OM)具有抗肝纤维化[4-5]、肺纤维化[6]、皮肤瘢痕纤维化[7]等作用,但对DN肾小管间质纤维化是否有此作用且作用机制方面的研究通过广泛查阅资料未见报道。因此,本研究旨在观察高糖条件下OM对大鼠近端肾小管上皮NRK52E细胞TGF-β1及其信号通路的重要负调控因子Smad7表达变化的影响,探讨OM对高糖诱导的大鼠肾小管EMT的作用及其可能机制,为OM应用于DN治疗提供重要的理论和实验依据。
材料和方法
1 细胞
大鼠近端肾小管上皮NRK52E细胞由复旦大学陆利民教授惠赠。
2 主要试剂
胰蛋白酶和DMEM培养基(HyClone);胎牛血清(Gibco),甲叉丙烯酰胺和甲叉双丙烯酰胺(Ameresco);抗 TGF-β1、抗 Smad7、抗 α-SMA 和抗 E-cadherin(Santa Cruz);抗 β-actin、DAB、辣根过氧化物酶标记羊抗兔和羊抗小鼠IgG(博士德);总RNA提取试剂盒和蛋白质marker(天根);BCA蛋白浓度测定试剂盒、MMT细胞增殖及毒性检测试剂盒(碧云天);PVDF膜、Whatman滤纸(Millinpore Mass);RevertAidTMFirst Strand cDNA Synthesis Kit(Fermentas);ECL显色剂(Pierce);Real-time PCR MasterMix(SYBR Green)(Bio-Rad);real-time PCR引物由上海捷瑞生物工程有限公司设计合成,见表1;氧化苦参碱(中国药品生物制品检定所,批号为110780-201007)。
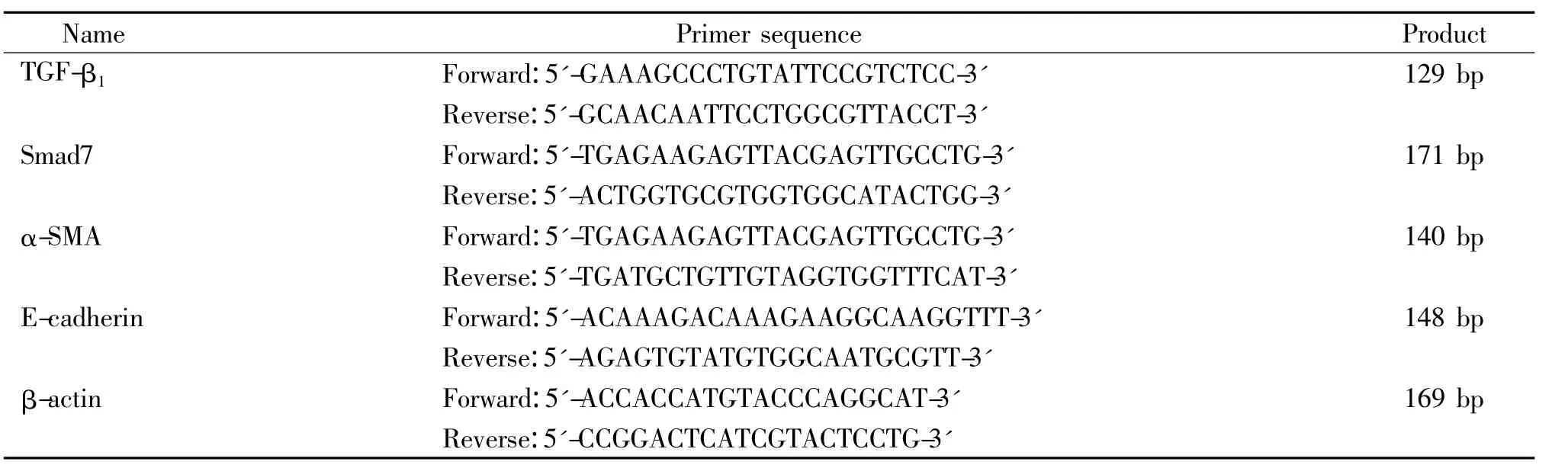
表1 引物序列Table 1.Sequences of the primers
3 主要方法
3.1 细胞培养与分组 复苏NRK52E细胞,于25 cm2细胞培养瓶内加入含10%胎牛血清(fetal bovine serum,FBS)的DMEM培养液,置于37℃、5%CO2恒温条件下培养。待细胞生长达80%融合时,换无血清DMEM培养液静止24 h,以使细胞生长同步化。细胞随机分组:(1)对照组(2%FBS+DMEM+5.5 mmol/L glucose);(2)高糖组(2%FBS+DMEM+25 mmol/L glucose);(3)高糖+0.50 g/L OM动态观察组(2%FBS+DMEM+25 mmol/L glucose+0.50 g/L OM),上述3 组分别设2 h、12 h、24 h、48 h 和72 h 五个培养时点进行动态观察;(4)高糖+OM不同浓度组(2%FBS+DMEM+25 mmol/L glucose+0.01、0.05、0.10、0.25、0.50 g/L OM)培养 48 h。各组细胞分别提取蛋白和RNA进行检测。
3.2 MTT法检测OM对NRK52E细胞活性的影响 页码 电子书="324" 纸书="2154"/>将NRK52E制成2.5×106/L细胞悬液,200μL/well接种到96孔板,待细胞长至80%融合时,加无血清DMEM静止24 h,根据DMEM中OM浓度不同分为8组:空白对照组、阴性对照组、0.01 g/L OM组、0.05 g/L OM 组、0.10 g/L OM 组、0.25 g/L OM组、0.50 g/L OM组和1.00 g/L OM组,每组设4个复孔,培养48 h后取出96孔板,吸弃上清,每孔加入100μL DMEM和10μL MTT溶液,继续培养4 h,加入DMSO 100μL,继续培养,直至在光学显微镜下观察到紫蓝色结晶全部溶解,在全自动酶联免疫检测仪上,测定570 nm处吸光度(以空白对照组调零)。
3.3 Real-time PCR 根据Trizol试剂盒说明书提取细胞总RNA,核酸蛋白分析仪测定RNA的浓度和纯度,琼脂糖凝胶电泳鉴定RNA完整性。取3μg RNA逆转录合成cDNA,进行real-time PCR。反应条件为95℃预变性3 min,95℃变性10 s,60℃退火30 s,循环40次。在Bio-Rad CFX 96TM荧光定量PCR分析系统上进行,熔解曲线自动生成,每个样本行3次real-time PCR,以β-actin为内参照,目的基因相对含量以 2-ΔΔCt表示。
3.4 Western blotting 裂解液裂解细胞,离心取上清,BCA法测蛋白浓度,加样缓冲液使蛋白变性,上样,经SDS-PAGE垂直电泳后,电转移至PVDF膜,用5%脱脂奶粉室温封闭2 h,TBST洗膜,分别与特异性 TGF-β1抗体(1∶200)、Smad7 抗体(1∶300)、α-SMA 抗体(1∶400)、E-cadherin 抗体(1∶400)和 β-actin抗体(1∶400)4℃孵育过夜,TBST洗膜,再与辣根过氧化物酶标记的Ⅱ抗(1∶5 000)室温孵育1 h,TBST洗膜,ECL显影曝光,Bio-Rad凝胶成像系统采集图像,Quantity One 4.6软件进行分析,以 β-actin为内参照,目的蛋白的相对表达水平用目的蛋白/βactin灰度比值表示。
4 统计学处理
采用SPSS 19.0统计软件进行统计分析,数据用均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法),以P<0.05为差异有统计学意义。
结 果
1 高糖条件下NRK52E细胞中 TGF-β1、Smad7、α-SMA和E-cadherin mRNA及蛋白表达的动态变化
1.1 mRNA表达的动态变化 Real-time PCR结果显示,与对照组相比,高糖组随处理时间延长,TGF-β1、Smad7和α-SMA mRNA表达逐渐增高,而E-cadherin mRNA表达逐渐降低,且呈时间依赖性(P<0.05),见图 1。

Figure 1.Expression of TGF-β1,Smad7,α-SMA and E-cadherin mRNA in NRK52E cells treated with 25 mmol/L glucose for 2,12,24,48 and 72 h determined by real-time PCR.Mean ± SD.n=3.*P <0.05 vs control at the same time.图1 Real-time PCR方法检测高糖条件下NRK52E细胞中TGF-β1、Smad7、α-SMA和E-cadherin mRNA表达的变化
1.2 蛋白表达的动态变化 Western blotting结果显示,与对照组相比,高糖组随处理时间延长,TGF-β1和α-SMA蛋白表达逐渐增高,而Smad7和E-cadherin蛋白表达逐渐降低,且呈时间依赖性(P<0.05),见图2。
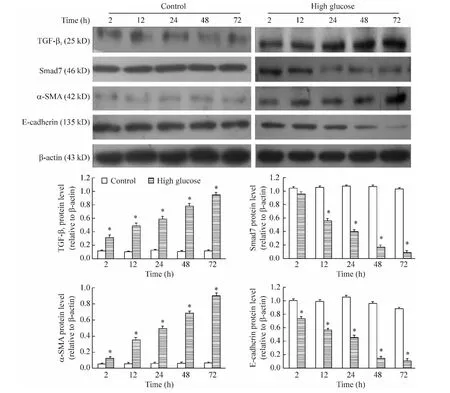
Figure 2.Expression of TGF-β1,Smad7,α-SMA and E-cadherin proteins in NRK52E cells treated with 25mmol/L glucose for 2,12,24,48 and 72 h determined by Western blotting.Mean ± SD.n=3.*P <0.05 vs control.图2 Western blotting方法检测高糖条件下NRK52E细胞中TGF-β1、Smad7、α-SMA和E-cadherin蛋白表达的变化
2 MTT结果
1.00 g/L OM对NRK52E细胞活性有明显抑制作用(P <0.05),而0.01 ~0.50 g/L OM 对 NRK52E的细胞活性无明显影响,提示该OM浓度范围对NRK52E细胞活性无明显影响,见图3。

Figure 3.Effects of OM at different concentrations on viability of NRK52E cells detected by MTTassay.Mean ± SD.n=4.*P <0.05 vs 0.00 g/L.图3 MTT法检测不同浓度OM对NRK52E细胞活性的影响
3 不同浓度OM对高糖条件下NRK52E细胞TGF-β1、Smad7、α-SMA 和 E-cadherin mRNA 及蛋白表达的影响
3.1 对mRNA表达的影响 Real-time PCR结果显示,高糖作用48 h 后,TGF-β1、Smad7 和 α-SMA mRNA表达较对照组显著增高,E-cadherin mRNA表达较对照组显著降低(P<0.05);与高糖组相比,高糖+OM不同浓度组随 OM 剂量增加,TGF-β1和 α-SMA mRNA表达逐渐降低,E-cadherin mRNA表达逐渐增高,呈剂量依赖性(P<0.05),Smad7 mRNA表达则 无明显差异,见图4。
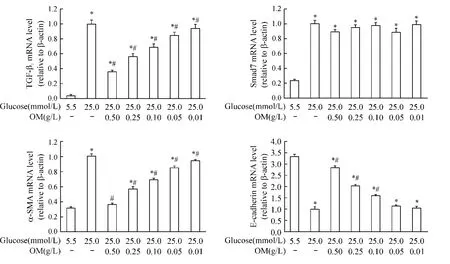
Figure 4.Expression of TGF-β1,Smad7,α-SMA and E-cadherin mRNA in NRK52E cells determined by real-time PCR.Mean ± SD.n=3.*P <0.05 vs5.5 mmol/L glucose;#P <0.05 vs25.0 mmol/L glucose alone.图4 Real-time PCR方法检测不同浓度OM对高糖条件下NRK52E细胞TGF-β1、Smad7、α-SMA和E-cadherin mRNA表达的影响
3.2 对蛋白表达的影响 Western blotting结果显示,高糖作用48 h后,TGF-β1和α-SMA蛋白表达较对照组显著增高,Smad7和E-cadherin蛋白表达较对照组显著降低(P<0.05);与高糖组相比,高糖+OM不同浓度组随OM剂量增加,TGF-β1和α-SMA蛋白的表达逐渐降低,Smad7和E-cadherin蛋白表达逐渐增强,且呈剂量依赖性(P<0.05),见图5。
4 0.50 g/L OM 作用不同时间对高糖条件下NRK52E 细胞 TGF-β1、Smad7、α-SMA 和 E-cadherin mRNA及蛋白表达的影响
4.1 对mRNA表达的影响 Real-time PCR结果显示,与高糖组相比,高糖+0.50 g/L OM动态观察组TGF-β1和 α-SMA mRNA 表达持续降低,E-cadherin mRNA表达持续增高(P<0.05),Smad7 mRNA表达无明显差异;与对照组相比,高糖+0.50 g/L OM动态观察组TGF-β1、Smad7和 α-SMA mRNA表达明显增高,而 E-cadherin mRNA表达明显降低(P<0.05),无明显时间依赖性,见图6。
4.2 对蛋白表达的影响 Western blotting结果显示,与高糖组相比,高糖+0.50 g/L OM动态观察组TGF-β1和α-SMA蛋白表达持续降低,Smad7和E-cadherin蛋白表达持续增高(P<0.05);与对照组相比,高糖+0.50 g/L OM动态观察组TGF-β1和α-SMA蛋白表达明显增高,而Smad7和E-cadherin蛋白表达明显降低(P <0.05),无明显时间依赖性,见图7。
讨 论
DN是糖尿病最常见的严重微血管并发症之一,已成为导致终末期肾病和糖尿病患者死亡的主要原因,肾小管间质纤维化为其主要病理特征。EMT在肾间质纤维化发生、发展中起重要作用,是肾间质纤维化发生的重要环节。TGF-β1是目前已证实的致肾小管EMT最强的细胞因子之一,在DN肾组织及高糖刺激的肾小管上皮细胞中 TGF-β1表达都显著上调[8],通过TGF-β1/Smads信号通路诱导肾小管上皮细胞发生EMT,进而致肾小管间质纤维化发生。Smad7作为TGF-β1/Smads信号转导通路中的负向调节因子,能够阻止或者减弱TGF-β1信号转导通路的生物学效应[9-11]。本研究结果显示,高糖处理NRK52E细胞不同时间后,随着处理时间延长,TGF-β1表达呈进行性增高、Smad7蛋白表达进行性降低、间质细胞标志物α-SMA表达进行性增高、上皮细胞标志物E-cadherin表达进行性降低,提示,高糖一方面可通过上调TGF-β1的表达激活TGF-β1/Smads信号通路,另一方面通过下调Smad7蛋白表达减弱对TGF-β1/Smads信号通路的负调控作用,而诱导NRK52E细胞EMT的发生。
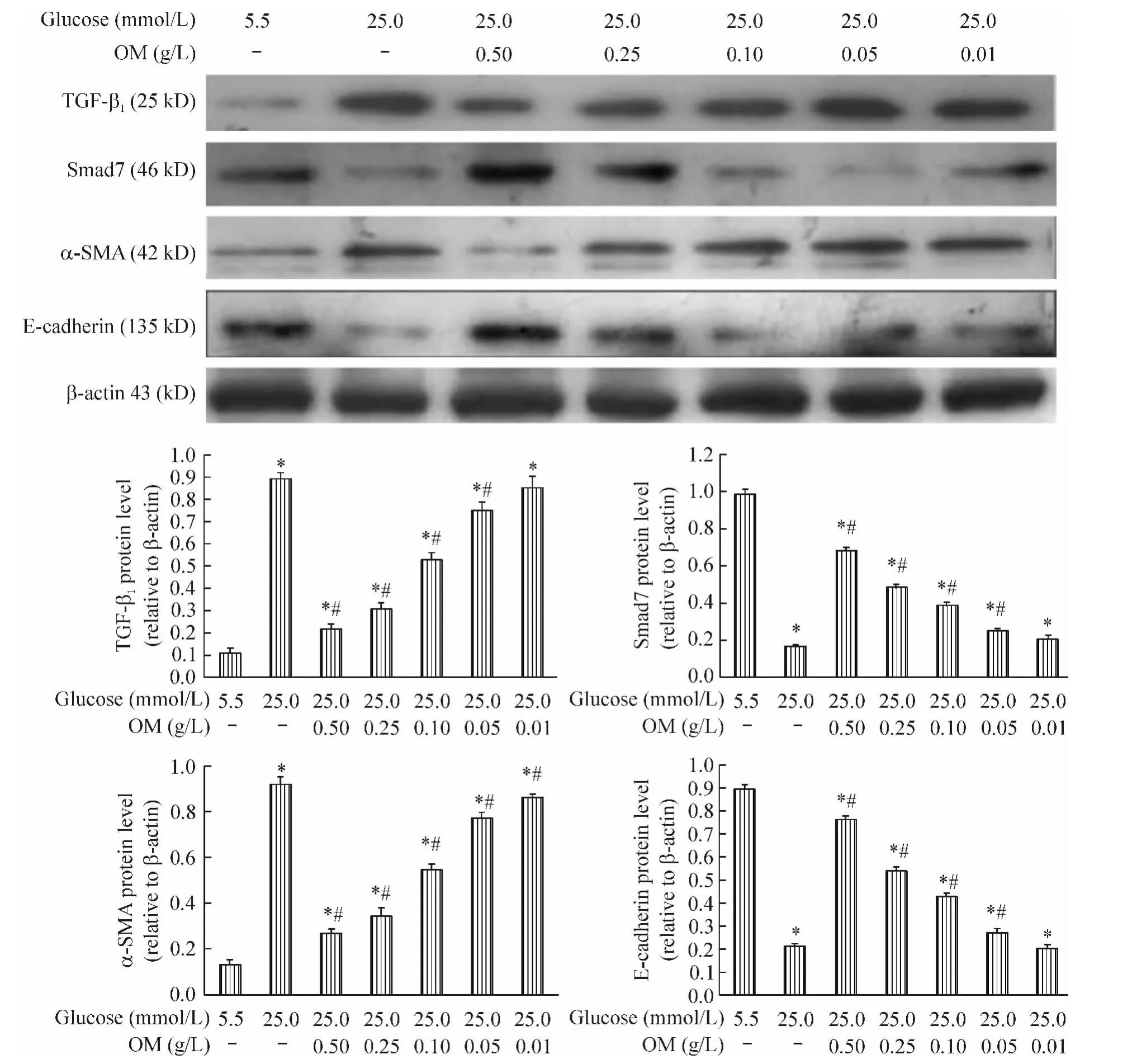
Figure 5.Expression of TGF-β1,Smad7,α-SMA and E-cadherin proteins in NRK52E cells determined by Western blotting.Mean ± SD.n=3.*P <0.05 vs 5.5 mmol/L glucose;#P <0.05 vs 25.0 mmol/L glucose alone.图5 Western blotting检测不同浓度OM对高糖条件下NRK52E细胞TGF-β1、Smad7、α-SMA和E-cadherin蛋白表达的影响
近年研究发现,OM有免疫调节、镇静、镇痛、抗心律失常、抗病毒、抗炎、抗肿瘤、抗纤维化等多方面的药理作用,在抗肾脏纤维化中有很好的疗效[12],但关于OM是否可以通过抑制 TGF-β1表达或促进TGF-β1/Smads信号转导通路负调控因子(如Smad7、SnoN等)的表达,阻碍 TGF-β1/Smads信号转导通路,抑制肾小管上皮细胞EMT,进而抑制DN肾小管间质纤维化方面的研究国内外尚未见报道。基于此,我们假设:OM可以通过抑制高糖所致的TGF-β1表达上调和Smad7表达下调,干预TGF-β1/Smads信号转导通路的过度活化,抑制肾小管上皮细胞EMT,进而达到治疗肾小管间质纤维化的目的。为此,本研究在体外细胞分子水平,通过观察OM对高糖条件下NRK52E细胞中TGF-β1及Smad7的表达情况,验证上述假设,以探讨OM对高糖诱导发生EMT的抑制作用及可能的相关机制,为OM用于抗DN肾小管间质纤维化治疗提供重要的理论和实验依据。
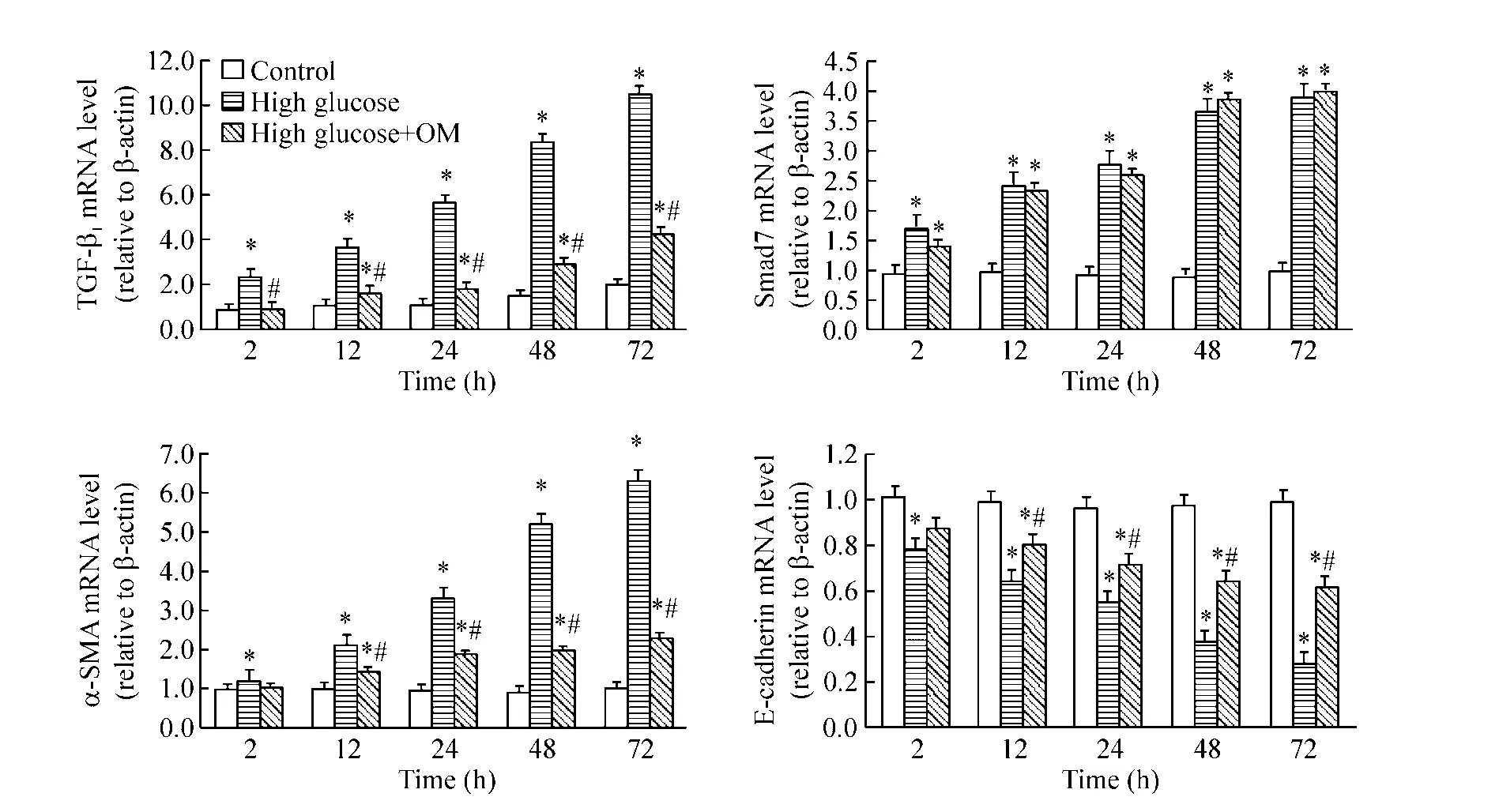
Figure 6.Expression ofα-SMA,E-cadherin,TGF-β1 and Smad7 mRNA in NRK52E cells determined by real-time PCR.Mean ± SD.n=3.*P <0.05 vs control at the same time;#P <0.05 vs high glucose at the same time.图6 Real-time PCR检测0.50 g/L OM对高糖条件下NRK52E细胞TGF-β1、Smad7、α-SMA和E-cadherin mRNA表达的影响

Figure 7.Expression ofα-SMA,E-cadherin,TGF-β1 and Smad7 proteins in NRK52E cells determined by Western blotting.Mean ±SD.n=3.*P <0.05 vs control at the same time;#P <0.05 vs high glucose at the same time.图7 Western blotting检测0.50 g/L OM对高糖条件下NRK52E细胞TGF-β1、Smad7、α-SMA和E-cadherin蛋白表达的影响
根据高糖培养48 h的NRK52E细胞明显发生EMT,且 MTT 实验结果提示 0.01 ~0.50 g/L OM 对NRK52E细胞无明显毒性作用,所以选择高糖+0.01~0.50 g/L不同浓度OM共同培养NRK52E细胞48 h,以观察不同浓度OM对高糖条件下NRK52E细胞中各相关指标表达的影响,结果显示,加OM干预后NRK52E细胞中TGF-β1及α-SMA mRNA和蛋白表达水平降低,E-cadherin mRNA和蛋白的表达增高,Smad7蛋白的表达增高,且均呈剂量依赖性,提示OM可抑制高糖诱导的 TGF-β1合成分泌增加及Smad7蛋白表达降低,从而抑制EMT的发生。因上述剂量依赖性实验中以0.50 g/L OM的效果最佳,故选择高糖+0.50 g/L OM进行动态观察,行时间依赖性实验以期寻找其发挥明显抑制EMT效应的最佳时点,结果显示:与对照组相比,高糖+0.50 g/L OM动态观察组 TGF-β1、α-SMA mRNA和蛋白表达明显增高,而E-cadherin mRNA和蛋白表达明显降低,Smad7蛋白表达明显降低而其mRNA表达明显增高,在一定时间范围内无明显时间依赖性;与高糖
组相比,高糖 +0.50 g/L OM 动态观察组 TGF-β1、α-SMA mRNA和蛋白表达持续降低,Smad7和E-cadherin蛋白表达持续增高,E-cadherin mRNA表达持续增高,无明显时间依赖性,Smad7 mRNA表达无明显差异,提示0.50 g/L OM可一定程度地抑制EMT发生。高糖条件下加OM干预的NRK52E细胞中Smad7蛋白水平较高糖组明显增高,Smad7 mRNA表达与高糖组均持续较高水平(两组间无明显差异),提示高糖条件下Smad7表达降低并非发生在其基因转录水平而是蛋白水平,结合其它研究结果[13-15],推测其原因可能是:高糖刺激NRK52E细胞上调TGF-β1表达,通过TGF-β1/Smads信号通路上调E3泛素连接酶(如Smurf2、Arkadia等)表达,介导 Smad7蛋白的泛素化降解增强而下调其蛋白表达,蛋白水平的降低可能使其基因转录水平的负反馈作用减弱,从而致使Smad7 mRNA表达上调。高糖条件下加入OM后,TGF-β1高表达受抑制,E3泛素连接酶表达水平降低,进而阻断Smad7蛋白的降解,因而Smad7蛋白水平增高,而关于Smad7 mRNA持续高表达的机制有待进一步深入研究探讨。综上所述,OM可抑制高糖诱导NRK52E细胞发生的EMT,从体外细胞分子水平探索其作用机制,可能与 OM下调 TGF-β1 mRNA和蛋白表达及上调Smad7蛋白表达,进而抑制TGF-β1/Smads信号通路的致纤维化效应有关。
