多囊卵巢综合征患者血清中蛋白因子的变化及其临床意义*
2013-12-01杨炜敏何善阳黄若磐
杭 晨, 杨炜敏△, 何善阳, 黄若磐
(1无锡市妇幼保健院妇产科,江苏 无锡214002;2中山大学第一附属医院黄埔院区,广东广州510700;3RayBiotech公司,美国佐治亚州诺克罗斯市30092)
多囊卵巢综合征(polycystic ovary syndrome, PCOS)是妇产科领域中最常见的内分泌疾病,其发病率在育龄妇女中约5% ~10%,在月经异常妇女中约70% ~80%[1]。因其临床症状、血激素生化检查及卵巢超声表现都存在异质性,给临床研究带来困难。虽然已进行了大量研究,PCOS的发病机制至今不清。越来越多的研究证据表明,PCOS的概念已经远远超出了妇科内分泌学的范畴,对其发病机理的研究也不再局限于性腺轴及卵巢局部内分泌因素,而是深入到免疫学、遗传学等多个方面。蛋白质组学的研究方法能够同步识别鉴定细胞、组织或机体的多种蛋白质,并分析蛋白质的功能及其模式,能够同时反映细胞内部的遗传特性和外界因素的影响,为在蛋白质水平对疾病进行研究提供广阔的技术平台。本实验采用可吸附蛋白质的膜为载体,采用抗体蛋白质芯片同时检测在多囊卵巢综合征患者及正常对照组血清中174种蛋白因子的表达,旨在探讨与多囊卵巢综合征发生发展有关的分子标志物,为临床诊断和治疗提供理论依据。
材料和方法
1 对象
选取南京医科大学附属无锡妇幼保健院妇科门诊2010年1~6月门诊诊断为PCOS的患者3例,采用2003年ESHRE/ASRM的诊断标准[2]:(1)偶发排卵和(或)无排卵;(2)临床和(或)生化指标提示高雄激素血症,并排除其它可能致病的因素,如先天性肾上腺增生、分泌雄激素肿瘤、Cushing综合征等;(3)卵巢多囊性改变:B超检查示≥12个直径2~9 mm卵泡和(或)卵巢体积增大>10 mL。符合其中两项者即可诊断为PCOS。以同期门诊健康体检女性3例为对照。所有入选者均于清晨空腹抽取肘静脉血4 mL,静置分离血清后放于-80℃冻存。
2 方法
2.1 蛋白质芯片检测 使用抗体蛋白质芯片试剂盒2000(人类细胞因子系列6、7、8;由RayBiotech提供,广州瑞博奥生物科技有限公司代理),操作过程按试剂盒说明书进行并略作修饰。具体方法为:将已包被抗体的蛋白质芯片膜浸泡于BSA缓冲液室温孵育30 min,以阻断非特异性反应,然后将膜与1∶10稀释的血清于摇床上室温孵育4 h,缓慢摇动,使反应均匀,充分洗膜,洗去非特异结合物,加2 mL生物素结合的抗体,4℃孵育过夜,再次彻底洗膜,加Cy3结合的链霉亲和素,摇床上室温孵育1 h,缓慢摇动充分洗膜,使反应均匀;Affymetrix激光成像扫描仪扫描照相;并进行密度分析,以5%BSA为阴性对照。
2.2 ELISA法检测蛋白质芯片结果变化显著的2个蛋白因子 通过查找文献筛选出目前无血清学检测结果报道的因子——血小板源性生长因子 BB(platelet-derived growth factor BB,PDGF-BB)及脂联素(adiponectin或adipocyte complement-related protein of 30 kD,Acrp30),其蛋白质芯片表达强度增加分别为2.8倍和1.5倍,见结果2。检测同期PCOS门诊患者及对照组体检健康女性各30例PDGF-BB及Acrp30水平变化,验证其改变是否具有统计学意义。
3 统计学处理
原始数据(光点密度)使用RayBiotech蛋白质芯片分析工具软件分析,根据单个膜阳性与阴性对照值进行标准化处理及减除背景处理,再进行组间比较。组间比较采用t检验,SPSS 10.0软件分析,以P<0.05为差异有统计学意义。
结 果
1 抗体蛋白质芯片检测结果
使用抗体蛋白质芯片试剂盒2000同步检测174种分泌型血清蛋白因子在PCOS患者及对照组血清中的水平。抗体蛋白质位点图见图1,蛋白因子检测结果见表 1、2。
2 PCOS组血清174种蛋白因子的改变
2.1 PCOS组表达增高的因子 经统计有23种因子在PCOS组升高,分别为血管生长素(angiogenin)、表皮生长因子(epidermal growth factor,EGF)、胰岛素样生长因子结合蛋白 1(insulin-like growth factorbinding protein 1,IGFBP-1)、IGFBP-4、白细胞介素 7(interleukin-7,IL-7)、巨噬细胞炎症蛋白1δ(macrophage inflammatory protein 1 delta,MIP-1-delta)、肺活化调节趋化因子(pulmonary and activation-regulated chemokine,PARC)、PDGF-BB、Acrp30、EGF 受体(EGF receptor,EGFR)、细胞间粘附分子1(intercellular adhesion molecule 1,ICAM-1)、可溶性 TNF受体I(soluble TNF receptor I,sTNFRI)、金属蛋白酶组织抑制物 2(tissue inhibitor of metalloproteinase 2,TIMP-2)、TNF相关凋亡诱导配体受体3(TNF-related apoptosis-inducing ligand receptor 3,TRAIL-R3)、E-选择素(E-selectin)、IL-1受体 II(IL-1 receptor II,IL-1RII)、IL-5受体 α (IL-5 receptor alpha,IL-5Ra)、潜在相关肽(latency-associated peptide,LAP)、L-选择素(L-selectin)、巨噬细胞集落刺激因子受体(macrophage colony-stimulating factor receptor,M-CSFR)、PDGF-AA、泌乳素(prolactin)和血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)。

Figure 1.The results of human serum protein array from PCOSand control groups.图1 PCOS患者及对照组血清蛋白质芯片检测结果
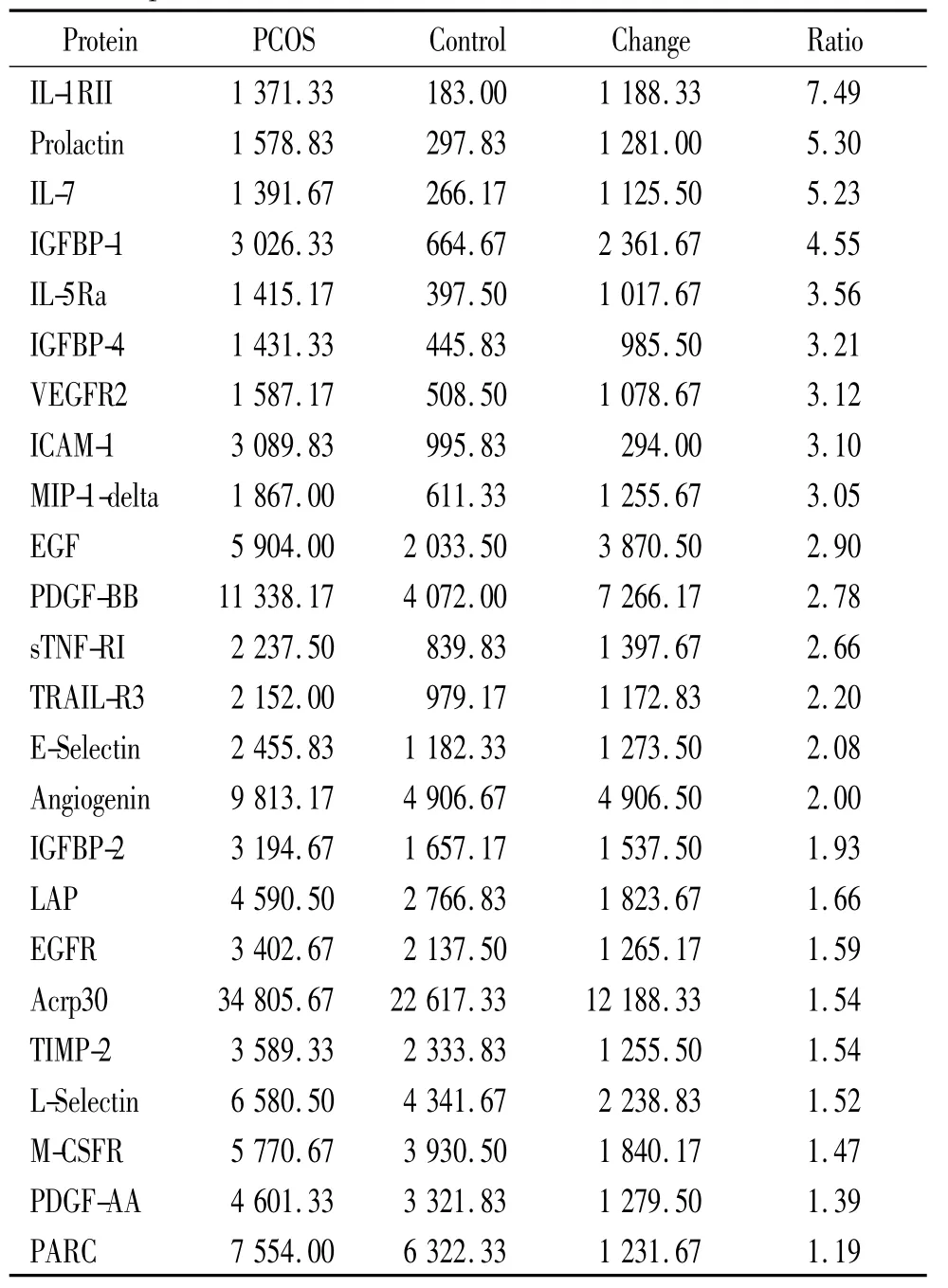
表1 在PCOS组中增高的血清蛋白因子Table 1.Serum protein factors increased in PCOSpatients compared with the controls
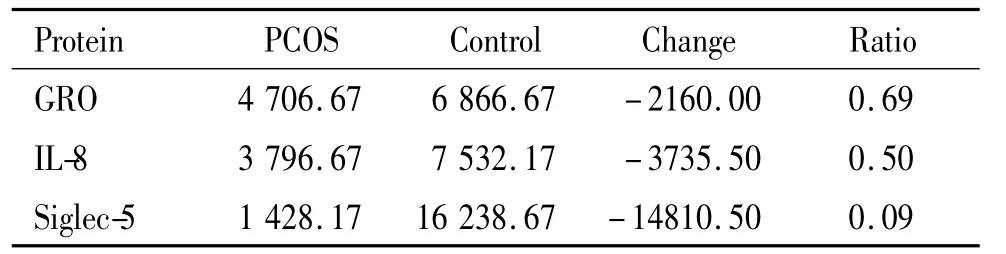
表2 在PCOS组中降低的血清蛋白因子Table 2.Serum protein factors decreased in PCOSpatients compared with the controls
2.2 PCOS组表达降低的因子 有3种,包括生长调节癌基因(growth-regulated oncogene,GRO)、IL-8和Siglec-5。
3 PCOS组表达明显增高的蛋白因子
PCOS组蛋白因子表达强度增高达3倍以上的为 IL-1RII、prolactin、IL-7、IGFBP-1、IL-5Ra、IGFBP-4、VEGFR2、ICAM-1 和 MIP-1-delta。
4 ELISA验证PDGF-BB及Acrp30
PCOS组及对照组血清中的 PDGF-BB为:(247.32±30.70)ng/L vs(204.51±28.55)ng/L(P<0.05)。PCOS组及对照组血清 Acrp30为(109.86±49.62)μg/L vs(85.91±38.69)μg/L(P <0.05)。
讨 论
既往研究显示[3]人类生殖腺是细胞因子产生与作用的部位,PCOS以生殖功能异常为基本特征,伴有免疫细胞、细胞因子及凋亡调节等多种改变,而免疫系统与生殖细胞的交互作用是复杂的、网络式的。近年来对PCOS的免疫学因素,尤其细胞因子等方面的研究取得了较大进展[4-5],主要研究内容可分为三大类:(1)炎性反应因子类;(2)生长因子类;(3)脂肪细胞因子类。卵巢正常功能受机体内分泌及卵巢局部内调节因子协调作用的影响,构成卵巢功能复杂的调节机制。生物活性因子在不同条件下多有变异,目前的研究尚不能全面说明这些因子和外来因素如何协调影响卵泡发育及其在PCOS发病机制中的作用。
蛋白质芯片技术成为满足人们对蛋白质的高通量、高敏感性,平行分析研究的有力工具。国内曾有报道采用WCX2蛋白质芯片检测31例PCOS患者和30例正常对照血清蛋白谱,用质谱仪筛选出PCOS患者与正常对照组相比的23种差异蛋白,从中再次筛选出4种蛋白质组成PCOS的蛋白谱最优化模型,其敏感性和特异性分别为83.3%和86.7%,认为可对PCOS做很好的诊断预测[6]。他们采用的是飞行时间质谱法,该方法虽然简便灵敏特异,不失为一种早期诊断的好方法,但不能明确所筛选出的蛋白标志物为何种蛋白,因此无法确定其作用。而对于PCOS患者,我们除了希望明确诊断外,更希望明确其异质性临床特征的归属性。
目前已商品化并得到广泛应用的蛋白质芯片中的大部分是使用表面加强的激光解吸电离飞行时间质谱方法[7],这种方法能够获得可重复的、统一的质谱图,可用于定量蛋白质研究,其有许多传统蛋白质研究方法无法比拟的优势如高通量、快速、平行、自动化等,已用于多领域的研究。但是它的缺点在于:(1)不能给出除蛋白质的分子量和丰度之外的其它信息,蛋白质的性质与功能尚需其他方法检测;(2)检测的灵敏度在很大程度上取决于配套的仪器设备和生物信息学处理软件,操作复杂,设备昂贵,数据处理尚未规范,因此难以在临床上普遍应用。本研究使用的抗体蛋白质芯片系统,为国内首例报道使用类似芯片用于PCOS患者血液检测,除具有蛋白质芯片的优点外,操作简便易学,无需任何特殊仪器设备,可根据需要调整或扩大抗体库,设计特异性的PCOS蛋白质检测芯片,可能为患者细胞因子调节网络提供更全面的资料,已广泛用于肿瘤等疾病的研究[8]。
本研究使用抗体蛋白质芯片反应体系通过对常见的分泌型蛋白因子库共174种因子的检测筛选,发现共有23种因子在PCOS组升高,降低的因子有GRO、IL-8和Siglec-5。其中表达强度在PCOS组增高达 3倍以上的因子为 IL-1RII、prolactin、IL-7、IGFBP-1、IL-5Ra、IGFBP-4、VEGFR2、ICAM-1 和 MIP-1-delta。这说明PCOS患者可能存在全身性免疫因子改变,以部分生长因子家族成员及炎症因子为主。在这些因子中有的已经证实与PCOS相关,如IGFBP[9]、EGF[10]、VEGF[11]、TNF[12]、ICAM-1[13]、IL-1[14]、Acrp30[15]、TIMP-2[16]、E-selectin[17]、L-selectin[18]等。本研究不仅再次印证了其作用,而且区分出了其作用的亚型,为进一步明确其作用机制及相互影响打下了基础。有些因子为既往没有发现与PCOS相关的蛋白,如 angiogenin、IL-7、IL-8、MIP-1-delta、PDGF-BB、PDGF-AA、PARC、TRAIL-R3、IL-5Ra、M-CSFR和GRO等,为进一步研究其作用提供了依据。通过查找文献筛选出目前无血清学检测结果报道的PDGF-BB及Acrp30,其蛋白质芯片表达强度增加分别为2.8倍和1.5倍。采用 ELISA检测PDGF-BB及Acrp30水平变化,结果与蛋白质芯片检测结果一致且差异具有统计学意义(P<0.05)。
综上所述,本研究初步筛查了小样本PCOS患者的血清蛋白因子水平,发现23种蛋白因子的表达异常,其中9种因子的表达强度在PCOS组较对照组增高3倍以上,为进一步设计特异性的PCOS蛋白质检测芯片打下了基础,并有望使用特异性的PCOS蛋白质检测芯片为PCOS相应的个体化治疗提供依据,为难治病例发展新的治疗方法。
