TRPV1激活对内毒素血症小鼠肺组织炎症损伤的影响及机制*
2013-12-01施孟如徐丽艳韩文文徐子琴邱俏檬卢中秋
施孟如, 南 超, 徐丽艳, 韩文文, 徐子琴, 李 冬, 邱俏檬, 卢中秋△
(1温州医科大学生物学实验教学中心,浙江温州325035;2温州医科大学附属第一医院急诊医学中心,3温州市人民医院,浙江温州325000)
脓毒症是由感染引起的全身炎症反应综合症,可引起脓毒性休克及多器官功能障碍综合征,其中急性肺损伤是最常见的并发症[1]。研究表明,Toll样受体4-核因子 κB(Toll-like receptor 4-nuclear factorκB,TLR4-NF-κB)通路活化介导的过度炎症反应在脓毒症肺损伤中起重要作用[2-3]。瞬时受体电位阳离子通道V亚族成员1(transient receptor potential cation channel,subfamily V,member 1,TRPV1)广泛分布于感觉神经纤维末梢上(C和Aδ),感受伤害性刺激和疼痛。近年发现,TRPV1与TLR4及CD14共定位于感觉神经末梢[4],在脓毒症中可被激活,并调节炎症反应的程度[5-6]。TRPV1活化是否参与调节脓毒症肺损伤的炎症反应过程尚不明确。本研究以腹腔注射脂多糖(lipopolysaccharide,LPS)制造ICR小鼠内毒素血症模型,用辣椒素(capsaicin,CAP)和抗辣椒碱(capsazepine,CAPZ)分别激活和拮抗TRPV1,观察小鼠肺组织TLR4/NF-κB通路及下游肿瘤坏死因子 α(tumor necrosis factorα,TNF-α)、白细胞介素6(interleukin 6,IL-6)和IL-10的变化,以及P物质(substance P,SP)和降血钙素基因相关肽(calcitonin gene-related peptide,CGRP)水平随TRPV1激活的变化情况,探讨TRPV1活化对内毒素血症肺损伤炎症反应的影响及机制。
材料和方法
1 试剂
LPS、CAP 和 CAPZ 购自 Sigma;IL-6、TNF-α、IL-10、CGRP和SP的ELISA试剂盒购自R&D Systems,上海西唐生物科技有限公司进口分装;抗小鼠NF-κB p65Ⅰ抗购自 Abcam;抗小鼠 TLR4Ⅰ抗购自Santa Cruz;辣根过氧化物酶标记山羊抗兔IgG(H+L)购自Milipore;辣根过氧化物酶标记山羊抗小鼠IgG(H+L)、核蛋白提取试剂盒、BCA蛋白浓度测定试剂盒(增强型)、RIPA裂解液(强)、彩色预染蛋白分子量标准、显影剂和定影剂购自碧云天生物技术研究所;ECL发光液购自Advansta。
2 方法
2.1 动物分组及干预 SPF级ICR小鼠108只,雄性,体重(20±2)g,由温州医学院动物中心提供。将小鼠随机分为6组:正常对照组(n=18)、CAP对照组(n=18)、CAPZ对照组(n=18)、内毒素血症组(n=18)、CAP干预组(n=18)和CAPZ干预组(n=18)。正常对照组:给小鼠腹腔注射生理盐水,3 h、8 h和16 h后麻醉活杀;CAP和CAPZ对照组:实验开始前30 min预先给小鼠皮下注射CAP(1 mg/kg)或CAPZ(15 mg/kg),腹腔注射生理盐水后分别于3 h、8 h和16 h麻醉后活杀;内毒素血症组:给小鼠腹腔注射LPS 10 mg/kg后3 h、8 h和16 h麻醉后活杀;CAP和CAPZ干预组:实验开始前30 min预先分别给小鼠皮下注射CAP(1 mg/kg)或CAPZ(15 mg/kg),腹腔注射LPS10 mg/kg后3 h、8 h和16 h麻醉后活杀。以上各组活杀后取肺组织,-70℃保存。
2.2 ELISA法检测肺组织细胞因子、SP及CGRP表达 取10%肺组织匀浆,用BCA法测定蛋白浓度,采用 ELISA 法检测肺组织 SP、CGRP、IL-6、TNF-α 和IL-10水平,严格按照试剂盒说明书操作,检测各因子浓度值,将浓度值除以相应各样本蛋白浓度值,得出各因子相对水平。
2.3 Western blotting检测肺组织TLR4和核内NF-κB表达 按照核蛋白提取试剂盒说明书提取肺组织核蛋白,BCA法测定蛋白浓度。取40μg蛋白上样量,先进行SDS-聚丙烯酰胺凝胶电泳,后转膜、封闭,Ⅰ抗、Ⅱ抗孵育,ECL显影,曝光。Quantity One分析软件进行灰度分析,用同一目的蛋白与内参照灰度比值表示此目的蛋白的相对含量。
2.4 肺组织病理学改变 小鼠活杀后取肺组织,经4%多聚甲醛固定,石蜡包埋,连续切片,HE染色,观察肺组织病理学改变。
3 统计学处理
采用SPSS 19.0软件处理,数据以均数±标准差(mean±SD)表示。多样本间数据比较采用单因素方差分析,组间两两比较采用LSD检验,若方差不齐则进行秩和检验,以P<0.05为差异有统计学意义。
结 果
1 内毒素血症组小鼠行为学改变及CAP和CAPZ的影响
正常对照组、CAP对照组和CAPZ对照组小鼠反应灵敏,呼吸平稳,黏膜红润,皮毛光滑,行动自如。内毒素血症模型组则在2 h左右出现精神萎靡,呼吸急促,倦怠懒动,反应变慢,进食减少,四肢水肿,其中下肢水肿稍重;8 h上述症状加重,反应迟钝,可见眼部有较多分泌物,体温降低,四肢发抖;16 h精神更加萎靡,刺激后无反应,眼部因分泌物较多而无法睁开,口唇发绀,体温较低,四肢冰冷。CAP干预组小鼠症状较内毒素血症组明显减轻,而CAPZ干预组小鼠症状稍有加重。
2 CAP和CAPZ对内毒素血症组小鼠肺组织TNF-α、IL-6和IL-10水平的影响
由图1可见,与同时点正常组比较,内毒素血症模型组TNF-α、IL-6和IL-10在各时点明显升高(P<0.05),且分别在8 h、16 h 和16 h 达峰值,CAP 对照组和CAPZ对照组与之比较差异无统计学意义(P>0.05);与同时点内毒素血症模型组比较,CAP干预组TNF-α和IL-6在3 h、8h和16 h 3个时点明显降低(P <0.05),而其 IL-10 则在3 h、8 h和16 h 3 个时点明显升高(P<0.05),CAPZ干预组则反之(P<0.05)。
3 CAP和CAPZ对内毒素血症组小鼠肺组织SP和CGRP水平的影响
由表1、2可见,与正常组比较,内毒素血症组各时点SP和CGRP明显升高(P<0.05),且均于8 h达峰值,CAP对照组和CAPZ对照组各时点SP和CGRP也有明显变化(P<0.05),但升幅不及同时点内毒素血症组及CAP干预组明显;与同时点内毒素血症组比较,CAP干预组各时点SP和CGRP升高明显(P <0.05),CAPZ干预组则降低明显(P <0.05)。
4 内毒素血症组小鼠肺组织TLR4和NF-κB水平的变化及CAP和CAPZ的作用
与同时点正常对照组相比,内毒素血症组小鼠肺组织TLR4水平明显升高(P<0.05),且在8 h达峰值,CAP对照组和CAPZ对照组TLR4表达水平变化无统计学意义(P>0.05);与同时点内毒素血症组相比,CAP干预组和CAPZ干预组TLR4表达水平变化不明显(P >0.05),见图2、表3。
与同时点正常对照组相比,内毒素血症组小鼠肺组织核内NF-κB水平明显升高(P<0.05),且在8 h达峰值,CAP对照组、CAPZ对照组NF-κB无明显变化(P>0.05);与内毒素血症组比较,CAP干预组小鼠肺组织核内NF-κB水平明显降低(P<0.05),而CAPZ干预组则明显升高(P<0.05),见图3、表4。
5 小鼠肺组织病理学改变
光镜下可见,正常对照组、CAP对照组和CAPZ对照组肺组织结构完整清晰,肺泡腔内无炎症细胞浸润,肺间质无渗出;内毒素血症组8 h和16 h可见肺泡大小不等,部分肺泡壁断裂呈气肿状,部分肺泡萎陷,肺泡壁增宽,肺泡毛细血管扩张,肺间质见多形核炎症细胞浸润;与内毒素血症组相比,CAP干预组肺泡壁毛细血管扩张、炎症细胞浸润及间质水肿程度明显减轻;CAPZ干预组无明显加重,见图4。
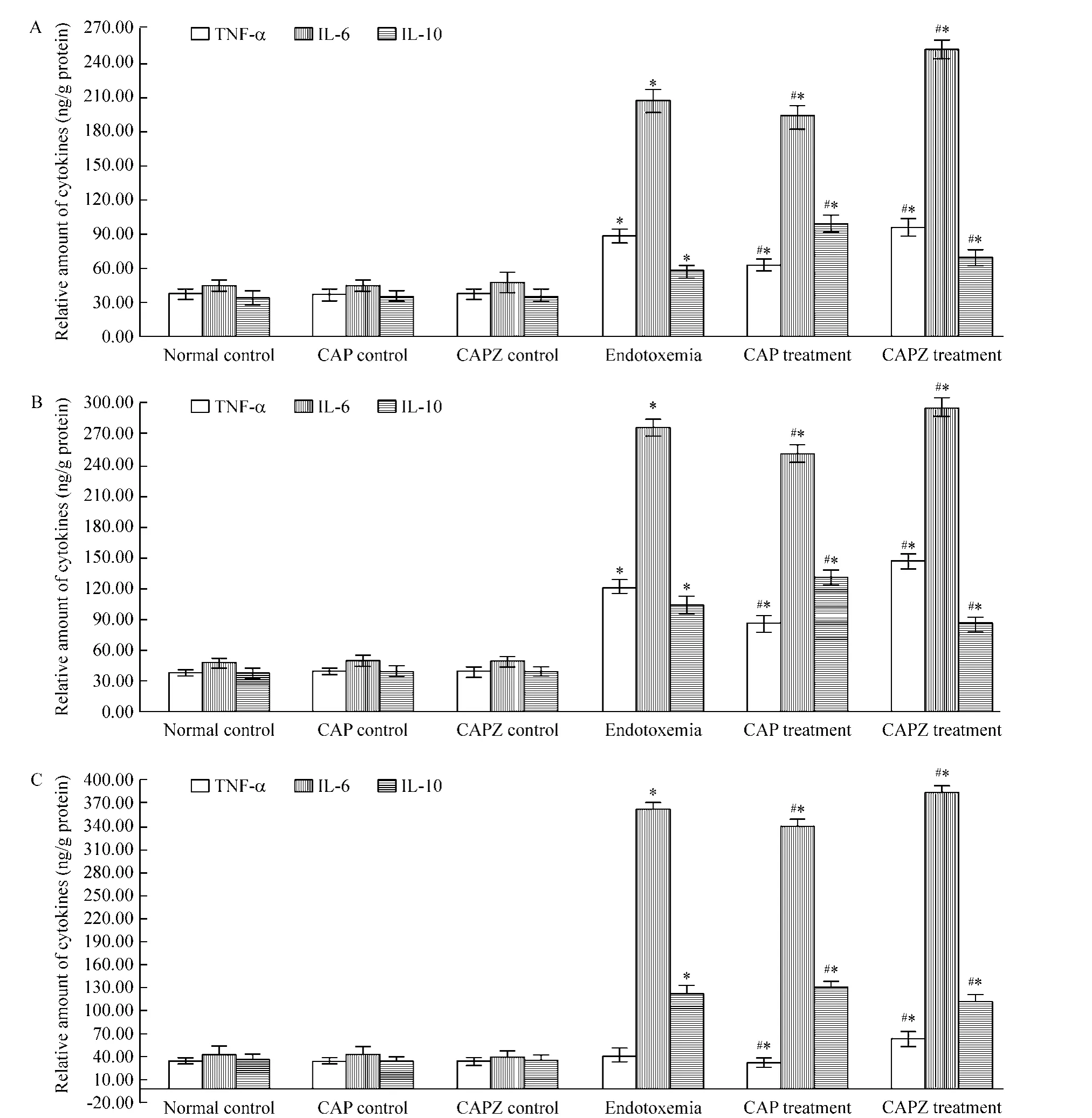
Figure 1.Changes of cytokines in the lung tissue of mice at 3 h(A),8 h(B)and 16 h(C).Mean ± SD.n=6.*P <0.05 vs normal control group;#P <0.05 vs endotoxemia group.图1 不同时点小鼠肺组织细胞因子的变化
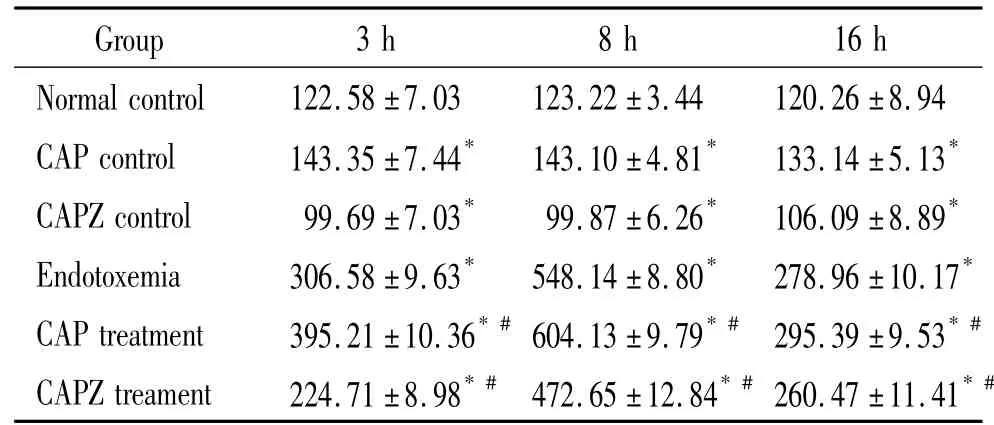
表1 不同时点小鼠肺组织SP水平变化Table 1.Changes of substance Pin the lung tissue of mice at different time points[ng/(g protein).Mean ±SD.n=6]
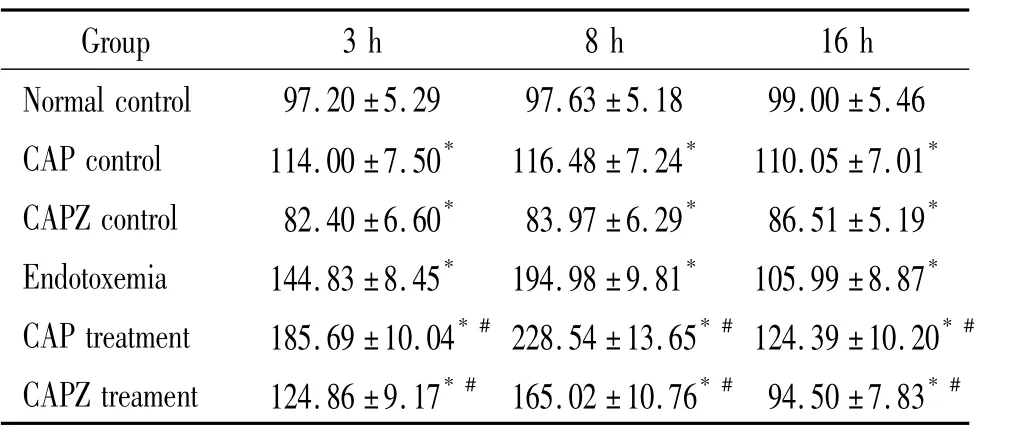
表2 各时点小鼠肺组织CGRP水平变化Table 2.Changes of CGRPin the lung tissue of mice at different time points[ng/(g protein).Mean ± SD.n=6]
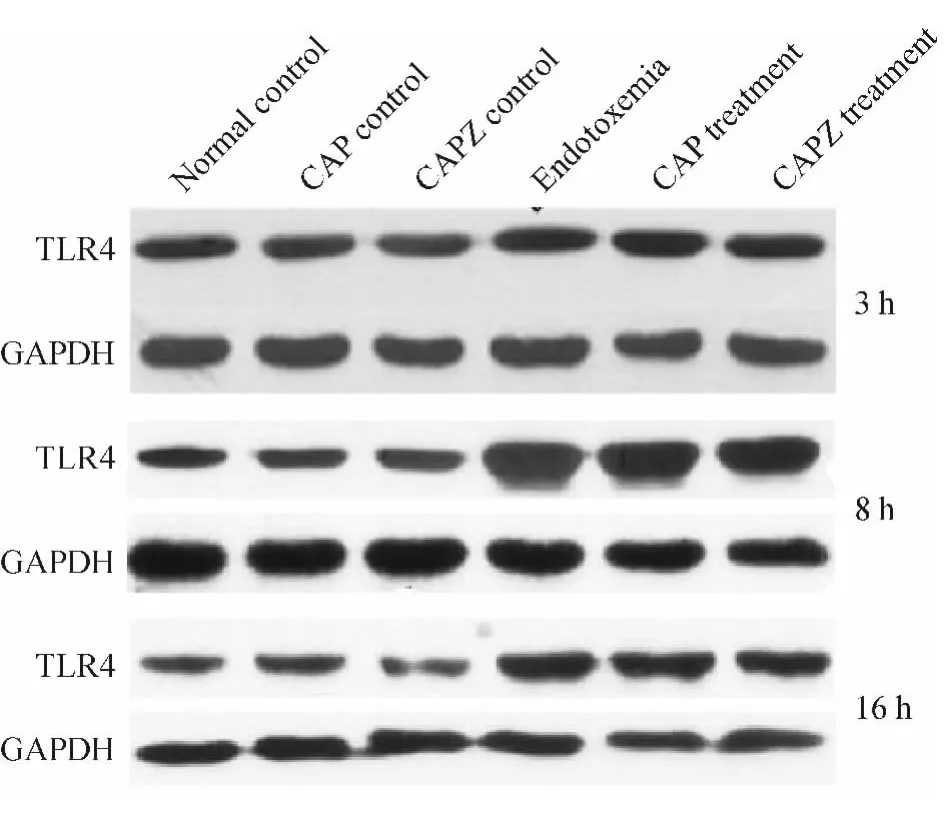
Figure 2.Changes of TLR4 protein in the lung tissue of mice at different time points.图2 不同时点各组小鼠肺组织TLR4水平变化

表3 不同时点各组小鼠肺组织TLR4相对表达量的变化Table 3.Changes of TLR4 protein relative quantity in the lung tissue of mice at different time points(Mean±SD.n=6)
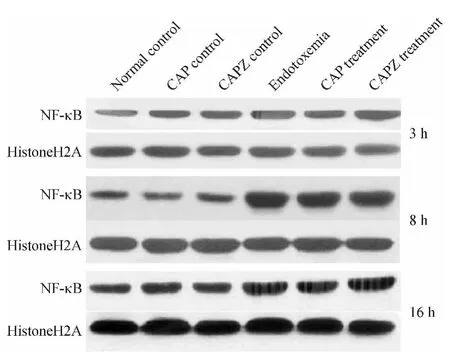
Figure 3.Changes of NF-κB protein in the lung tissue of mice at different time points.图3 不同时点各组小鼠肺组织NF-κB表达变化
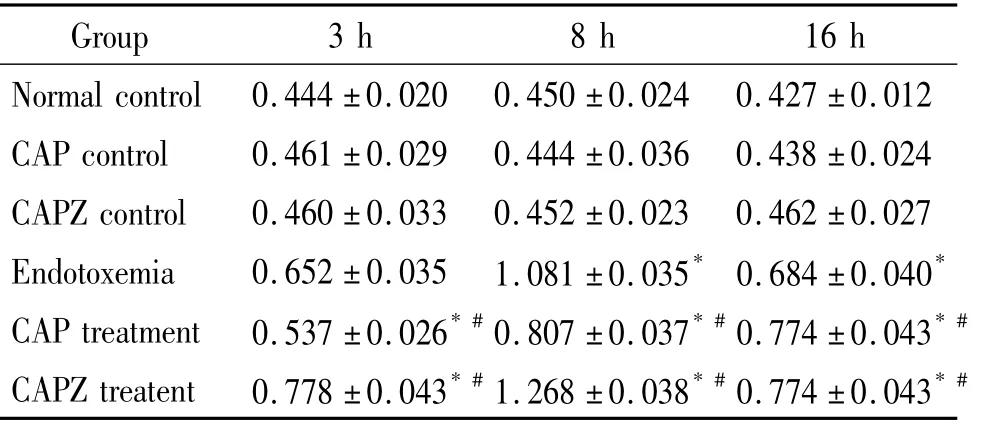
表4 不同时点各组小鼠肺组织NF-κB相对表达量的变化Table 4.Changes of NF-κB protein relative quantity in the lung tissue of mice at different time points(Mean±SD.n=6)

Figure 4.Pathological changes of the lung tissue of mice in different groups(HE staining,×200).A:normal control;B:CAP control;C:CAPZ control;D:endotoxemia;E:CAPtreatment;F:CAPZ treatment.图4 各组小鼠肺组织病理学改变
讨 论
TRPV1是一种非选择性阳离子通道,可被辣椒素激活,也可被脂质、质子、阳离子、有害热等激活[7],主要定位于分泌SP和CGRP的感觉神经纤维(C和Aδ),CAP是其激动剂,而CAPZ是其拮抗剂。TRPV1作为伤害性刺激感受器,激活时炎症或骨癌中的疼痛反应会加重。目前,有人用不同剂量CAP干预大鼠脓毒症模型,结果发现小剂量CAP可降低脓毒症大鼠 TNF-α和 IL-6,升高 IL-10,而大剂量CAP则可使大鼠脓毒症加重[6],本文采用了小剂量CAP干预内毒素血症小鼠,并在其基础上进一步检测了NF-κB和TLR4水平,结果发现TRPV1激活后明显降低内毒素血症小鼠TNF-α和IL-6水平,升高IL-10,而TRPV1拮抗后效果与之相反,这在正反两方面说明TRPV1激活后可减轻内毒素血症小鼠肺组织炎症反应程度,减少肺损伤。CAP对照组以及CAPZ对照组炎症因子水平较正常对照组无显著变化,这说明TRPV1在正常状态下不能影响以上炎症因子的表达。但与此同时,TRPV1激活后可调节NF-κB水平却不能调节TLR4水平,这说明TRPV1在内毒素血症中的调节作用不是通过TLR4实现的。而先前Diogenes等[8]也发现,用LPS刺激三叉神经可激活TRPV1受体,但用TLR4拮抗剂阻断TLR4后,TRPV1无法被激活,由此可以推测,TLR4可能位于TRPV1调节位点上游。
众所周知,TRPV1激活后可导致SP和CGRP水平升高,故肺组织SP和CGRP水平可以作为TRPV1激活与否的指示剂。另外,CAP对照组的SP以及CGRP水平显著升高,而其NF-κB水平变化却不明显,其原因可能有以下3个:(1)在没有LPS刺激情况下,NF-κB激活基础量较低,可能 SP以及 CGRP的升高对其激活量变化有影响,但是幅度较低,在WB图像上表现不明显。(2)也可能SP和CGRP的对NF-κB的调控作用比较复杂,在没有LPS刺激情况下,CAP激活所导致的SP以及CGRP水平较低,SP以及CGRP在水平较低情况下对NF-κB作用平衡关系较大剂量的情况不一样,所呈现出来的综合结果就是NF-κB表达没有受到明显影响,这需要通过实验明确。(3)CAP干预组NF-κB水平变化较明显,而CAP对照组NF-κB水平变化不明显,可能是因为CAP对NF-κB的作用必须在有LPS刺激的情况下才能发挥,这点需要通过细胞实验进一步证实。
关于TRPV1激活影响NF-κB活化的机制尚不明确。本研究表明,脓毒症小鼠TRPV1激活后血清SP和CGRP水平升高,而后两者可能是参与调节NF-κB活化及炎症反应水平的重要物质。Ang等[9]研究发现,SP的升高能激活ERK1/2并诱导NF-κB活化,促进炎症反应。尽管这一作用机制不能解释我们研究结果,但揭示了SP可能是TRPV1激活后影响NF-κB活化的可能机制。另有研究显示,CGRP可降低脓毒症小鼠血清TNF-α水平、提高IL-10和IL-6水平[10],且可抑制朗格汉斯细胞中NF-κB的激活[11],可见CGRP也参与了 TRPV1激活影响 NF-κB活化的过程。然而,尽管TRPV1的激活后可促进血清SP水平的升高,但同时TRPV1激活可导致生长抑素的释放[12],而后者却可抑制 SP 的释放[13],由此可见,TRPV1激活后SP水平受到双向调控。所以,TRPV1激活后可能SP及CGRP影响NF-κB活化及炎症反应,但是TRPV1激活对SP及CGRP的调控非常复杂,有待进一步研究阐明。
综上所述,内毒素血症小鼠TRPV1激活可能通过SP及CGRP影响NF-κB水平并降低肺组织炎症因子水平,减轻肺部炎症损伤,这为脓毒症肺损伤治疗提供了新思路和靶标。
