婆罗双树样基因4在人前列腺癌细胞和组织中的表达及其与临床预后之间的关系*
2013-12-01赖义明凌逸虹曾乐祥陈杰青余永晟张思敏张一鸣王淦平郭正辉
赖义明, 黄 海, 凌逸虹, 曾乐祥, 陈杰青, 曹 亿,余永晟, 张思敏, 张一鸣, 李 金, 王淦平, 郭正辉△
(中山大学孙逸仙纪念医院1泌尿外科,3小儿外科,5急诊外科,广东广州510120;2中山大学肿瘤防治中心病理科,广州510060;4深圳市第二人民医院泌尿外科,广东深圳518035;6增城市人民医院泌尿外科,广东广州511300)
前列腺癌是男性最常见的恶性肿瘤之一,其发病率在世界范围内逐年增加[1]。前列腺癌早期无明显症状,大部分患者在发现时已是晚期,错失最佳的治疗时机,因此,寻找具有高度灵敏性和特异性的前列腺癌肿瘤标记物很有必要。婆罗双树基因(Spalt,SAL)最早在果蝇中发现,在果蝇的生长发育中发挥着重要作用[2]。婆罗双树样基因 4(Sal-like 4,SALL4)是SAL的4个人类同源异型基因之一,其编码的蛋白包含多个C2H2双锌指结构域(zinc finger,ZF),是一种广泛表达的转录因子。近年来的研究发现SALL4蛋白在胚胎干细胞的干性维持、自我更新及快速增殖过程中发挥着重要的调控作用[3],SALL4表达对于生殖细胞肿瘤、急性髓性白血病、骨髓增生异常综合征、乳腺癌及肺癌等肿瘤的诊断具有重要的临床意义[4-8]。目前,国内外尚未有关于SALL4在前列腺癌中的相关研究,其在正常前列腺以及前列腺癌组织中的表达情况尚不清楚。本研究通过前列腺癌细胞系、良性增生前列腺和前列腺癌组织切片,应用间接免疫荧光、RT-PCR、Western blotting和免疫组化的方法,探讨SALL4蛋白在前列腺癌中的表达情况,并阐明其和临床病理学参数之间的关系。
材料和方法
1 材料
1.1 主要试剂 RNAiso Plus总RNA提取试剂、逆转录试剂盒和RT-PCR试剂盒购自TaKaRa。SALL4兔抗人多克隆抗体购自Abcam。免疫组织化学的工作浓度为1∶50,采用北京中杉金桥生物技术有限公司的免疫组化试剂。Dylight 488标记的山羊抗兔IgG购自杭州联科生物技术有限公司。其它试剂购自江苏碧云天生物技术研究所。
1.2 前列腺癌细胞系及组织标本 (1)人前列腺癌LNCaP、DU145和PC-3细胞系以及正常前列腺上皮RWPE-1细胞系由中山大学孙逸仙纪念医院林百欣医学研究中心获得。(2)前列腺石蜡标本为2007~2012年中山大学孙逸仙纪念医院泌尿外科手术标本。其中前列腺癌组织68例,前列腺增生组织30例,正常前列腺组织采用内对照共68例,年龄(66.5±8.1)岁,所有标本均为初发,术前未做任何治疗,术后均由甲醛固定,石蜡包埋保存。标本均由中山大学孙逸仙纪念医院病理科提供。
2 方法
2.1 免疫荧光染色法 将处于对数生长期的LNCaP、DU145、PC-3和RWPE-1细胞接种于24孔培养板,于37℃、5%CO2孵箱内培养24 h,用PBS洗3次;用4%多聚甲醛和0.1%Triton X-100固定通透各30 min,PBS洗3次;用1% 牛血清白蛋白室温封闭1 h;加入SALL4兔抗人多克隆抗体(1∶100),4℃孵育过夜后用PBS洗3次,同时用正常兔血清代替Ⅰ抗作为对照同法进行反应,用来验证兔抗人SALL4抗体的特异性;加入1∶100稀释的 Dylight 488-山羊抗兔IgG,于室温摇床孵育1 h,PBS洗3次;DAPI(1∶1 000)复染核1 min,PBS 洗3 次,荧光显微镜观察结果。
2.2 RT-PCR检测前列腺癌LNCaP、DU145和PC-3细胞系以及正常前列腺上皮RWPE-1细胞系中SALL4 mRNA的表达 取 LNCaP、DU145、PC-3和RWPE-1细胞培养瓶加入RNAiso Plus 1 mL,待细胞彻底匀浆后转移至1.5 mL EP管,按RNAiso Plus说明书提取细胞总RNA。提取后溶于去离子水中,测量RNA含量。取上述各样本总RNA各1μg,按25μL体系进行反转录反应,反应条件为:37℃ 15 min,85℃5 s,4℃ 1 s。PCR 引物由 Invitrogen合成,SALL4引物序列为:正义链 5’-CCCGGCAGTAAGGACTGTC-3’,反义链 5’-TCTCTGTCTTTAGGTACACCACA-3’。PCR产物为97 bp,PCR反应体系:98℃ 10 s,55℃30 s,72℃ 30 s,共32个循环。RT-PCR产物的半定量分析:琼脂糖凝胶电泳后观察结果。应用凝胶图像扫描系统对扩增产物的电泳条带进行吸光度扫描,计算出SALL4与GAPDH的吸光度(A)比值,结果以SALL4/GAPDH表示。
2.3 Western blotting法检测前列腺癌 LNCaP、DU145和PC-3细胞系以及正常前列腺上皮RWPE-1细胞系中SALL4蛋白的表达 向细胞加入含有PMSF的 RIPA裂解液,冰上裂解 30 min。4℃、12 000 r/min离心30 min,将上清移至新的EP管。然后对所得的蛋白液进行BCA法测浓度。配制8%分离胶和5%浓缩胶,按每孔50μg的上样量恒压电泳。然后将蛋白电转到PVDF膜后,用5%脱脂奶粉封闭。将目的条带孵育在 GAPDH(1∶1 000,碧云天)和SALL4(1∶800,Abcam)Ⅰ抗稀释液中4℃过夜。第2天再孵育Ⅱ抗1 h,然后用超敏ECL发光液(Millipore)及黑白胶片(柯达)进行曝光。
2.4 免疫组化染色检测前列腺组织中SALL4蛋白的表达 前列腺癌和增生前列腺组织4 mm厚石蜡切片,二甲苯脱蜡10 min×2,梯度乙醇水化。将切片浸入3%过氧化氢,避光作用10 min,PBS洗片3次,将切片放入柠檬酸钠-EDTA抗原修复液(碧云天)塑料盒中,微波炉抗原修复21 min(高火7 min,中火14 min),冷却至室温。PBS洗片2次,擦净周围水分,滴加第Ⅰ抗体,湿盒内4℃ 孵育过夜,PBS洗片2次。擦净周围水分,滴加Ⅱ抗,湿盒内室温30 min,PBS洗片2次。擦净周围水分,滴加DAB显色剂(中杉金桥),3~5 min后显微镜观察染色的效果,自来水终止反应。擦净周围水分,滴加苏木素(1∶20,中杉金桥)染核5 min,自来水终止反应。光学显微镜下读片,记录染色强度,封固。SALL4阳性染色标准:染色均匀,呈棕色颗粒样。对染色结果进行半定量判定:染色强度依次为0分(无色),1分(淡黄色),2分(棕黄色),3分(棕褐色);染色范围以染色细胞所占的百分比评分:阳性细胞<25%为0分,25% ~50%为1分,51% ~75%为2分,>75%为3分。染色强度和阳性细胞百分比的乘积为免疫组化的结果:0分判断为(-),1分和2分判断为(+),3分和4分判断为(++),6分和 9分判断为(+++)。
3 统计学处理
应用SPSS 17.0统计软件分析,计数资料采用卡方检验,等级资料采用秩和检验,计量资料数据以均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 LNCaP、DU145、PC-3 和 RWPE-1 细胞中SALL4的定位分析
用兔抗人SALL4抗体作为Ⅰ抗建立间接细胞免疫荧光法,对 LNCaP、DU145、PC-3和 RWPE-1细胞中SALL4蛋白的表达分布进行检测,结果显示,RWPE-1细胞中SALL4含量较低,荧光显微镜下只见微弱荧光;LNCaP、DU145和PC-3细胞内SALL4表达量较RWPE-1细胞显著增强,且主要分布在细胞浆内,胞核和胞膜也有少量表达,见图1。用PBS代替Ⅰ抗作为对照,按同法与上述4种细胞进行反应,荧光显微镜下均未见细胞出现荧光。
2 RT-PCR检测前列腺癌细胞系及正常前列腺细胞SALL4 mRNA的表达
由图2可见,目标基因及内参照条带清晰,比例正确。A260/A280分别为 1.895、1.955、1.926 和1.885,RNA质量满意。被扩增的2条DNA片段分别为 SALL4和GAPDH。SALL4 mRNA在RWPE-1、LNCaP、DU145和PC-3细胞中均有表达,表达水平无明显差异(P >0.05)。
3 Western blotting检测前列腺癌细胞系及正常前列腺细胞SALL4蛋白的表达
从图3中可以看出3种前列腺癌细胞中SALL4蛋白的表达量要明显高于正常前列腺上皮细胞,差异均有统计学意义(P<0.05)。
4 免疫组化染色检测前列腺癌、前列腺增生及正常前列腺组织中SALL4蛋白的表达
染色结果显示,阳性染色仅见于前列腺癌上皮细胞及部分增生前列腺上皮细胞和少量正常前列腺上皮细胞,前列腺癌基底细胞、间质细胞均未见阳性染色,见图4。SALL4在前列腺癌组织中的蛋白表达水平明显高于增生前列腺和正常前列腺(P<0.01),而在正常前列腺和增生前列腺间的表达水平无显著差异,见表1。SALL4表达水平与Gleason评分、前列腺癌临床分期、预后及组织前列腺特异抗原(prostatespecific antigen,PSA)表达密切相关;而与患者年龄、治疗前血清总PSA水平、前列腺体积及组织雄激素受体(androgen receptor,AR)表达无明显相关性,见表2。
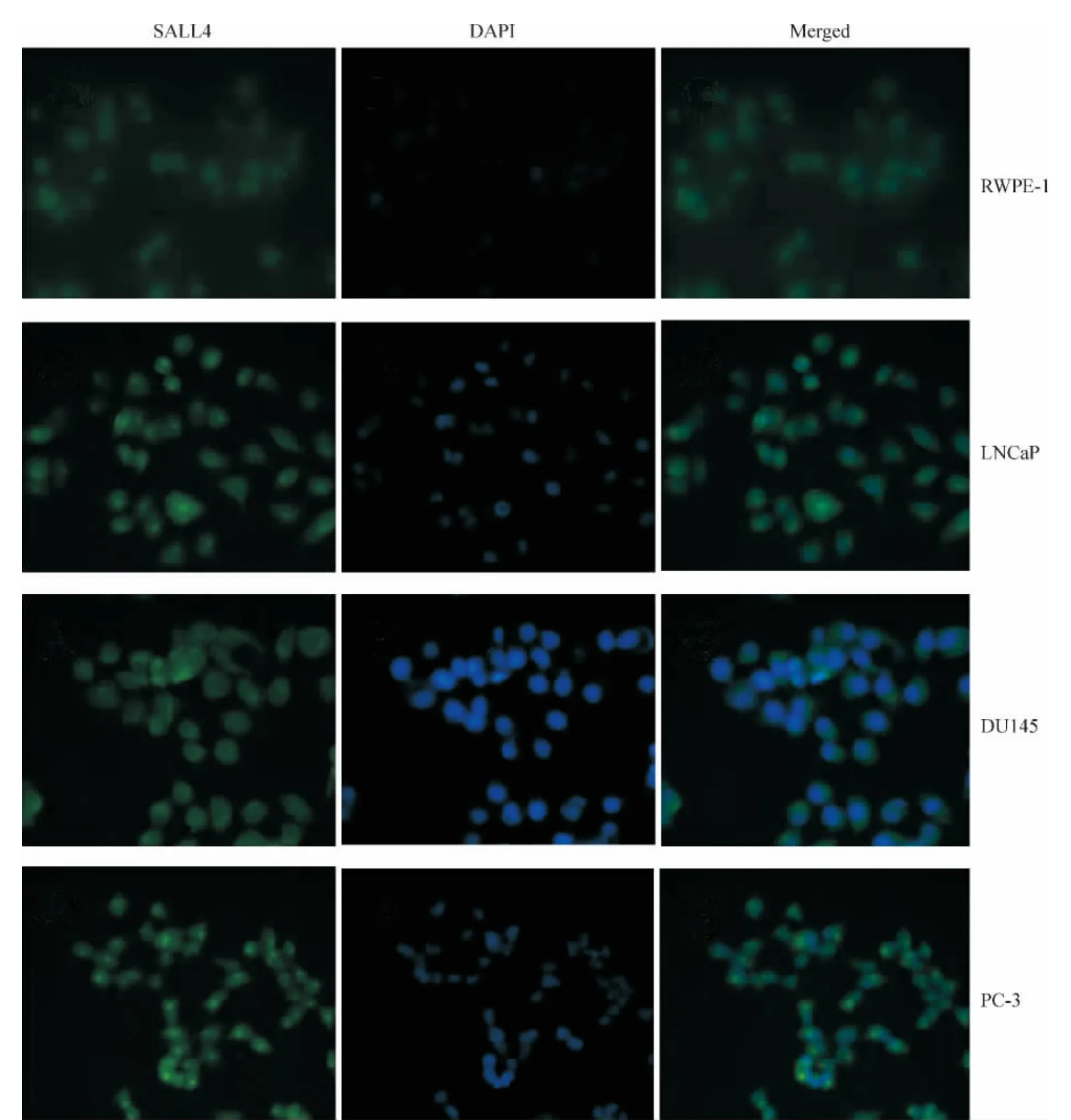
Figure 1.Intracellular distribution of SALL4 in LNCaP,DU145,PC-3 and RWPE-1 cells detected by immunofluorescence(×400).图1 免疫荧光染色法检测LNCaP、DU145、PC-3和RWPE-1细胞中SALL4的表达分布
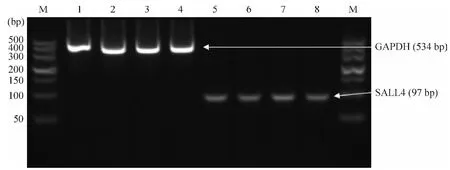
Figure 2.Expression of SALL4 mRNA in prostate cancer cell lines LNCaP,DU145 and PC-3,and normal prostate epithelial cell line RWPE-1.M:marker;1:RWPE-1;2:LNCaP;3:DU145;4:PC-3;5:RWPE-1;6:LNCaP;7:DU145;8:PC-3.图2 前列腺癌LNCaP、DU145和PC-3细胞系以及正常前列腺上皮RWPE-1细胞系SALL4 mRNA的表达
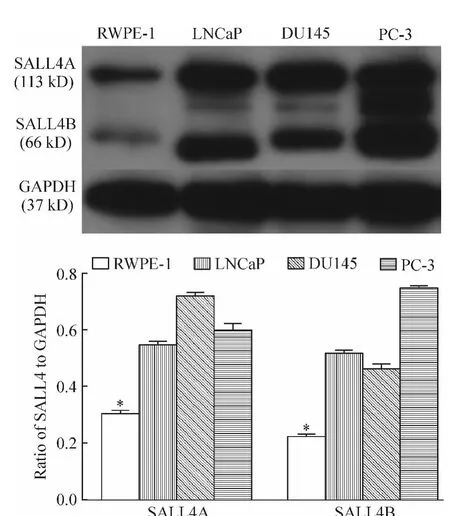
Figure 3.The expression of SALL4 proteins in prostate cancer cell lines LNCaP,DU145 and PC-3,and normal prostate epithelial cell line RWPE-1 was evaluated by Western blotting.Mean ± SD.n=3.*P < 0.05 vs LNCaP,DU145 and PC-3 cells.图3 前列腺癌LNCaP、DU145和PC-3细胞系以及正常前列腺上皮RWPE-1细胞系SALL4蛋白的表达
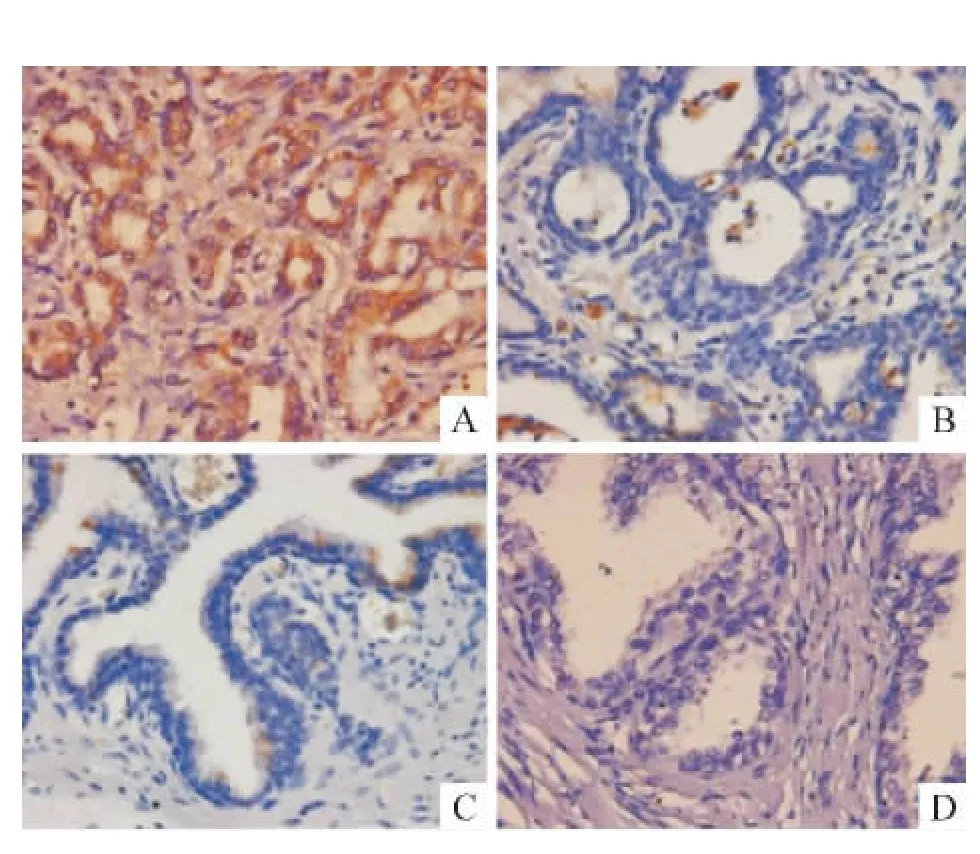
Figure 4.Expression of SALL4 protein in prostate tissues(immunohistochemistry,× 400).A:cancerous prostate tissues,SALL4 was located in the cytoplasm and part of it in the nucleus;B:hyperplastic prostate tissues,both cytoplasm and nucleus were negative;C:normal prostate tissues,both cytoplasm and nucleus were negative;D:negative control.图4 SALL4蛋白在前列腺组织中表达

表1 前列腺癌、增生前列腺和正常前列腺组织SALL4染色结果Table 1.Positive staining of SALL4 in cancerous,hyperplastic and normal prostate tissues
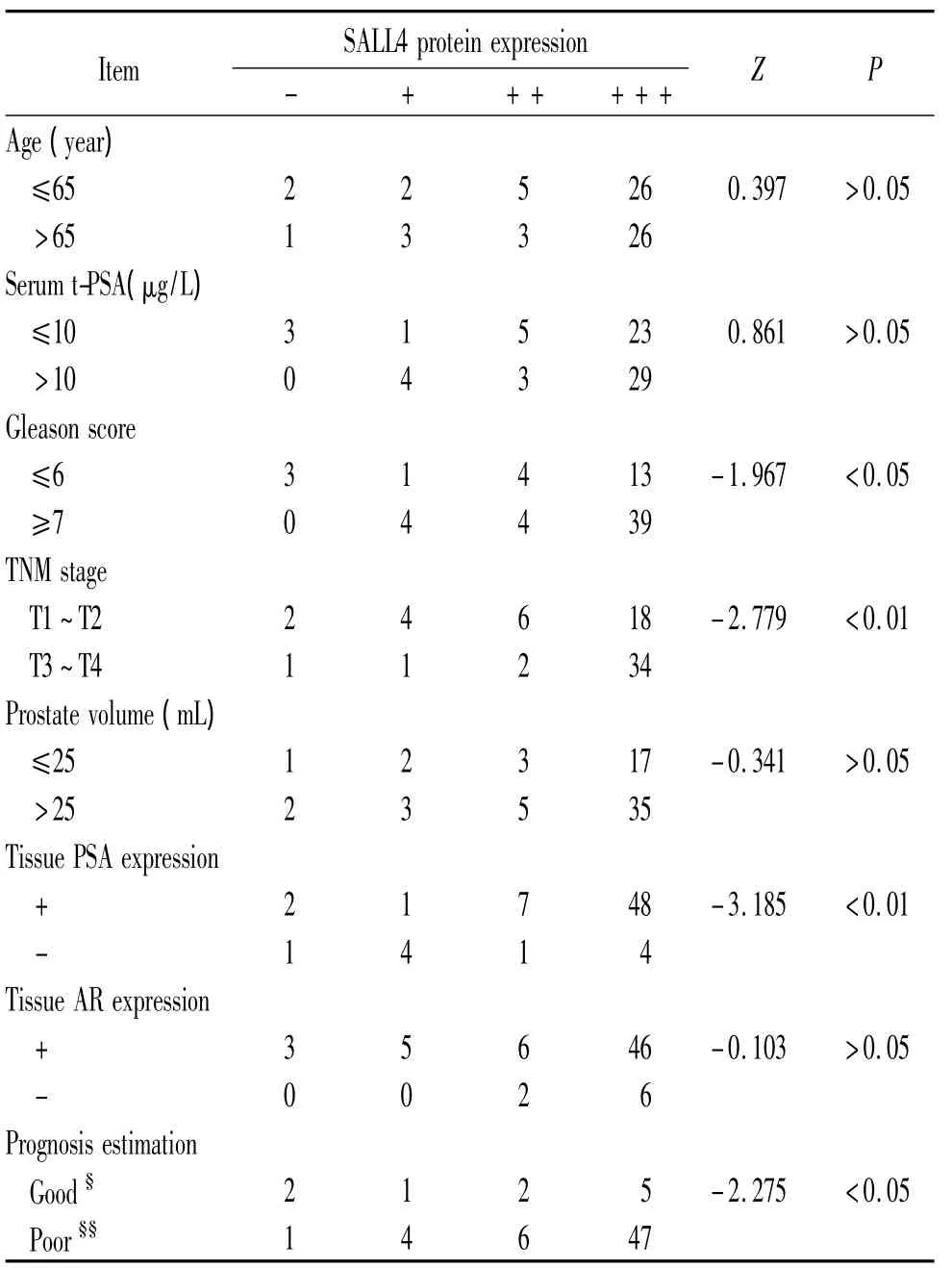
表2 68例前列腺癌病理组织的临床病理资料与SALL4蛋白表达的相关分析Table 2.Correlation of the SALL4 expression with the clinicopathologic features of 68 prostate cancer cases
讨 论
前列腺癌的生物学行为和病理组织形态均较为复杂,单纯地依靠任何一种常规的病理学观察或临床检查结果来判断前列腺癌患者病情的恶性程度和预后常存在一定的困难和偏差,常引起漏诊、误诊。PSA作为前列腺癌标记物被广泛应用于前列腺癌的筛查,但是很多良性前列腺疾病以及包括直肠指诊、前列腺穿刺活检等在内的多种常规检查方法均可导致血清PSA水平的升高,这严重影响了PSA单独用于诊断前列腺癌的准确性。怀疑前列腺癌,治疗前血清PSA在4.0~10.0μg/L范围内,行穿刺活检的患者约有高达75%被证实为非癌[9]。寻求新的高灵敏性和特异性的前列腺癌肿瘤标记物显得迫切而且非常重要。前列腺癌的基础研究表明,多种基因及相关分子共同参与了前列腺癌的发生、发展,其中SALL4基因是SALL家族成员之一,定位于人染色体20q13.13 ~ 13.2。SALL 基 因 家 族 包 括 SALL1 到SALL4 4个成员,最早克隆于与果蝇同源的DNA序列(Sal)[2]。Sal是果蝇生长发育必须的同源异构基因[10]。人类SALL基因家族与人的正常生长发育密切相关[11]。
SALL4包含4个外显子,由于外显子2内部拼接模式的不同,其可以编码SALL4A和SALL4B 2种异构体蛋白。SALL4A和SALL4B表达广泛且具有组织特异性,可见于脑、肺、肾、睾丸、卵巢和CD34+细胞,但后者不表达于 CD34+细胞[5]。SALL4A 和SALL4B能够形成同质或异质二聚体,并在早期胚胎发育中发挥重要作用[12]。SALL4A和SALL4B虽然有许多相似的结构,但它们也有不完全相同的结合位点,它们可以与不同的干性因子相互作用,在小鼠胚胎干细胞中仅需SALL4B的存在就可以维持其多能状态[13]。在人类中,SALL4的缺失或突变与多种疾病相关,包括Okihiro综合征、acro-renal-ocular综合征和IVIC综合征,这些疾病均以多器官畸形为特征,如耳畸形、听力丧失以及肢体、心脏和肾脏等脏器的缺陷等[14-16]。与许多胚胎干性因子不同,SALL4可以在成体干细胞尤其是造血前体细胞中表达,SALL4可以通过下游的Bmi-1调节造血细胞的生长[17]。SALL4的过度表达能促进造血干/祖细胞的增殖和维持自我更新[18]。SALL4调控干细胞命运和造血干/祖细胞自我更新的功能可能与表观遗传机制有关[19]。
本研究结果显示SALL4蛋白在细胞中主要表达于胞浆,在胞核中也有微量表达,在3种前列腺癌细胞株中SALL4的蛋白表达水平均要明显高于正常前列腺上皮细胞RWPE-1(P<0.05),而SALL4 mRNA的表达水平在4种细胞系中无明显差异(P>0.05),说明SALL4可能主要在蛋白水平起作用。免疫组化结果显示正常前列腺与前列腺增生组织中SALL4阳性表达分别为22.06%和23.33%,而在前列腺癌中有接近95.6%的标本 SALL4阳性表达显著增高(P<0.01),而且其阳性表达强度与 Gleason评分、临床分期、预后及组织中PSA的表达密切相关。有类似的研究表明SALL4过表达于不同的恶性肿瘤,在结直肠癌中,大约90%的肿瘤标本有SALL4过表达,并且与肿瘤淋巴结转移及分化程度密切相关[20],在乳腺癌中也有86.1%的肿瘤SALL4表达增高,甚至在肿瘤的早期就可以增高[7]。此外,有研究发现93%的肺癌有 SALL4 表达水平的增高[8]。Cao等[4]的研究表明在所有类型的睾丸生殖细胞肿瘤中,SALL4是维持肿瘤低分化状态所必须的。另外,SALL4也表达于超过90%的转移性精原细胞瘤、未成熟型畸胎瘤、胚胎性癌,SALL4可作为睾丸、卵巢和性腺外转移性生殖细胞肿瘤一种新的诊断标志物[21]。目前有研究表明 SALL4 与 Wnt、PTEN、NFКB及凋亡等信号通路密切相关,如在结直肠癌中,SALL4过表达可以通过转录抑制促凋亡基因PTEN而抑制肿瘤细胞凋亡,并且通过表观遗传修饰Bmi-1使上皮细胞分化基因持续受到抑制,引起结直肠癌细胞发生上皮-间充质转化(epithelial-mesenchymal transition,EMT)丧失黏附性而促进其转移到淋巴结中[20]。在乳腺癌中,SALL4可抑制黏附基因CDH1并且上调CDH1抑制基因ZEB1,从而促进乳腺癌的转移[22]。我们前期研究发现前列腺特异性膜抗原可能通过上调ERK蛋白的活性正向调节前列腺癌细胞的生长、迁移,进一步检测发现不同情况下ERK与SALL4的表达具有高度的一致性,磷酸化的ERK可能通过进入胞内激活SALL4启动肿瘤细胞快速增殖机制[23-24]。这些研究提示在前列腺癌中SALL4表达的增高也可能通过上述信号通路起作用。
本研究在前列腺癌中阐明了SALL4在蛋白表达水平作为肿瘤标志物的临床重要性。结合我们的研究结果和相关文献,我们认为SALL4对于前列腺癌的研究具有重要意义,SALL4蛋白可能成为未来前列腺癌诊断和预后评估的重要标记物。它在前列腺癌进展中的作用可以通过它在前列腺癌中过度表达并且与Gleason评分、临床分期、预后及组织中PSA这几个代表着恶性程度的指标密切相关被证明。SALL4蛋白可能将成为诊断前列腺癌新的肿瘤标志物,并可能具有评估前列腺癌患者病情、指导临床治疗方案及判断预后的作用。但在前列腺癌发生发展的过程中,SALL4的具体生物学作用和调控机制还有待进一步研究。
