固定化氧化还原介体强化酸性红B生物脱色作用研究
2013-11-28马志远许志芳张晨晓郭建博
马志远,许志芳,康 丽,张晨晓,廉 静,郭建博
(1.河北省环境地质勘查院,河北石家庄 050021;2.河北科技大学环境科学与工程学院,河北石家庄 050018;3.邢台市环境科学研究院,河北邢台 054000)
偶氮染料是一种被广泛应用于纺织、颜料、皮革和塑料等行业的人工合成染料[1-2],目前该废水的处理主要采用生物法[3-4]。最近研究表明氧化还原介体的引入能加速电子供体与电子受体间的电子传递速率,可使偶氮染料的还原速率提高一个到几个数量级[5-6]。崔姗姗等开展了水溶性氧化还原介体对酸性橙Ⅱ(AO7)厌氧生物脱色的影响,结果表明蒽醌-2-磺酸钠(AQS)、蒽醌-2,6-二磺酸钠(AQDS)对厌氧脱色过程的促进效果明显,反应速率常数分别提高了199%和760%[7]。张隆等开展了酸性偶氮染料的生物还原产物对偶氮染料生物脱色的催化强化作用的研究,结果表明部分该还原产物可起到氧化还原介体的作用,加速多种偶氮染料的脱色[8]。然而,在处理过程中直接投加氧化还原介体,不仅造成二次污染,同时也增加了处理成本。因此,本研究考察了海藻酸钙固定化1,5-二氯蒽醌强化偶氮染料酸性红B 厌氧生物脱色的特性,以期为氧化还原介体在偶氮染料废水处理领域的应用提供理论支持。
1 材料与方法
1.1 材料
1.1.1 菌种来源
实验所用菌种为本实验室分离驯化好的耐盐菌株Staphylococcussp.GYZ(GenBank登录号为EF188282)。
1.1.2 培养基
LB培养基:酵母膏(质量浓度为2.5g/L);胰蛋白胨(质量浓度为5.0g/L)和NaCl(质量浓度为2.5g/L)。
无机盐培养基:(NH4)2SO4(质量浓度为1.0 g/L);K2HPO4(质量浓度为1.4g/L);KH2PO4(质量浓度为0.6g/L);MgSO4(质量浓度为0.1g/L);CaCl2(质量浓度为0.1g/L);NaCl、碳源、微量元素,视实验的需要添加,用1 mol/L 的NaOH 或HCl调节pH 值为7.2~7.5,备用。
微量元素组成:FeCl3·6H2O(质量浓度为5mg/L);CuSO4·5H2O(质量浓度为0.05mg/L);H3BO3(质量浓度为1mg/L);MnCl2·4H2O(质量浓度为0.05 mg/L);ZnSO4·7H2O(质量浓度为1mg/L);NiSO4(质量浓度为0.8mg/L)。
1.1.3 主要试剂
1,5-二氯蒽醌(化学纯),购自北京恒业中远化工有限公司;酸性红B(分析纯),购自天津一商化工贸易有限公司染料分公司(1,5-二氯蒽醌和酸性红B的化学结构式见图1)。其他试剂均为分析纯,购自石家庄现代仪器仪表化工有限公司。
实验采用人工配制的酸性红B 染料溶液,配置好的高浓度酸性红B 储备液置于4 ℃冰箱保存备用。
1.1.4 主要仪器

图1 1,5-二氯蒽醌和酸性红B的化学结构式Fig.1 Chemical structure of 1,5-dichloroanthraquinone and acid red B
紫外-可见分光光度计(UV/vis 2600型),购自上海天美科学仪器有限公司;氧化还原组合电极(Leici-501型),购自上海雷磁仪器厂;pH 计(DELTA-320型),购自梅特勒-托利多集团。
1.2 非水溶性氧化还原介体的固定
非水溶性氧化还原介体的固定采用海藻酸钙包埋法,其具体操作步骤详见文献[9]。
1.3 固定化氧化还原介体强化偶氮染料脱色实验
所有脱色实验均在250 mL 锥形瓶中进行,每组实验3个平行样。按体积分数5%对LB培养基/无机盐培养基进行接种,密封后放入35℃恒温培养箱中培养;待其OD660达到0.4左右时,根据实验的需求分别加入不同体积的酸性红B 储备液(用无菌水补足至290mL),从而得到不同的酸性红B 初始浓度;随后加入15mL1,5-二氯蒽醌小球(折合3.6 mmol/L),密封后放入恒温培养箱中进行厌氧脱色实验。分别考察温度、pH 值、NaCl浓度、初始染料浓度和不同碳源对固定化1,5-二氯蒽醌强化酸性红B厌氧脱色的影响,以确定其加速酸性红B 脱色的最佳反应条件。实验过程中,每隔一定时间测定氧化还原电位(ORP)并取样,离心,测定上清液中偶氮染料的含量。
1.4 分析方法
菌液浓度采用紫外-可见分光光度法测定,依据菌液在600nm 处的浊度(OD)值确定菌液的浓度。酸性红B浓度采用紫外-可见分光光度法测定,依据酸性红B在可见光区最大特征峰处(514nm)吸光度值的变化确定其浓度。氧化还原电位使用氧化还原组合电极测定。pH 值使用数显pH 计测定。
2 结果与讨论
2.1 温度对1,5-二氯蒽醌强化酸性红B生物脱色的影响
空白海藻酸钙小球、固定化介体海藻酸钙小球及高温灭活菌体对偶氮染料的吸附性实验结果表明:在24h内,空白海藻酸钙小球、固定化介体海藻酸钙小球及高温灭活菌体对酸性红B 的吸附量都很小(<3%),因而由其所带来的酸性红B 浓度的变化可忽略不计。温度是影响微生物生长和酶活性的重要因素之一,菌株GYZ 的最适生长温度为30 ℃;当温度高于40 ℃时,海藻酸钙固定化介体小球的机械性能将会受到影响,开始出现破裂现象。因此,综合考虑温度对菌株及海藻酸钙固定化介体小球的影响,本实验在初始酸性红B 质量浓度为200mg/L,1,5-二氯蒽醌浓度为3.6 mmol/L,pH值为8.0,NaCl质量分数为0.5%,LB 培养基的反应条件下,分别考察了温度为20,25,30,35,40℃时温度对海藻酸钙固定化1,5-二氯蒽醌加速偶氮染料脱色的影响,反应过程中酸性红B 脱色率的变化如图2所示。

图2 温度对1,5-二氯蒽醌强化酸性红B脱色的影响Fig.2 Effect of temperature on acid red B biodecolorization with 1,5-dichloroanthraquinone
图2表明,在20~35 ℃范围内,随着脱色反应体系温度的升高,酸性红B 的脱色速率不断升高;在35 ℃时酸性红B 的降解速率最快,脱色效果最好;当温度继续升高至40 ℃时,酸性红B 脱色率有所降低,脱色效果较35 ℃时变差;当反应进行到5 h,在20,25,30,35,40 ℃的温度条件下,酸性红B的脱色率分别为20.9%,29.5%,40.7%,87.5%和71.9%。当温度低于35 ℃时,随着温度的升高,细菌的生物量增加速率加快,因而酸性红B 的脱色率随温度增加而增加;但其反应体系的最适温度并非菌株GYZ的最适温度,推测这是由于温度的增加同时促进了染料溶液与海藻酸钙固定化1,5-二氯蒽醌小球的传质性能;然而,高温对菌株GYZ 的活性抑制效应掩蔽了传质效果的增加,使得反应温度为40℃时脱色效率有所下降。因此,本研究确定的最佳反应温度条件为35 ℃。
2.2 pH 值对1,5-二氯蒽醌强化酸性红B 生物脱色的影响
微生物的生命活动、物质代谢与pH 值有密切的关系;同时,染料分子中的发色基团在不同的pH值条件下,其性质也会有所不同。为了探究pH 值对固定化1,5-二氯蒽醌强化酸性红B 生物脱色过程的影响,本实验在初始酸性红B 质量浓度为200mg/L,1,5-二氯蒽醌浓度为3.6mmol/L,温度为35 ℃,NaCl质量分数为0.5%,LB 培养基的反应条件下,分别考察了在初始pH 值为2.0,3.0,4.0,5.0,6.0,7.0,7.5,8.0,9.0,10.0,11.0和12.0时反应(5,30,48h)中酸性红B脱色率的变化趋势,结果如图3所示。
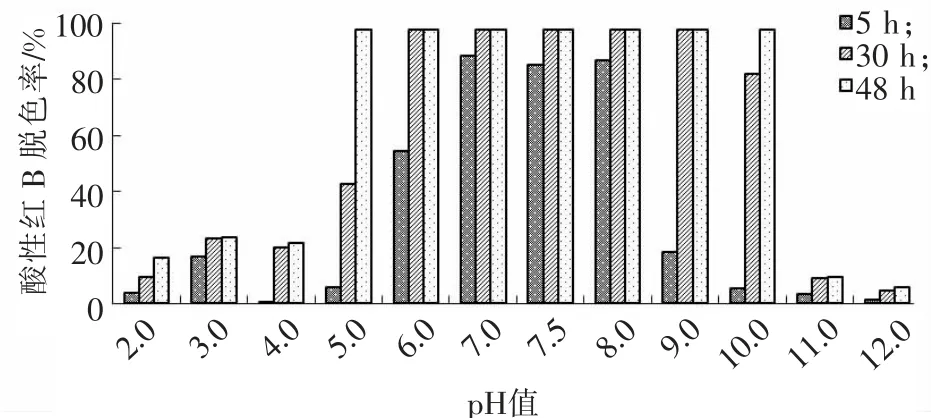
图3 pH 值对1,5-二氯蒽醌强化酸性红B生物脱色的影响Fig.3 Effect of pH on acid red B biodecolorization with 1,5-dichloroanthraquinone
图3表明,当pH 值<5 和pH 值>11 时,脱色反应明显受到抑制;当pH 值在7.0 ~8.0范围内时,脱色率在5h即可达到80%以上。由此说明pH 值较高或较低均会抑制酸性红B的脱色,这主要是由于在强酸或强碱条件下微生物的生命活动受到了抑制,同时反应体系的传质也受到了制约。因此,本研究确定的最佳反应pH 值范围为7.0 ~8.0。
2.3 NaCl浓度对1,5-二氯蒽醌强化酸性红B生物脱色的影响
印染工艺过程中常采用大量的无机盐作为固色剂,导致其生产过程所排出的废水中盐浓度较高;盐对微生物的活性会产生较大影响,盐浓度的增加将破坏生物的代谢功能和降低生物的降解动力[10]。为了考察盐浓度对固定化1,5-二氯蒽醌强化酸性红B脱色效果的影响,本实验在初始酸性红B 质量浓度为200mg/L,1,5-二氯蒽醌浓度为3.6mmol/L,温度为35 ℃,pH 值为8.0,LB 培养基的反应条件下,分别考察了NaCl质量分数为0.5%,2.5%,5.0%和8.0%时反应过程中(5,18,30h)酸性红B脱色率的变化趋势,结果如图4所示。

图4 NaCl质量分数对1,5-二氯蒽醌强化酸性红B生物脱色的影响Fig.4 Effect of NaCl concentration of on acid red B biodecolorization with 1,5-dichloroanthraquinone
图4表明,当反应进行到5h,随着反应体系NaCl质量分数的增高,酸性红B的脱色效率明显依次降低;当反应进行到18h,NaCl质量分数范围为0.5%~5.0%时,酸性红B 可基本完全脱色,而NaCl质量分数为8.0%时,酸性红B的脱色率仍仅为21.1%;当反应进行到30h,与18h具有相同的趋势。由此说明随着NaCl质量分数的增加,微生物的生物活性受到了不同程度的抑制,但当NaCl质量分数较低时,在一定时间内微生物可逐步适应体系的NaCl质量分数,虽然完成脱色的时间增长,但只要能够保证足够的脱色时间,该菌株仍能够对酸性红B完全降解。因此,NaCl质量分数对介体强化酸性红B 脱色过程有一定冲击作用,但在质量分数小于5%时,对染料脱色率的影响较小。
2.4 初始酸性红B浓度对1,5-二氯蒽醌强化酸性红B生物脱色的影响
为了考察初始酸性红B 浓度是否是固定化1,5-二氯蒽醌强化酸性红B 厌氧脱色的限制性因素,本实验在1,5-二氯蒽醌浓度为3.6 mmol/L,温度为35 ℃,pH 值为8.0,NaCl质量分数为0.5%,LB培养基的反应条件下,分别考察了初始酸性红B 质量浓度为200,300,400,500 mg/L 时,反应过程中酸性红B质量浓度的变化趋势,结果如图5所示。
图5表明,随着初始酸性红B 质量浓度由200 mg/L增加至500 mg/L,体系的整体脱色时间延长;在脱色反应初期,浓度越高体系所需的适应时间越长,但体系的脱色速率相近。由此说明在酸性红B质量浓度小于500 mg/L 范围内,染料浓度不会成为1,5-二氯蒽醌强化酸性红B 厌氧脱色的限制性因素[9]。

图5 初始酸性红B质量浓度对1,5-二氯蒽醌强化酸性红B生物脱色的影响Fig.5 Effect of initial concentration of acid red B on its biodecolorization with 1,5-dichloroanthraquinone
2.5 碳源对1,5-二氯蒽醌强化酸性红B生物脱色的影响
为了考察不同碳源对固定化1,5-二氯蒽醌强化酸性红B 脱色的影响,在无机盐培养基中按照质量浓度5g/L的投加量添加碳源,本实验在初始酸性红B质量浓度为200mg/L,1,5-二氯蒽醌浓度为3.6mmol/L,温度为35 ℃,pH 值为8.0,NaCl质量分数为0.5%的反应条件下,分别选择麦芽糖、淀粉、葡萄糖、蔗糖、乳糖、柠檬酸和LB 培养基7种碳源,考察脱色过程中(8,18,30h)酸性红B脱色率的变化趋势,结果如图6所示。

图6 碳源对1,5-二氯蒽醌强化酸性红B生物脱色的影响Fig.6 Effect of carbon source on acid red B biodecolorization with 1,5-dichloroanthraquinone
由图6可知,当反应进行到8h和18h,仅有以LB培养基为碳源的体系脱色率较高,分别达到49.2%和98.0%,其余体系的脱色率均低于40%;当反应进行到30h,除以葡萄糖为碳源的体系脱色率为92.1%,其余体系的脱色率均达到98%以上。以上结果说明在1,5-二氯蒽醌存在的情况下菌株GYZ可利用的碳源范围仍较广,所选取的7种碳源均可被利用,其中,以LB 培养基作为碳源时,脱色效率最高,因此,实验选用LB培养基作为碳源。
2.6 1,5-二氯蒽醌强化酸性红B 生物脱色过程中ORP的变化
在初始酸性红B质量浓度为200mg/L,1,5-二氯蒽醌浓度为3.6mmol/L,温度为35 ℃,pH 值为8.0,NaCl质量分数为0.5%,LB 培养基的条件下,考察固定化1,5-二氯蒽醌强化酸性红B 脱色过程中,酸性红B脱色率与ORP的变化的关系,结果如图7所示。
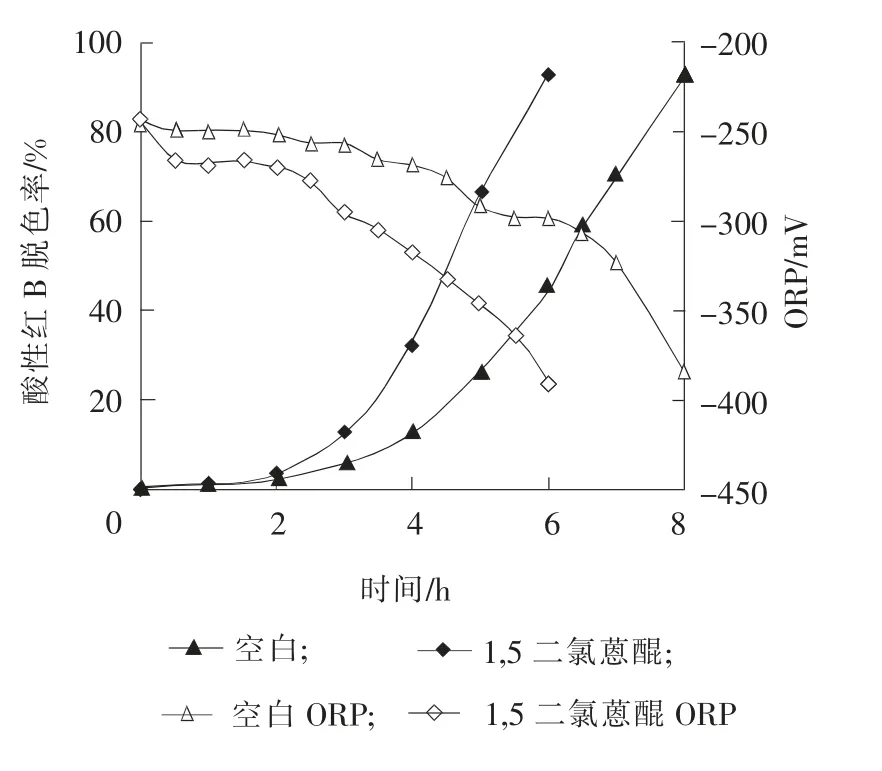
图7 1,5-二氯蒽醌强化酸性红B脱色过程中的ORP变化Fig.7 ORP change during acid red B decolorization process with 1,5-dichloroanthraquinone
由图7可知,投加空白海藻酸钙小球的体系中,酸性红B的脱色率明显低于投加了固定化1,5-二氯蒽醌海藻酸钙小球的反应体系,该结果证明了介体的加入可显著提高酸性红B 的脱色效果;在空白和投加固定化1,5-二氯蒽醌的体系中,随着酸性红B的脱色率的不断增加,其ORP 均不断下降;在脱色反应的过程中,加入固定化1,5-二氯蒽醌的反应体系的ORP 较空白体系的低[11]。由以上结果推测,1,5-二氯蒽醌介体的投加能起到加速作用,并且可能是通过加速ORP的降低来达到的。
3 结 论
在不考虑各因子间交互作用的条件下,固定化1,5-二氯蒽醌强化酸性红B 脱色的最佳温度为35℃;最佳pH 值范围为7.0~8.0;NaCl浓度对介体强化酸性红B 脱色过程有一定冲击作用,但质量分数小于5%时,对染料脱色率的影响较小;初始染料质量浓度小于500 mg/L 范围内,染料浓度不会成为1,5-二氯蒽醌强化酸性红B 厌氧脱色的限制性因素;以LB培养基作为碳源时,脱色效率最高。在脱色过程中,随着脱色率的增加,体系ORP 不断下降,介体可能是通过加速ORP的降低来起到对脱色过程的加速作用。
/References:
[1] 李克斌,赵 锋,魏 红,等.磷钨酸均相光催化还原降解水中偶氮染料酸性大红3R[J].高等学校化学学报,2011,32(8):1 812-1 818.LI Kebin,ZHAO Feng,WEI Hong,et al.Photocatalytic reductive degradation of acid red 3Rby posphotungstic acid[J].Chemical Journal of Chinese Universities,2011,32(8):1 812-1 818.
[2] 陈 晔,陈 刚,陈 亮,等.偶氮染料分子结构对其生物脱色影响的研究进展[J].环境科学与技术,2011,34(8):65-69.CHEN Ye,CHEN Gang,CHEN Liang,et al.Review of studies on effects of molecular structure on azo dye microbial decolorization[J].Environmental Science and Technology,2011,34(8):65-69.
[3] 郭建博,周集体,王 栋,等.耐盐菌群对高含盐染料模拟废水的脱色实验研究[J].环境科学,2005,12(6):31-36.GUO Jianbo,ZHOU Jiti,WANG Dong,et al.Decolorization of dye wastewater with high salt concentration by acclimatized salt-tolerant cultures [J].Environmental Science,2005,12(6):31-36.
[4] 王瑜瑜,张春晓,郭建博,等.耐盐基因工程菌降解偶氮染料特性研究[J].河北科技大学学报,2010,31(5):483-486.WANG Yuyu,ZHANG Chunxiao,GUO Jianbo,et al.Characteristic study on azo dyes degradation by salt-tolerant genetically engineered bacteria[J].Journal of Hebei University of Science and Technology,2010,31(5):483-486.
[5] 康 丽,郭建博,李洪奎,等.氧化还原介体催化强化偶氮染料脱色研究进展[J].河北工业科技,2010,27(6):447-450.KANG Li,GUO Jianbo,LI Hongkui,et al.Research advance of catalytic effect of redox mediator in azo dye decolorization process[J].Hebei Journal of Industrial Science and Technology,2010,27(6):447-450.
[6] 苏妍彦,王 竞,周集体,等.蒽醌染料中间体催化强化偶氮染料生物脱色[J].环境科学,2008,29(7):1 986-1 991.SU Yanyan,WANG Jing,ZHOU Jiti,et al.Enhanced biodecolourization of azo dyes by the catalysis of anthraquinone dyes intermediators[J].Environmental Science,2008,29(7):1 986-1 991.
[7] 崔姗姗,徐宏勇,周思辰,等.氧化还原介体对偶氮染料厌氧脱色的影响[J].哈尔滨理工大学学报,2008,13(2):103-106.CUI Shanshan,XU Hongyong,ZHOU Sichen,et al.Effects of different redox mediators on the anaerobic reduction of azo dyes[J].Journal of Harbin University Science &Technology,2008,13(2):103-106.
[8] 张 隆,王 竞,周集体,等.酸性偶氮染料还原产物强化偶氮染料生物脱色[J].中国环境科学,2008,28(3):237-241.ZHANG Long,WANG Jing,ZHOU Jiti,et al.Enhanced biological decolourization of azo dyes by the catalysis of reduced acid azo dyes[J].China Environmental Science,2008,28(3):237-241.
[9] 康 丽,郭建博,廉 静,等.介体厌氧催化活性艳红K-2BP脱色及构效特性研究[J].环境科学,2011,32(4):1 060-1 065.KANG Li,GUO Jianbo,LIAN Jing,et al.Catalyst effect and the structure-activity characteristics of redox mediators on the reactive brilliant red K-2BP decolorization[J].Environmental Science,2011,32(4):1 060-1 065.
[10] 雷 弢,仝攀瑞,陈方方,等.含盐条件下偶氮染料兼厌氧性生物的降解性能[J].西安工程大学学报,2011,25(1):103-106.LEI Tao,TONG Panrui,CHEN Fangfang,et al.Facultative anaerobic biodegradation performance of azo dyestuff under salt-containing condition[J].Journal of Xi′an Polytechnic University,2011,25(1):103-106.
[11] 廉 静,许志芳,赵丽君,等.固定化氧化还原介体加速亚硝酸盐生物反硝化作用[J].环境工程学报,2012,6(6):1 805-1 809.LIAN Jing,XU Zhifang,ZHAO Lijun,et al.Biological catalyzing denitrification of nitrite by immobilized redox mediator[J].Chinese Journal of Environmental Engineering,2012,6(6):1 805-1 809.
