细胞自噬与结肠癌Lovo细胞迁移和侵袭的相关性研究
2013-11-27王天宝石汉平韩方海董文广
王天宝 石汉平 韩方海 董文广
结直肠癌(colorectal cancer,CRC)是常见的恶性肿瘤之一,其发病率约每年增加4%。CRC治疗失败的主要原因是深层浸润、淋巴和远处转移等,约30%~60%患者初次就诊时就存在局部或远处转移灶,而根治性切除术后5年内,约50%患者发生肝转移,即使完整切除复发灶,仍约有60% ~70%患者再次复发转移[1]。CRC浸润转移是一个复杂的生物学现象,包括:细胞黏附性能改变、细胞基质降解、肿瘤细胞局部浸润、肿瘤细胞循环内播散、免疫逃逸、血管内肿瘤细胞栓塞形成及在新的微环境中重新生长等。在此过程中,肿瘤细胞需要首先克服失巢凋亡、机体免疫及各种治疗杀伤等致命威胁才能在新的微环境中形成转移灶[2]。细胞自噬是进化上高度保守、受自噬相关基因和复杂信号通路调控的一种自我消化过程[3]。研究发现自噬可以协助乳腺癌细胞克服失巢凋亡[4]。在Earle平衡盐溶液(Earlebalancedsaltsolution,EBSS)中培养的营养缺乏情况下,结直肠癌细胞自噬体明显增加,应用自噬抑制剂3-甲基嘌呤(3-methyladenine,3-MA)则显著促进细胞凋亡,但在肿瘤邻近组织上皮细胞则未见此现象[5]。脂联素可增加结肠癌细胞微管相关蛋白轻链3(microtubuleassociatedproteinlightchain 3,LC3)浓度,抑制自噬相关基因 mTOR及 Akt表达,从而促进自噬,确保细胞在营养缺乏条件下生存[6]。总之,细胞自噬可能与结直肠癌发生、增殖和凋亡有关。然而肿瘤细胞在浸润转移途中必须克服各种致命威胁因素,在此过程中,细胞自噬可能也扮演重要角色。本研究发现结肠癌细胞自噬增强促进细胞迁移和浸润,可能是恶性肿瘤局部和远处转移的机制之一。
材料与方法
一、材料
胎牛血清、DMEM-高糖培养基、青链霉素、GAPDH内参抗体和磷酸钾缓冲液(phosphate bufferedsaline,PBS)(hyclone),3-MA,Lovo 结肠癌细胞株(上海市肿瘤研究所),RNA提取试剂盒、逆转录试剂盒及Westernblot试剂盒(武汉博士德公司),pSELECT-GFP-LC3及定量 PCR用的 SYBR GreenqPCRSuperMix(Invitrogen),LipofectamineTM2000、Transwell细胞培养板及 Matrigel胶(BD),ABI PRISM7500SequenceDetectionSystem,日立-7650透视电子显微镜,倒置光学显微镜(日本OLYMPUS公司),细胞恒温培养箱(美国 thermoscientific公司),倒置荧光显微镜(德国Leica公司)。
二、方法
1.细胞复苏与培养:按常规复苏Lovo细胞。将水浴锅预热至37℃。75%酒精擦拭,紫外线照射超净工作台30min。取出细胞培养瓶,打开瓶盖,吸掉旧培养液。用PBS洗涤细胞1~2次。加入Trypsin-EDTA溶液2ml/75cm2,轻洗细胞皿底部。吸掉Trypsin-EDTA溶液,放入37℃培养箱2~3min,轻拍培养瓶壁使大部分细胞脱落,于倒置显微镜下观察,当细胞将要分离而呈现圆粒状时,加入适量含血清的新鲜培养基终止Trypsin作用。以吸管上下吸放数次以打散细胞团块,混和均匀后,MEM培养基补足样本量3瓶传代细胞,依稀释比例转移至新的培养瓶中。放入 CO2培养箱(5%CO2,饱和湿度,37℃)。
2.细胞转染pSELECT-GFP-LC3质粒:转染前一天对细胞进行传代,使其汇合度为60% ~70%,质粒的浓度为1.6~2.0μg/ml。6孔培养板,每孔表面积10cm2,培养基用量为2000μl。吸取质粒母液(0.5 μg/μl)3.2 μl溶解到1000 μlOpti-MEM 培养基为 A液;取10μlLipofectamineTM2000溶解于1000μlOpti-MEM培养基为B液;B液混合5min后,将A液和B液混合,静止20min后加到细胞培养板中。转染4h后换为含10%FBS的MEM培养基。
3.实验分组及激光共聚焦显微镜观察:自噬自强组:细胞转染pSELECT-GFP-LC3后,用PBS洗三次,单独用 EBSS培养 3h。自噬抑制组:250μmol/L3-MA处理Lovo细胞3h。正常Lovo细胞自噬组:正常培养3h。于六孔板中,将Lovo细胞接种于经多聚赖氨酸预处理的盖玻片,4h后收获细胞,4%多聚甲醛固定细胞15min,PBS洗两次,加入 0.25%Triton-X100,冰上放置 5min,PBS 洗2次,然后加入1%牛血清白蛋白处理30min,加入1%BSA稀释的兔抗人LC3(1∶100),4℃孵育过夜。次日细胞用PBS洗3次后,加入FITC标记的羊抗兔IgG(1%BSA以1∶20的比例稀释),室温下避光孵育30min,PBS再次洗涤细胞后,用10μg/mlPI和0.1%RNaseA室温下细胞核DNA染色30min,激光共聚焦显微镜下观察拍片,绿色荧光颗粒数代表细胞内自噬溶酶体数量,提示自噬状态。
4.Q-PCR检测:参照RNA提取试剂盒操作手册提取总RNA,检测其完整性。在RNasefree的PCR管中,将提取的总1.0μgRNA加入双蒸水中,总体积12μl。将上述溶液吹打均匀,将温度设置为65℃保温5min,使RNA变性。随后立即冰上致冷,以防止RNA复性。在该PCR管中再加入下列试剂:Oligo(dT)Randomprimer0.5 μl,10 μmol/L dNTP2.0 μl,RNaseinhibitor0.5 μl,5 × buffer 4.0 μl,M-MLV0.5 μl。将上述 20 μl反应溶液30℃保温10min。42℃保温60min。80℃保温10min。内参片段:18SrRNA-112bp(F:CCTGGATA CCGCAGCTAGGA,R:GCGGCGCAATACGAATGCCCC)。目的片段:Beclin1-151bp(F:AAGGCGAGACACG TTTTTG,R:TTCGTCAGCATGAACTTGAG)。反应体系:cDNA5.0 μl,上游引物 0.5 μl,下游引物0.5 μl,2 × SYBRGreenqPCRSuperMix10.0 μl,dH2O4.0 μl。经 95 ℃ 2min,50 ℃ 2min,95 ℃15s,60℃ 32s循环后读板,40cycles;融解曲线分析温度60~95℃。每个样重复3次。
5.电镜检测:细胞离心为细胞团,在4℃冰箱内进行以下实验:2.5%戊二醛磷酸缓冲液固定2h。用0.1mol/L磷酸漂洗液漂洗15min,进行三次。1%锇酸固定液固定,2~3h。用0.1mol/L磷酸漂洗液漂洗15min,进行3次。脱水:50%乙醇,15~20min;70%乙醇,15~20min;90%乙醇,15~20min;90%乙醇90%丙酮(1∶1),15 ~20min;90%丙酮,15 ~20min。100%丙酮,室温,15 ~20min,进行3次。包埋:纯丙酮 +包埋液(2∶1),室温3~4h;纯丙酮+包埋液(1∶2),室温,过夜;纯包埋液,37℃,2~3h。固化:37℃烘箱,过夜;45℃烘箱,12h;60℃烘箱,24h。超薄切片机切片,厚度50~60nm。3%醋酸铀-枸橼酸铅双染色。透射电镜观察拍片。
6.Transwell检测不同自噬状态对细胞迁移与侵袭能力的影响:计数1×105个正常Lovo细胞、自噬增强组及自噬抑制组细胞,用100μl无血清1640培养基重悬,加入Transwell上室,在下室加入600μl完全培养基。37℃,5%CO2孵育,在24h及48h分别取出小室,用棉签擦去上室的细胞,4%多聚甲醛固定15min,PBS洗涤一次,结晶紫染色10min,PBS洗涤一次,检测细胞是否穿过小孔,如有穿过终止其他实验组,并拍照计数,评价对迁移能力的影响。Matrigel模仿细胞外基质,4℃溶解过夜,用预冷的无血清培养基以1∶3的体积比稀释Matrigel,取40μl加入预冷的Transwell小室中,37℃孵育2h使Matrigel凝固。吸走小室中多余的液体,并在上室、下室分别加入100μl、600μl无血清培养基,37℃过夜。采用上述迁移检测方法评价对侵袭能力的影响。
三、统计学分析方法
采用SPSS10.5统计学软件进行数据分析,计量资料采用t检验,以P<0.05为差异有统计学意义。
结 果
1.激光共聚焦显微镜观察:绿色荧光颗粒以自噬增强组最多,其次为正常细胞组,而3-MA自噬抑制组最少(图1)。
2.Q-PCR检测:Beclin1mRNA表达量自噬增强组为(1.23 ±0.12)个,正常细胞组为(1 ±0.13)个,3-MA 自噬抑制组为(0.98±0.1)个。
3.透视电镜:自噬增强组见大量的自噬溶酶体,明显多于正常细胞组和3-MA自噬抑制组(图2)。
4.Transwell实验:迁移实验细胞计数自噬增强组为(138.0 ±16.7)个,高于正常细胞组(90.7 ±12.9)个(P=0.026)和自噬抑制组(92.7 ±26.7)个(P=0.030),正常细胞组和自噬抑制组之间差异无统计学意义(P=0.905)。侵袭实验细胞计数自噬增强组为(147.0±13.0)个,高于正常细胞组(99.0 ±20.5)个(P=0.028)和自噬抑制组(95.7 ±25.6)个(P=0.021),正常细胞组和自噬抑制组之间差异无统计学意义(P=0.848)。
讨 论
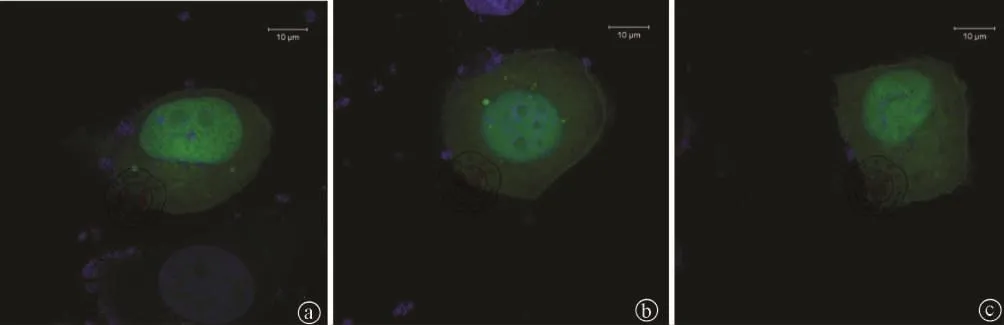
图1 激光共聚焦显微镜镜下观察自噬增强组、正常细胞组和自噬抑制组Lovo细胞内荧光颗粒图像
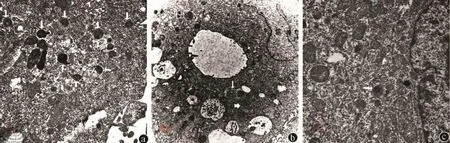
图2 透视电镜下观察自噬增强组细胞、正常细胞组和3-MA自噬抑制组Lovo细胞的自噬溶酶体图像
细胞自噬本质是细胞内的一些双层膜结构包裹部分自噬底物,如老化或损伤的细胞器、错误折叠的蛋白质等胞质成分形成自噬体,随后转运至溶酶体并与之融合形成自噬溶酶体,溶酶体内蛋白水解酶消化降解底物后,生成氨基酸或游离脂肪酸,从而使营养物质循环利用[7]。多数研究证实,细胞自噬在肿瘤的发生发展中具有双重作用,既可以作为抑制肿瘤发生的一种机制,也是在代谢应激等不利生存环境下的一种肿瘤保护机制。本研究证实营养缺乏可诱导结肠癌细胞自噬溶酶体和LC3-GFP荧光颗粒数量明显增加,证实自噬水平升高。自噬相关蛋白Beclin1的表达自噬增强组也高于正常细胞组和自噬抑制剂组。在正常结直肠粘膜腺体可见细胞自噬激活,而且多见于未分化的祖细胞群,据此推测细胞自噬参与结直肠癌的发生[8],LC3高表达与结直肠癌转移及预后较差有关[9]。结肠癌细胞株HT-29自噬相关死亡的细胞内见大量自噬体、LC3及酸性囊泡结构[10]。在长时间饥饿条件下,结直肠癌细胞株HCT116细胞内野生型P53抑制LC3和自噬流;但在P53缺失情况下,LC3则会大量积聚,过度自噬导致细胞死亡[11]。采用RNAi技术沉默自噬蛋白Atg7可明显抑制5-氟尿嘧啶耐药结肠癌细胞株细胞自噬,提高5-氟尿嘧啶诱导的细胞凋亡水平[12]。自噬抑制剂二磷酸氯喹和5-氟尿嘧啶联合应用明显抑制结肠癌BALB/c裸小鼠移植瘤生长和细胞自噬水平,提示抑制自噬可提高化疗效果[13]。因此,细胞自噬在肿瘤的发生发展中可能具有双重作用,既是抑制肿瘤发生的一种机制,也是在代谢应激等不利生存环境下的一种肿瘤保护机制。
本研究证实自噬增强促进结肠癌细胞的迁移和侵袭。在低氧或营养缺乏条件下,肿瘤细胞会通过激活血管内皮生长因子等基因的表达,促进肿瘤组织内部血管形成,从而增加组织内部的氧供。同时还会通过诸如激活CXCR4等基因表达以增强肿瘤细胞的侵袭和运动能力,刺激肿瘤细胞转移[14]。SDF-1/CXCR4结合后可促进G蛋白三聚体分离,形成GβGγ和Gαi,二者均可以激活下游信号通道的重要节点分子PI3K[15]。PI3K是一个复杂的大家族,根据其结构可分为Ⅰ型,Ⅱ型和Ⅲ型,其中PI3KⅢ是细胞自噬激活重要的启动因子[6-7]。结合相关文献报道,推测SDF-1/CXCR4可能通过CXCR4-PI3KⅢ信号传导通路,激发细胞自噬。因存在CXCR4-PI3KⅢ细胞自噬信号传导通路,进而赋予了肿瘤细胞克服其浸润转移途中所遇到的各种致命威胁的能力,导致肿瘤细胞局部浸润和远处转移。
总之,结肠癌细胞自噬增强促进肿瘤细胞迁移和浸润,可能是局部浸润和远处转移的机制之一,通过改变细胞自噬状态有望成为治疗恶性肿瘤的策略之一。
[1] Parsons HM,Tuttle TM,Kuntz KM,et al.Association between lymph node evaluation for colon cancer and node positivity over the past 20 years.JAMA,2011,306(10):1089-1097.
[2] Rice J.Metastasis:The rude awakening.Nature,2012,485(7400):55-57.
[3] Behrends C,Sowa ME,Gygi SP,et al.Network organization of the human autophagy system.Nature,2010,466(7302):68-76.
[4] Buchser WJ,Laskow TC,Pavlik PJ,et al.Cell-mediated autophagy promotes cancer cell survival.Cancer Res,2012,72(12):2970-2979.
[5] Yoshioka A,Miyata H,Doki Y,et al.LC3,an autophagosome marker,is highly expressed in gastrointestinal cancers.Int J Oncol,2008,33(3):461-468.
[6] Habeeb BS,Kitayama J,Nagawa H.Adiponectin supports cell survival in glucose deprivation through enhancement of autophagic response in colorectal cancer cells.Cancer Sci,2011,102(5):999-1006.
[7] Sancak Y,Bar-Peled L,Zoncu R,et al.Ragulator-Rag complex targets mTORC1 to the lysosomal surface and is necessary for its activation by amino acids.Cell,2010,141(2):290-303.
[8] Groulx JF,Khalfaoui T,Benoit YD,et al.Autophagy is active in normal colon mucosa.Autophagy,2012,8(6):893-902.
[9] Giatromanolaki A,Koukourakis MI,Harris AL,et al.Prognostic relevance of light chain 3(LC3A)autophagy patterns in colorectal adenocarcinomas.J Clin Pathol,2010,63(10):867-872.
[10] Chen F,Wang CC,Kim E,et al.Hyperthermia in combination with oxidative stress induces autophagic cell death in HT-29 colon cancer cells.Cell Biol Int,2008,32(7):715-723.
[11] Scherz-Shouval R,Weidberg H,Gonen C,et al.p53-dependent regulation of autophagy protein LC3 supports cancer cell survival underprolongedstarvation.ProcNatlAcadSciUSA,2010,107(43):18511-1856.
[12] LiJ,HouN,FariedA,etal.Inhibitionofautophagyaugments5-fluorouracilchemotherapyinhumancoloncancerinvitroandin vivomodel.EurJCancer,2010,46(10):1900-1909.
[13] SasakiK,TsunoNH,SunamiE,etal.Resistanceofcoloncancer to5-fluorouracilmay be overcome by combination with chloroquine,aninvivostudy.AnticancerDrugs,2012,23(7):675-782.
[14] 王天宝,石汉平,韩方海,等.SDF-1/CXCR4系统和结直肠癌转移的相关性研究进展.中华结直肠疾病电子杂志,2012,1(1):31-33.
[15] TeicherBA,FrickerSP.CXCL12(SDF-1)/CXCR4pathwayin cancer.ClinCancerRes,2010,16(11):2927-2931.
王天宝,石汉平,韩方海,等.细胞自噬与结肠癌Lovo细胞迁移和侵袭的相关性研究[J/CD].中华结直肠疾病电子杂志,2013,2(2):63-67.
