8种傣药提取物体外抑制α-糖苷酶活性的研究
2013-11-26齐艳菲王兴云刘丽娜王德彬杨光忠
胡 鑫,齐艳菲,王兴云,盘 妮,刘丽娜,王 丽,王德彬,徐 婧,杨光忠
(中南民族大学 药学院,武汉430074)
糖尿病是一种与遗传因素和多种环境因素相关的慢性全身性疾病,由于体内胰岛素的绝对或相对分泌不足而引起的糖、脂肪、蛋白质的代谢紊乱[1],常用胰岛素注射(I型)和口服降糖药物(II型)治疗.对II型糖尿病的病人,在采用控制饮食的方法不能有效控制血糖时,需要口服降糖药物[2],其中α-糖苷酶抑制剂如阿卡波糖已证明其单独用药或与其他降糖药物合用时能明显降低血糖水平,并以降低餐后血糖为主[2,3].但其引起的不良反应较多见,如胃肠道反应(约58%),典型表现包括胃胀,腹胀,腹泻,胃肠痉挛性疼痛,顽固便秘等,而具有降糖作用的民族药物如傣药等效果显著,毒副作用轻微,并能同时治疗并发症.本文研究了对我国8种傣药植物中不同部分的不同提取物对α-糖苷酶的抑制活性,旨在寻找其中的降糖有效成分,为深入开发以及合理利用降糖傣药提供科学依据.
1 试剂与仪器
1.1 植物材料
8种傣药材料如表1,由云南西双版纳民族医药研究所提供和鉴定.

表1 8种傣药植物的拉丁文名Tab.1 Latin name of eight Dai Nationality Medicine tested plant
1.2 仪器与试剂
酶标仪(美国 Thermo Electron公司),PH S-25型酸度计(上海伟业仪器厂),旋转蒸发器RE-52(上海亚荣生化仪器厂),WH-3微型漩涡混合仪(上海沪西分析厂有限公司),电子天平(梅特勒-托利多仪器上海有限公司),α-葡萄糖苷酶(Sigma),4-硝基苯-α-D-吡喃葡萄糖苷(4-N-trophenyl-α-D-glucopyranoside,pNPG,Sigma),阿卡波糖(Sigma),DMSO(国药集团),所用溶剂均为分析纯(上海试一化学试剂有限公司).
2 实验方法
2.1 8种傣药提取物的制备
取植物药材(50g)粉碎后,室温下用甲醇浸泡3次,甲醇用量每次约1L,每次浸泡72h,合并3次甲醇提取液.真空抽滤(3层滤纸)得滤液,减压旋转蒸发得甲醇浸膏.将甲醇浸膏溶解在甲醇和水(体积比9︰1)的混合溶剂中,用石油醚萃取脱脂,石油醚处于上层,萃取12次,萃取液与母液体积比约为1︰1,减压浓缩回收石油醚循环使用,得石油醚提取物(P)少量,然后减压浓缩甲醇层溶液成浸膏.用超纯水将甲醇全部浸膏溶解,用乙酸乙酯萃取,萃取液与母液体积比为1︰1,萃取12次,减压浓缩成浸膏;乙酸乙酯萃取完后用正丁醇继续萃取,体积比为1︰1,萃取6次,减压浓缩成浸膏.这样每种植物材料就获得了石油醚(P),乙酸乙酯(E),正丁醇(NBA)和水(W)4个提取物.将各提取物用DMSO配制成1mg/mL溶液,即得样品液.
2.2 酶活性测定方法和酶活性抑制率的计算
2.2.1 测定样品溶液的配制
分别配制0.2mol/L Na2HPO4溶液(A)250mL,0.2mol/L KH2PO4溶液(B)250mL,将 A 液和 B液按49︰5l的体积比例配成0.2 mol/L磷酸盐缓冲液(pH6.8).用pH6.8的磷酸盐缓冲液将标准底物pNPG 配成3mM,冰箱保存.300U α-葡萄糖苷酶用1000 mL浓度为0.05 mol/L的PB缓冲液配制成3 U/mL的保存液,并分装,置于低温下冻存(-20℃),使用时稀释成0.3 U/mL.
2.2.2 酶活性测定方法
[4],将待测样品与α-葡萄糖苷酶溶液(50μL,0.3 U/mL),0.2mol/L 磷酸二氢钾缓冲液(pH6.8,50μL)充分混合,37℃预先孵育 15min后,加入 3mM pNPG 溶液 100 μL,37℃ 反应 10min后加入0.1mol/L Na2CO3溶液(750μL)终止反应,在波长405nm处测定在酶作用下释放出的对硝基酚(PNP)光吸收值.酶活力单位定义为:在 37℃,pH6.8条件下,1min内水解 pNPG 释放 1μmol PNP所需的酶量.抑制剂活力单位定义:在相同条件下降低1个酶活力单位所需的抑制剂量.
2.2.3 样品酶活性抑制率的测定
参考文献[5],96孔板每孔依次加入50μL磷酸缓冲液(0.2mol/L,pH6.8),50 μL α-葡萄糖苷酶溶液(0.3U/mL),DMSO 或 10 μL 样品溶液(10个浓度).37℃培养箱反应15min后,每孔加入100 μL pNPG(3mM)溶液,37℃培养箱反应10min后终止反应,酶标仪 405nm波长测 A值(吸光度值,Absorbance).实验设置空白(Blank,10 μL 不含样品DMSO),背景孔(Backgroud,50 μL 缓冲液代替酶液),每个样品孔(sample)设3个复孔.各傣药提取物样品均设平行空白对照.
根据抑制百分率的定义与本实验的实际方法,样品提取物对α-葡萄糖苷酶活性的抑制率按下式计算:Inhibitory rate/%=

2.2.4 样品浓度对酶活性抑制率的影响
将1-1样品液与1 mg/mL阿卡波糖分别稀释至原浓度的 0.02 倍、0.04 倍、0.06 倍、0.08 倍,依次类推直至 0.2倍,测定其对 α-葡萄糖苷酶的抑制率.
3 结果
3.1 8种傣药提取物对α-葡萄糖苷酶的抑制活性
8种傣药提取物对α-葡萄糖苷酶的抑制活性如表2所示.由表2可知,8种傣药中大部分提取物对α-葡萄糖苷酶有较好的抑制活性,32个提取物中有16个提取物的IC50值低于对照阿卡波糖.其中野花椒的石油醚提取部位(IC50=40.71 μg/mL),黑皮跌打藤茎的乙酸乙酯和正丁醇提取部位(IC50分别为26.33 μg/mL、17.74 μg/mL)小于 50 μg/mL.
8种植物中白花丹根和黑皮跌打藤茎的4个提取部位对α-葡萄糖苷酶均有较好的抑制活性.其中黑皮跌打藤茎提取物中乙酸乙酯、正丁醇和水提取物的 IC50分别为26.33,17.74,54.58 μg/mL(石油醚部 IC50为183.33 μg/mL),显著高于阿卡波糖(P<0.01)和其他7种傣药(P <0.05).此外,白花丹根乙酸乙酯(E)、正丁醇(NBA)部较阿卡波糖抑制活性较强(P<0.01);山鸡椒、野花椒、登台树去皮茎木、野山椒果实仅石油醚(P)部较阿卡波糖抑制活性较强(P<0.01).因黑皮跌打藤茎正丁醇部抑制活性最强,因此选取该部分进行后续研究.

表2 8种植物不同提取物对α-葡萄糖苷酶的抑制活性IC50Tab.2 α-Glucosidase inhibitory activities IC50of the extracts from eight kinds of plants
3.2 提取物浓度对α-葡萄糖苷酶抑制活性的影响
6个抑制活性较好的样品提取物浓度对α-葡萄糖苷酶抑制率的影响结果见图1.由图1可见,各提取物对α-葡萄糖苷酶抑制活性呈剂量依赖性,当提取物 1-1,3-1,5-2,6-2,6-3,6-4 浓度分别低于 80,100,80,120,40,120 μg/mL 时 α-葡萄糖苷酶抑制率随样品浓度的增加而显著增加,呈明显的线性关系.当抑制率达到80%后,样品浓度增加对抑制率的影响不大.其他26个提取物物浓度对α-葡萄糖苷酶抑制率的影响呈现如表2所示的相似效应.特别是黑皮跌打藤茎正丁醇提取部位(点线1)活性最高,在样品浓度为50 μg/mL时,对α-葡萄糖苷酶的抑制活性约达85%.
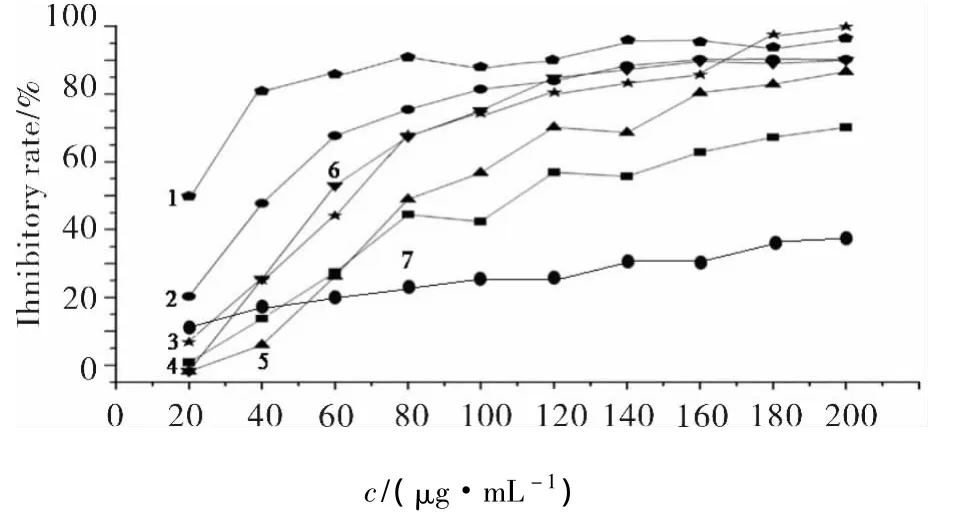
图1 6种提取物及阿卡波糖浓度对α-葡萄糖苷酶活性的影响Fig.1 Effects of the concentration of six extracts and acarbose on α-glucosidase activity
4 讨论
α-葡萄糖苷酶抑制剂竞争性抑制位于小肠的各种α-葡萄糖苷酶,使淀粉类分解为葡萄糖的速度减慢,从而减缓肠道内葡萄糖的吸收,降低餐后高血糖.目前临床上应用的α-葡萄糖苷酶抑制剂主要为西药如阿卡波糖等,价格较贵且副作用常见.目前对于民族药物抗糖尿病研究较少,其对α-糖苷酶抑制活性研究亦不多见.本文对8种傣药提取物的α-葡萄糖苷酶抑制活性进行研究,发现提取物均有一定的α-葡萄糖苷酶抑制活性,且大部分提取物的抑制活性高于阿卡波糖.其中黑皮跌打藤茎4种溶剂提取物均具有α-葡萄糖苷酶抑制活性,正丁醇提取物活性最好(IC50=17.74 μg/mL),优于阿卡波糖(P<0.01).黑皮跌打藤为番荔枝科植物,主要用于接骨续筋,除风,活血止痛[6],含有生物碱[7-9],黄酮[10,11]等结构类型.野花椒为芸香科植物,主要含有生物碱、酰胺、木脂素、香豆素、挥发油和脂肪酸等化学成分[6].多羟基生物碱类化合物是一类具有显著抑制葡萄糖苷酶活性的化合物[12].黄酮,香豆素均能显著抑制 α-葡萄糖苷酶抑制活性[13,14].8 种傣药特别是黑皮跌打藤茎中的单体活性成分的α-葡萄糖苷酶抑制活性,及其在胰岛素抵抗细胞模型及动物模型中药理作用和具体机制,有待进一步研究.
参考文献
[1]车今智,傅德贤,欧阳藩.植物药治疗糖尿病的研究概况[J].中草药,2004,35(1):112-113.
[2]刘志峰,李春梅,李 敏.α-糖苷酶抑制剂阿卡波糖的临床药理作用[J].中国药理学通报,2004,20(9):965-968.
[3]范丽凤,陆菊明.糖尿病口服降压糖药物治疗新进展[J].继续医学教育,2005,19(1):8-10.
[4]Kim J S,Kwon Y S,Chun W J,et al.Rhus verniciflua Stokes flavonoid extracts have anti-oxidant,anti-microbial and a-glucosidase inhibitory effect[J].Food Chem,2010,120(2):539-543.
[5]沈忠明,李 英,姜 宏.降糖中药对 α-葡萄糖苷酶抑制作用的研究[J].中国生化药物杂志,2000,21(2):69-70.
[6]林艳芳,依 专,赵应红.中国傣医药彩色图谱[M].昆明:云南民族出版社,2003.
[7]Deng Y,Chen J,Wu F E.Two new aporphine alkaloids from Fissistigma bracteolatum[J].Chin Chem Lett,2002,13(9):862-864.
[8]郑宗平,梁敬钰,胡立宏.瓜馥木活性成分研究[J].中国天然药物,2005,3(3):151-154.
[9]傅春燕,尹文清,周中流.瓜馥木阿卜菲类生物碱的研究[J].中药材,2007,30(4):409-412.
[10]商立坚,赵碧涛,郝小江.广西瓜馥木的新黄酮成分[J].云南植物研究,1994,16(2):191-195.
[11]傅春燕,尹文清,周中流.瓜馥木化学成分研究[J].广西师范大学学报:自然科学版,2007,25(3):73-74.
[12]Heightman T D,Vasella A T.Recent insights in inhibition,structure,and mechanism of configuration-retaining glycosidases.[J].Angew Chem Int Ed,1999,38(6):750-770.
[13]沈 琼.以香豆素为母体进行结构修饰的生物活性化合物研究[D].广州:中山大学,2005.
[14]周晓惠,吕敬慈,雍克岚.广西龙血竭游离黄铜类化合物的分离鉴定及活性研究[J].上海大学学报:自然科学版,2007,13(2):212-215.
