rhKD/APPvar对实验性慢性肝损伤肝组织纤维化影响的研究
2013-11-24孟威宏王虹蛟颜炜群任立群
孟威宏,王虹蛟,王 强*,颜炜群,任立群
(1.沈阳军区总医院,辽宁 沈阳110015;2.长春解放军第461医院;3.吉林大学再生医学科学研究所)
关于肝纤维化机制及防治研究,目前是国内外生物学、医学研究的热点之一[1-6]。本论文利用实验鼠的四氯化碳(CCl4)慢性肝损伤模型,同时利用胶原纤维染色检测方法观察重组人淀粉样蛋白前体中的Kunitz型蛋白酶抑制剂结构域变异体(reorganization human KD/APP variant,rhKD/APPvar)对实验性慢性肝损伤大鼠肝组织纤维化改变的影响,并对其作用机制进行探讨。
1 材料与方法
1.1 实验动物
Wistar大鼠,雌雄兼用,由长春高新医学动物研究中心提供。合格证号:医动字第1055113。
1.2 实验方法
1.2.1 大鼠慢性CCl4肝损伤模型的建立 Wistar大鼠,体重190-210g,雌雄各半,由高新实验动物中心供应。本实验采用新鲜的花生油作为溶剂。将25%CCl4溶解于花生油中混匀。正常对照组仅皮下注射花生油5ml/kg,其它各组大鼠首次给予CCl4原液5ml/kg,以后每周2次25%CCl4液(花生油稀释)5ml/kg皮下注射。禁食,不禁水。
1.2.2 动物分组及给药 取Wistar大鼠70只(体重190-210g,雌雄各半),随机分为7组,每组10只。
第1组为正常对照组(空白组):腹腔注射等量生理盐水。
第2组为CCl4中毒模型组(模型组):腹腔注射等量生理盐水。
第3组为rhKD/APPvar小剂量组:腹腔注射2万KIU·kg-1。
第4组为rhKD/APPvar中剂量组:腹腔注射4万KIU·kg-1。
第5组为rhKD/APPvar大剂量组:腹腔注射8万KIU·kg-1。
第6组为抑肽酶组:腹腔注射抑肽酶4万KIU·kg-1。
第7组为rhKD/APP组:腹腔注射rhKD/APP 4万KIU·kg-1。
3-5组每天给予rhKD/APPvar一次,连用4周,第6组每天给予抑肽酶注射液一次,连用4周。第7组每天给予rhKD/APP一次,连用4周。禁食,不禁水。
1.2.3 胶原纤维染色 末次给药1h后处死大鼠,取肝大叶相同部位的一小块肝组织固定于10%福尔马林,常规法制做组织切片,利用Masson氏染色法染色进行胶原纤维染色后,在光镜下观察肝细胞变性坏死程度、肝间质纤维增生程度。
Masson染色法:切片脱蜡至水;1%高锰酸钾氧化切片5min;水洗,草酸漂白1min;水洗,蒸馏水洗,天青石蓝染5min水洗;摔去余液不用水洗,滴染Mayer氏苏木素3-5min;流水冲洗5-10min;丽春红苦味酸饱和液染5min;1%醋酸水溶液洗;1%磷钼酸分化切片约5min;蒸馏水洗;1%淡绿或者甲苯胺蓝滴染30s;1%醋酸水溶液洗切片;95%酒精分化,无水酒精脱水;二甲苯透明,中性树胶封固。
结果判定:胶原纤维呈现绿色或蓝色,细胞核呈现灰黑或灰蓝色,胞质红细胞呈现红色。利用O-lympus图像分析软件,自动分析蓝染胶原面积,并计算其相对面积,即与总面积的比值。每组随机选择50个视野进行比较。
1.2.4 统计学处理 实验数据以±s表示,各组之间数据比较均采用两组资料秩和检验的方法。
2 结果
利用Masson氏染色法染色肝组织胶原纤维以评测肝组织纤维化程度。胶原纤维被染为蓝色或绿色,其它细胞、组织以红色着色为主。利用Olympus图像分析软件自动分析蓝染胶原面积。空白对照组极少见着色的胶原纤维,仅在血管周围可见少量蓝染胶原纤维区域(图1),相对胶原面积为(1±0.02)%。模型对照组胶原纤维增生明显,穿插肝组织形成较为明显的假小叶,胶原纤维总面积大(图2),相对胶原面积为(31±5.25)%。rhKD/APPvar小剂量组胶原纤维增生明显,相对胶原面积为(28±7.78)%,同模型组相比无明显减轻趋势(图3)。rhKD/APPvar中剂量组,胶原纤维增生以局部多见,较少相互交叉形成假小叶(图4),相对胶原面积为(21±6.24)%,与模型组相比胶原面积显著减少(P<0.05)。rhKD/APPvar大剂量组,胶原纤维增生较轻,汇管区及血管周围可见轻度胶原纤维增生,无假小叶形成(图5),相对胶原面积为(8±2.21)%,与模型组相比显著降低(P<0.05)。抑肽酶组及rhKD/APP组胶原纤维增生明显,以汇管区居多,假小叶形成较少(图6,7),相对胶原面积分别为(23±4.87)%和(26±10.21)%。与模型组相比显著降低(P<0.05),但高于rhKD/APPvar大剂量组。实验结果显示,rhKD/APPvar能够显著抑制大鼠肝脏纤维化。
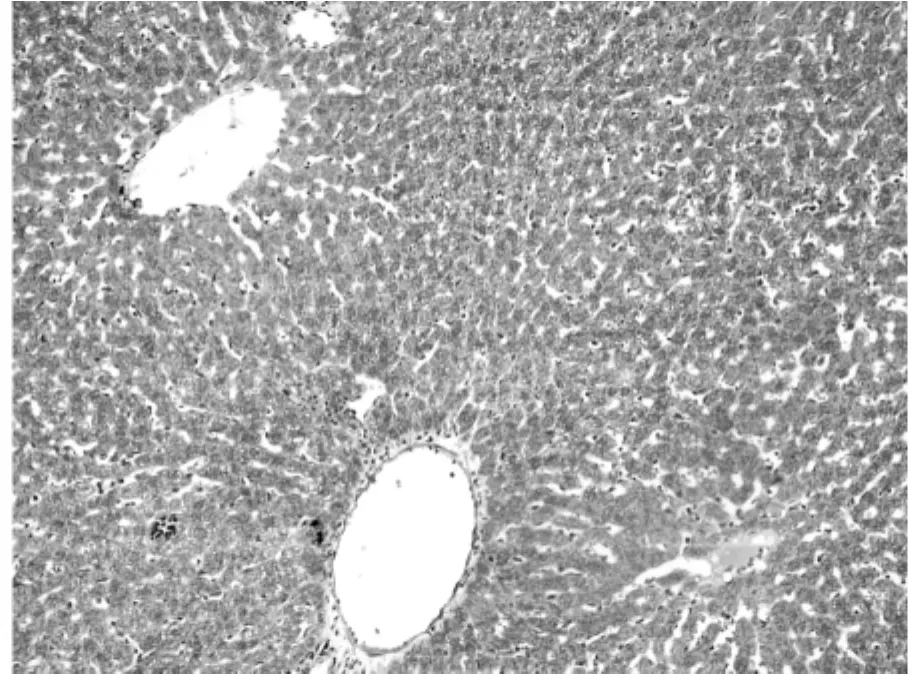
图1 空白对照组相对胶原面积为(1±0.02)%(200×)
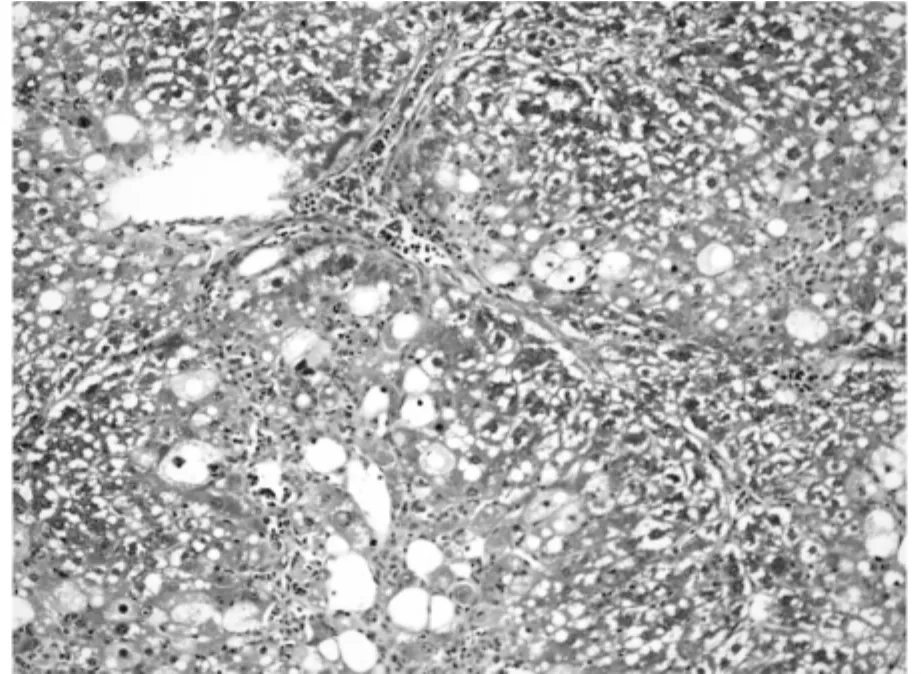
图2 模型组相对胶原面积为(31±5.25)%(200×)
3 讨论
肝纤维化是慢性肝病造成的,是一个常见的世界性难题。四氯化碳(Carbon Tetrachloride,CCl4)作为经典的亲肝毒物,主要经呼吸道和消化道进入体内,对人和动物均可致肝损伤。目前国内外多采用CCl4建立肝损伤模型[7,8]。但肝纤维化具逆转的可能性。从本质上讲,慢性肝病的治疗就是肝纤维化的治疗,主要是祛除原发病的病因和抗肝纤维化治疗,因此,肝纤维化的治疗和抗肝纤维化的治疗有不同的概念与范围。目前根据抗纤维化药物作用于纤维化过程的不同环节大致可分为5类:①细胞保护类:本类药物的作用机制为保护肝细胞阻止其凋亡。现已证实熊去氧胆酸(UDCA)对原发性胆汁性肝纤维化有效。二甲基前列腺素E2(DMPGE2)可抑制鼠慢性营养性肝损伤模型肝内胶原的沉积;也有报道DMPGE2显著改善CCl4诱发大鼠肝纤维化模型的肝纤维化程度,并认为肝细胞保护作用是前列腺素抗肝纤维化的机制之一;②HSC活化抑制类:其中主要药物首推干扰素(interferon,INF)。目前认为α和γ型干扰素具有明显的抗肝纤维化作用。国外研究INF-γ抗肝纤维机制主要为阻止HSC的增殖和活化,减少胶原成分的mRNA转录,从而减少ECM成分的表达。此外,INF-γ还具有阻止肝纤维化进一步发展以及减低纤维化水平的作用;③中和细胞因子活性类:血小板衍生因子(PDGF)和转化生长因子β(TGF-β)是 HSC活化及产生ECM的主要细胞团子。因此设想,中和两种细胞因子的活性是一种有发展潜力的抗纤维化疗法;④抑制ECM合成及分泌类:a.脯氨酸羟化酶抑制物:脯氨酸羟化酶竟争性抑制物可抑制脯氨酸的
羟化反应,减少前胶原三股螺旋α肽链的稳定性。其中二羧基吡啶衍生物经动物实验证明具有抗纤维化、抑制HSC活化的作用。口服锌制剂可在脯氨酸羟化酶的活性部位与Fc竞争结合而抑制此酶活性,减少胶原物质在肝脏的沉积。b.山黧豆素(lthyrogen):本药含有β-氨基丙腈和氨基已腈,可以阻止胶原纤维和弹力纤维的架桥连接。目前本药对肝纤维化的治疗尚未用于临床,仍处于实验阶段。c.铜离子络合剂:D-青霉胺用于临床上肝豆状核变性所致肝纤维化的治疗具有一定疗效,但对其他原因所致肝纤维化并无明显疗效。d.秋水仙碱(colchicie):其作用机制为抑制微管蛋白的聚合,从而干扰细胞胶原分泌。⑤促进ECM降解类:主要是指具有胶原酶活性或促进胶原酶活性药物。有人报告大黄酸、来氟米特对CCl4所致的大鼠肝纤维化有保护抑制作用[9]。CCl4导致肝损伤机制目前认为与CCl4自身和其自由基代谢产物有关。在鼠CCl4肝损伤期间,肿瘤坏死因子受体-1(TNFR-1)介导的信号是损伤后促有丝分裂应答的主要成分[10-11]。近年来,随着对肝纤维化的形成机制认识的深入及基因治疗技术的发展,采用基因调节治疗,阻断肝脏内炎症及纤维化的关键环节,日益引起学者们的重视[12]。但基因治疗肝纤维化进入临床试验恐非短期内能达到目的。

图3 rhKD/APPvar小剂量组相对胶原面积为(28±7.78)% (200×)
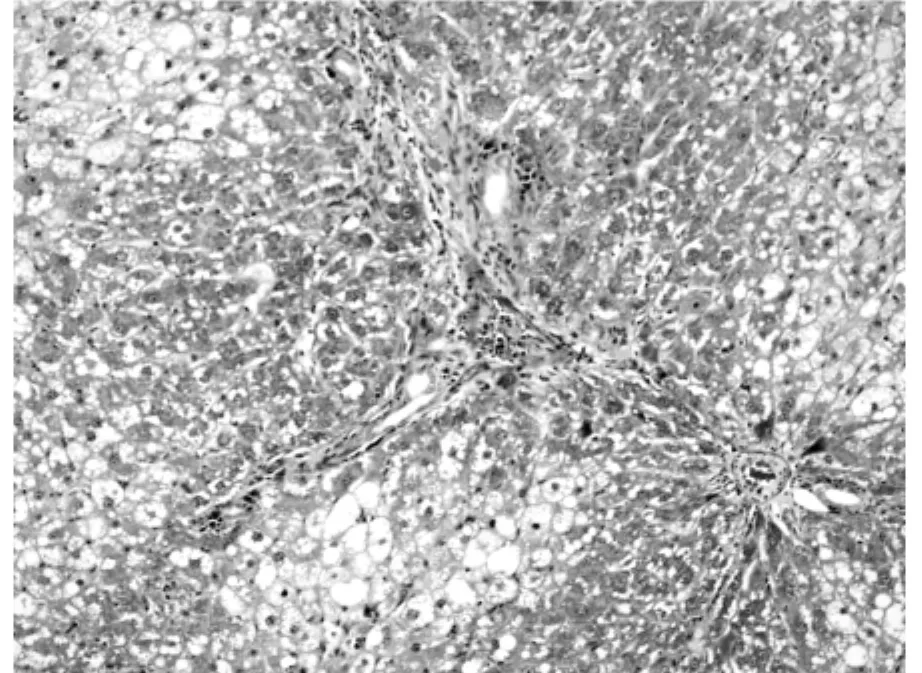
图4 rhKD/APPvar中剂量组相对胶原面积为(21±6.24)% (200×)
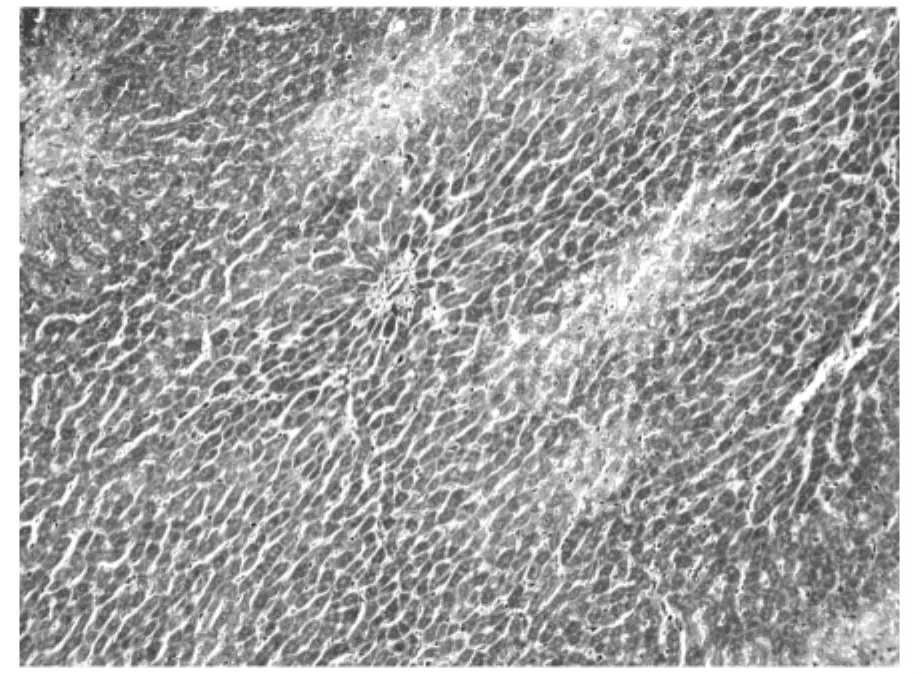
图5 rhKD/APPvar大剂量组相对胶原面积为(8±2.21)% (200×)
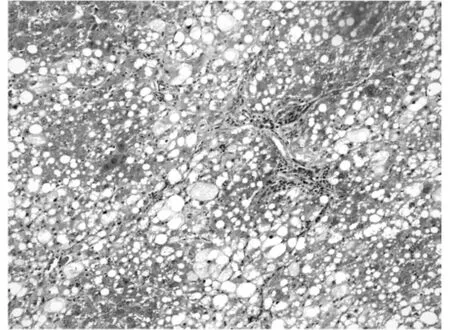
图6 抑肽酶组相对胶原面积为(23±4.87)%(200×)
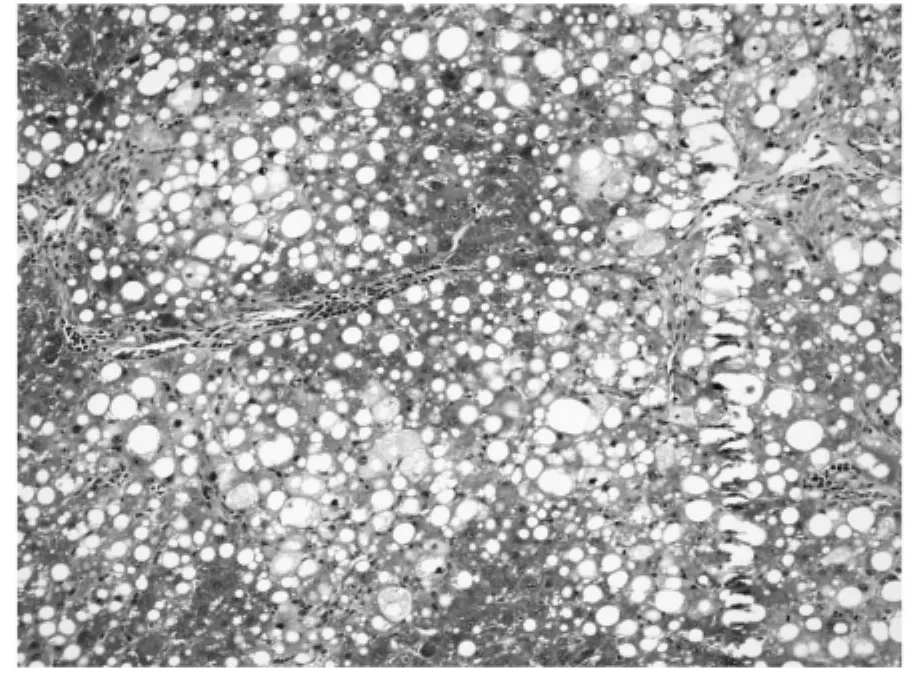
图7 rhKD/APP组相对胶原面积为(26±10.21)%(200×)
淀粉样蛋白前体中的Kunitz型蛋白酶抑制剂结构域(Kunitz protease inhibitor domain of amyloid protein precursor,KD/APP)是人 Kunitz型蛋白酶抑制剂(Kunitz protease inhibitor,KPI),具有强烈抑制丝氨酸蛋白酶的活性,是较理想的牛胰蛋白酶抑制剂(Bovine pancreatic trypsin inhibitor,BPTI)替代品。本研究采用重组人淀粉样蛋白前体中的Kunitz型蛋白酶抑制剂结构域变异体(reorganization human KD/APP variant,rhKD/APP-var),通过建立慢性肝损伤的动物模型,观察rhKD/APPvar在慢性肝损伤中的保护作用。结果显示本实验模型对照组胶原纤维增生明显,穿插肝组织形成较为明显的假小叶,胶原纤维总面积大。rhKD/APPvar小剂量组胶原纤维增生明显,同模型组相比无明显减轻趋势。rhKD/APPvar中剂量组,胶原纤维增生以局部多见,较少相互交叉形成假小叶,与模型组相比胶原面积显著减少(P<0.05)。rhKD/APPvar大剂量组,胶原纤维增生较轻,汇管区及血管周围可见轻度胶原纤维增生,无假小叶形成,与模型组相比显著降低(P<0.05)。BPTI组及rhKD/APP组胶原纤维增生明显,以汇管区居多,假小叶形成较少,与模型组相比显著降低(P<0.05),但高于rhKD/APPvar大剂量组。实验结果显示,rh-KD/APPvar能够显著抑制大鼠肝脏纤维化,其大剂量效果优于BPTI和rhKD/APP组。
本实验结果表明rhKD/APPvar对大鼠慢性CCl4肝损伤模型具有很好的保护性作用,明显减轻慢性肝损伤的程度,抑制肝纤维化的发展。尽管其作用机制还不清楚,但从本实验的结果可以认为是从减轻肝细胞的损伤及抑制肝纤维化的发展两个方面对慢性肝损伤起到保护性作用的。
[1]Posadas SJ,Caz V,Caballero I,et al.Effects of mannoprotein E1 in liquid diet on inflammatory response and TLR5expression in the gut of rats infected by Salmonella typhimurium[J].BMC Gastroenterol,2010,10(1):58.
[2]Greif F,Ben-Ari Z,Taya R,et al.Dual effect of erythropoietin on liver protection and regeneration after subtotal hepatectomy in rats[J].Liver Transpl,2010,16(5):631.
[3]Ellett JD,Atkinson C,Evans ZP,et al.Murine Kupffer cells are protective in total hepatic ischemia/reperfusion injury with bowel congestion through IL-10[J].J Immunol,2010,184(10):5849.
[4]王虹蛟,张馨木,常淑芳,等.抑肽酶对小鼠急性肝损伤的保护作用[J].中国实验诊断学,2005,9(3):420.
[5]孟威宏,王虹蛟,张馨木,等.口服抑肽酶对大鼠急性肝损伤的保护作用[J].吉林大学学报:医学版,2006,32(3):370.
[6]王虹蛟,孟威宏,王 强,等.抑肽酶对实验性慢性肝损伤的保护作用[J].中国实验诊断学,2008,12(1):4.
[7]Wassers S,Tan CE.Expermental models of hepatic fibrosis in the rat.Ann Acad Med Singapore.1999,28(1):109.
[8]McGregor D,Lang M.Carbon tetrachloride:genetic effects and other modes of action[J].Mutat Res.1996,366(3):181.
[9]Davis R,Whittington R.Aprotinin:a review of its pharmacology and therapeutic efficacy in reducing blood loss associated with cardiac surgery[J].Drugs,1995,49(6):954.
[10]Pinzani M,Milani S,Grappone C,et al.Expression of plateletderived growth factor in a model of acute liver injury[J].Hepatology.1994,19(3):701.
[11]Date M,Matsuzaki K,Matsushita M,et al.Differential regulation of activin A for hepatocyte growth and fibronectin synthesis in rat liver injury[J].J Hepatol.2000,32(2):251.
[12]Berr Ari Z,Hochhauser E,Burstein I,et al.Role of anti-tumor necrosis factor alpha in ischemia/reperfusioninjury in isolated rat liver in a blood-free environment[J].Transplan tati on,2002,73(12):1875.
