地西他滨联合半剂量CAG方案治疗骨髓增生异常综合征
2013-11-23伏媛朱华渊徐佳岱谌廷妹吴微钱思轩李建勇刘澎
伏媛 朱华渊 徐佳岱 谌廷妹 吴微 钱思轩 李建勇 刘澎
1 临床资料
1.1 病例 患者男,68岁,2011年7月4日因“确诊骨髓增生异常综合征(MDS)5月”入院。患者1月28日体检发现贫血,入住当地医院诊断为铁粒幼细胞性贫血,予维生素B6、重组人促红细胞生成素(EPO)、复方皂矾丸治疗后贫血改善。3月4日外院复查骨髓常规及活检:MDS-RA,予沙利度胺及安特尔治疗,但贫血改善不明显。5月5日我院血常规:白细胞3.8×109/L,血红蛋白50 g/L,血小板65×109/L;染色体:46,XY[20];骨髓常规及活检:骨髓增生异常综合征-难治性血细胞减少(MDS-RCMD)。5月19日起予地西他滨(达珂)联合半剂量CAG(阿糖胞苷+阿克拉霉素+重组人粒细胞刺激因子)化疗,粒细胞缺乏(粒缺)期并发颈部软组织感染,予抗感染及输血等对症治疗后好转。7月4日为再次巩固治疗入院。入院查体:一般生命体征平稳,轻度贫血貌。皮肤黏膜无瘀点瘀斑,胸腹、四肢皮肤见少许皮疹,暗红色。全身浅表淋巴结未及。眼睑不肿,唇无发绀,牙龈无肿胀,口腔无溃疡,扁桃体无肿大。胸骨无压痛,心肺听诊阴性。腹平软,无压痛及反跳痛,肝脾肋下未及,双下肢局部皮肤褪皮,无浮肿。
1.2 辅助检查 血常规:白细胞 19.4×109/L,血红蛋白 67 g/L,血小板 171×109/L;血生化:白蛋白32.1 g/L,乳酸脱氢酶(LDH)170 U/L,血清铁蛋白1030.0μg/L;骨髓常规:MDS-RCMD;染色体:46,XY[20];大小便常规、胸片及心电图均无异常。
1.3 诊断 MDS-RCMD。
1.4 治疗 7月5日起予地西他滨(达珂)联合半剂量CAG治疗,7月14日出现粒缺(图1A),7月15日出现高热伴畏寒、咳嗽,肺部听诊呼吸音粗,无音,予经验性抗感染治疗。发热未控制,且口腔内出现霉菌斑,血培养阴性,7月20日复查血培养,调整抗生素为:美罗培南、利奈唑胺联合伏立康唑,7月22日胸部CT:双肺多发斑片、斑点、索条及网状影,部分病灶较模糊;两侧胸腔少量积液;两下肺胸膜下少许条索影,两侧胸膜增厚、粘连(图2A)。7月26日患者突发急性左心衰,予吸氧、利尿及硝酸甘油对症处理后症状好转。第2次血培养示肺炎克雷白菌;痰涂片见少量革兰阴性球菌,7月30日抗生素调整为:哌拉西林钠他唑巴坦、莫西沙星联合伏立康唑。8月2日胸部CT:与7月22日相比,两肺新出现弥漫斑片、条索状影,呈网格状改变;两侧胸膜粘连、增厚;两侧胸腔中量积液(图2B)。8月3日1-3β-D葡萄糖抗原、半乳甘露聚糖抗原(G、GM)试验均阳性,结核抗体和痰真菌培养阴性,痰涂片未见真菌孢子,结合症状及辅助检查,考虑真菌感染,8月4日换用卡泊芬净抗真菌,予大剂量甲强龙治疗间质性肺炎。8月18日胸部CT:与8月2日CT相比,两肺斑片、条索、结节状病灶减轻;两侧胸腔积液消失(图2C)。8月19日血常规:白细胞6.7×109/L,血红蛋白75 g/L,血小板118×109/L。停用抗生素,激素改予泼尼松龙口服。考虑患者骨髓造血功能已恢复,感染好转,8月20日予出院,院外继续口服伏立康唑。9月16日查胸部CT:与8月18日CT相比,病灶大部分吸收,双上肺少许陈旧灶(图2D)。
1.5 疗效 患者体温正常,感染控制,血小板恢复正常,贫血好转,血红蛋白稳定在>75 g/L,脱离了输血依赖。
2 讨论
MDS是一组起源于造血干/祖细胞的克隆性疾病,以造血细胞凋亡亢进和病态造血为特征,是引起老年患者全血细胞减少的一种常见原因[1],具有向急性髓细胞白血病(AML)转化的风险,对传统治疗反应差,转为AML后缓解率低、预后差、治疗相关并发症和死亡率高。在临床上MDS依国际预后积分系统(IPSS)危度分组,低危和中危-1患者,采用对症治疗刺激造血能力,提高造血效率,来改善患者的生活质量;中危-2和高危患者,则予高强度的化疗以根除恶性克隆,恢复正常造血,延长患者的生存时间。
2.1 达珂的作用机制、治疗MDS的指征及疗效 关于MDS的具体发病机制尚不明确,但已证实DNA甲基化异常,尤其是抑癌基因的高甲基化失表达在MDS和白血病的发病中起重要作用。DNA过甲基化影响基因表达的调控和基因组的稳定性,被认为与肿瘤的形成相关[2]。达珂是脱氧胞苷酸类似物,属于抗代谢药物,在体内体外均能与DNA甲基转移酶(DNMT)结合,并在DNA复制的过程中参入到DNA中并与DNMT永久结合,使细胞内DNMT的浓度降低,从而使抑癌基因恢复正常的去甲基状态,使细胞恢复正常的分化、衰老及凋亡的演变过程[3-4]。1993年首次报道达珂对MDS治疗有效[5],且用药后部分有异常核型的患者可恢复正常核型[6]。FDA和欧盟分别于2002年和2003年批准5-氮杂胞苷(5-aza)用于各种类型MDS的治疗;达珂抑制 DNA甲基化的活性是5-aza的30倍[7],2006年FDA批准达珂用于MDS的治疗,适用于初治和治疗过的MDS、所有FAB亚型原发或继发MDS及IPSS积分为中危-1、中危-2及高危 MDS患者[8]。达珂治疗MDS的完全缓解率约为30%,联合骨髓移植能提高患者总体生存率,但不增加移植相关不良反应[9-10];接受达珂治疗后患者的健康状况较治疗前明显改善,生存质量提高[11-12]。我们报道的该例患者按IPSS分组为中危-1,有严重贫血和明显的出血倾向,予多种保守治疗效果均不明显,已出现输血依赖,考虑疾病进展,结合患者病情及对前期治疗的反应,选用了达珂联合半剂量CAG方案。
2.2 达珂治疗MDS的不良反应及预后评价 由于MDS患者的造血储备能力不佳,对强烈化疗的承受能力差,易发生严重而持久的骨髓造血功能抑制。临床试验发现,小剂量达珂治疗MDS发生骨髓抑制的概率及严重程度低于传统方案,这可能与达珂通过去甲基化诱导肿瘤细胞凋亡有关[13]。小剂量达珂治疗MDS常见的Ⅲ~Ⅳ级血液学不良反应主要为粒细胞和血小板减少,血红蛋白减低较轻[14],Ⅲ~Ⅳ级的非血液学不良反应主要有:发热、败血症、肺炎、心血管疾病、胃肠道反应、黏膜炎等[15];但通过积极对症治疗后基本上所有患者均能安全恢复,总体治疗过程相对安全,耐受性好。MDS患者应用达珂第1疗程中大多会出现Ⅲ~Ⅳ级骨髓抑制,而第2疗程骨髓抑制程度明显减轻,外周血各系恢复时间也缩短[16];阿糖胞苷治疗MDS发生严重骨髓抑制的概率约为88%[13],达珂对骨髓抑制的发生率明显低于阿糖胞苷。该例患者应用达珂的2个疗程中均出现较严重的骨髓抑制,外周血三系减低,以中性粒细胞和血小板更明显,但第1疗程结束后骨髓抑制情况更严重、更持久(图1A、B、C),这与之前的报道一致。这可能是MDS患者自身的正常造血储备能力差、治疗前外周血较低以及达珂本身的细胞毒作用等综合作用的结果;但与之前报道不同的是,该例患者2疗程中均出现粒缺、发热和感染(图1D),第2疗程感染更严重、更持久;提示达珂治疗MDS发生感染的严重程度并不完全与骨髓抑制的程度及持续时间相关,可能还和病态造血、患者的一般状况及对病原的敏感程度相关。另外,该例患者第2疗程CT结果提示间质性肺炎,给予大剂量甲强龙治疗有效,但目前尚未发现有关达珂能引起肺间质性病变的报道。
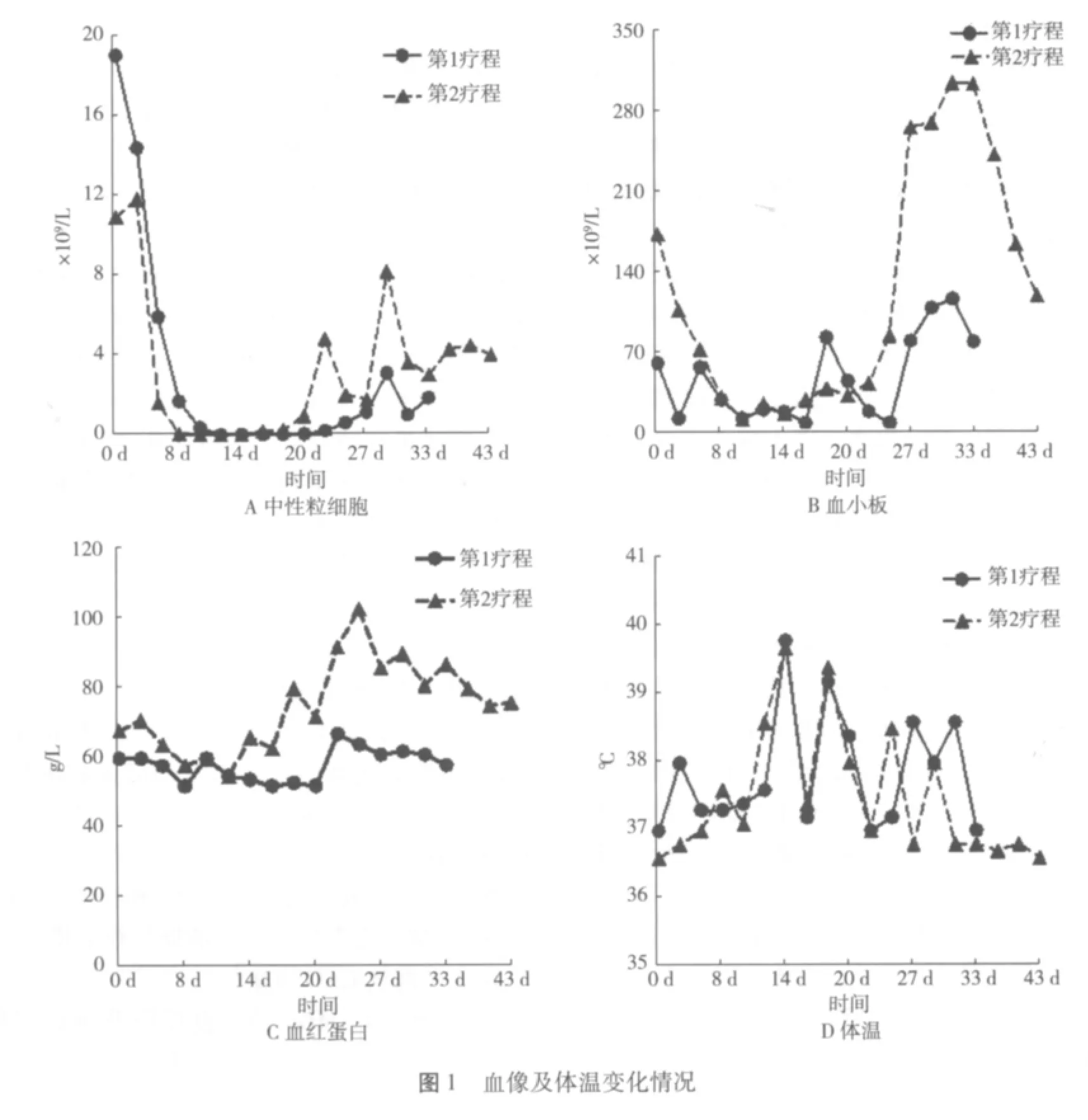

2.3 达珂治疗MDS的预后影响因素及疗效评价 达珂治疗MDS的预后与治疗前的血红蛋白、血小板及核型无关,而与IPSS分组、LDH、年龄及血小板对治疗的反应相关。LDH大于正常值1.5倍是不良预后因素,血小板对治疗的反应与总生存时间密切相关[15-17]。达珂治疗后患者骨髓平均受抑期约5周,未缓解者甚至需要更长时间才能脱离输血,所以达珂治疗MDS临床可评价疗效的时间应>2疗程[15]。我们报道的患者治疗前LDH正常,IPSS分组为中危-1,2疗程中血小板对治疗均敏感,且以第2疗程更明显;2疗程后评价疗效显示,患者血小板基本恢复正常,血红蛋白明显提升,基本脱离了输血依赖。
总之,该患者接受达珂联合半剂量CAG化疗后血液学改善明显,说明达珂治疗老年MDS疗效确切;但两疗程中均发生了长期的严重骨髓抑制、粒缺感染,提示达珂治疗老年MDS应警惕化疗后发生长期严重血液学毒性及并发感染的风险。
[1]童华波,段婉,安晓莉.55例老年人全血细胞减少骨髓象及病因分析[J].实用老年医学,2011,25(6):525-526.
[2]Dhodapkar M,Grill J,Lust JA.Abnormal regional hyper methylation of the calcitonin gene in myelodysplastic syndromes[J].Leuk Res,1995,19(10):719-726.
[3]Mund C,Hackanson B,Stresemann C,etal.Characterization of DNA demethylation effects induced by 5-Aza-2'-deoxycytidine in patients with myelodysplastic syndrome[J].Cancer Res,2005,65(16):7086-7090.
[4]Momparler RL,Bovenzi V.DNA methylation and cancer[J].JCell Physiol,2000,183(2):145-154.
[5]Zagonel V,Lo Re G,Marotta G,etal.5-Aza-2'-deoxycytidine(Decitabine)induces trilineage response in unfavourable myelodysplastic syndromes[J].Leukemia,1993,7(Suppl 1):30-35.
[6]Daskalakis M,Nguyen TT,Nguyen C,etal.Demethylation of a hypermethylated P15/INK4B gene in patients with myelodysplastic syndrome by 5-Aza-2'-deoxycytidine(decitabine)treatment[J].Blood,2002,100(8):2957-2964.
[7]Lin PX,Fields RD,v Agoston D.Effects of electrical stimulation on GAP-43 expression in mouse sensory neurons[J].Brain Res Dev Brain Res,1993,76(1):95-103.
[8]徐泽峰,肖志坚.地西他滨治疗骨髓增生异常综合症的研究进展[J].中华血液学杂志,2007,28(1):61-64.
[9]De Padua Silva L,de Lima M,Kantarjian H,etal.Feasibility of allo-SCT after hypomethylating therapy with decitabine for myelodysplastic syndrome[J].Bone Marrow Transplant,2009,43(11):839-843.
[10]Gore SD,Hermes-DeSantis ER.Future directions in myelodysplastic syndrome:newer agents and the role of combination approaches[J].Cancer Control,2008,15(Suppl 1):40-49.
[11]Kantarjian H,Issa JP,Rosenfeld CS,etal.Decitabine improves patient outcomes in myelodysplastic syndromes:results of a phase Ⅲ randomized study[J].Cancer,2006,106(8):1794-1803.
[12]Pitako JA,Haas PS,Van den Bosch J,etal.Quantification of outpatient management and hospitalization of patients with high-risk myelodysplastic syndrome treated with low-dose decitabine[J].Ann Hematol,2005,84(Suppl 1):25-31.
[13]Yoshida M,Tsunoda S,Akutsu M,etal.The clinical effect of low-dose Ara-C in patients with refractory acute nonlymphocytic leukemia and myelodysplastic syndrome[J].Gan To Kagaku Ryoho,1987,14(4):1057-1062.
[14]Tien HF,Tang JH,Tsay W,etal.Methylation of the p15(INK4B)gene in myelodysplastic syndrome:it can be detected early at diagnosis or during disease progression and is highly associated with leukaemic transformation[J].Br J Haematol,2001,112(1):148-154.
[15]Wijermans PW,Lubbert M,Verhoef G,etal. An epigenetic approach to the treatment of advanced MDS;the experience with the DNA demethylating agent 5-aza-2'-deoxycytidine(decitabine)in 177 patients[J].Ann Hematol,2005,84(Suppl 1):9-17.
[16]邵秀茹,梁红,关晓军,等.地西他滨治疗中、高危骨髓增生异常综合征患者的临床研究[J].中华血液学杂志,2011,32(11):789-791.
[17]van den Bosch J,Lubbert M,Verhoef G,etal.The effects of 5-aza-2'-deoxycytidine(Decitabine)on the platelet count in patients with intermediate and high-risk myelodysplastic syndromes[J].Leuk Res,2004,28(8):785-790.
