右美托咪啶复合瑞芬太尼全凭静脉麻醉对老年开腹手术患者术中血流动力学的影响
2013-11-23冯丹丹张伟马正良郝静顾小萍
冯丹丹 张伟 马正良 郝静 顾小萍
老年患者由于年龄增长导致呼吸、心血管、肝、肾等系统生理功能衰退,组织细胞的退行性改变及病理生理的改变较难承受麻醉和手术中的强烈刺激,围手术期维持血流动力学的平稳对老年患者的生命安全和术后的早期康复都起着重要作用。盐酸右美托咪啶(dexmedetomidine hydrochloride)是新型高选择性 α2肾上腺素能受体激动剂,具有镇静、抗焦虑、镇痛、稳定血流动力学、呼吸抑制轻等特点,目前已在全麻辅助用药等临床实践中成功应用。但将右美托咪啶作为主要镇静药应用于全身麻醉国内鲜有报道。本研究将右美托咪啶维持的全身麻醉应用于老年开腹手术,比较右美托咪啶和丙泊酚分别复合瑞芬太尼全凭静脉麻醉对老年开腹手术术中血流动力学的影响。
1 资料和方法
1.1 一般资料 选择我院2012年2~6月全麻下上腹部手术40例,年龄60~80岁,ASAⅠ~Ⅱ级。排除标准:(1)有颅脑外伤或手术史者或有严重中枢神经系统损伤者。(2)冠心病、重度心律失常以及心功能不全。(3)肝肾功能明显异常者。(4)具有主要精神疾病或者精神疾病倾向者。(5)近期使用抗精神病药物、酗酒或者滥用药物者。(6)不同意合作者。(7)体质量指数(BMI)>25或BMI<18.5。入选患者按序列号法随机分成右美托咪啶组(D组)和丙泊酚组(C组),每组20例。D组男9例,女11例,年龄(64.1±4.8)岁,C组男12例,女8例,年龄(61.2±2.1)岁。2组患者在年龄、身高、体质量、手术时间、失血量和尿量上均无统计学差异(P>0.05)。
1.2 方法 患者术前12 h禁食禁饮,未用术前药。进入手术室后前臂留置20G留置针开放静脉,麻醉诱导前持续输注复方氯化钠10 ml/(kg·h)。局麻下进行桡动脉穿刺置管及右颈内静脉穿刺置管,连接Flotrac/VigileoCCO/SvO2持续心排量监护仪(爱德华生命科学有限公司)监测心排量指标,连接Philips组合式病人监护仪MP60监测心电图(ECG)、血氧饱和度(SPO2)、血压(BP)、中心静脉压(CVP)、脑电双频指数(BIS)等指标。D组在麻醉诱导前给予右美托咪啶(批号:11120234,江苏恒瑞医药股份有限公司)0.6 μg/kg,10 min内泵注完成。麻醉诱导给予咪达唑仑100 μg/kg,芬太尼 3 μg/kg,维库溴铵 0.1mg/kg。C组不使用右美托咪啶而给予丙泊酚1mg/kg。气管内插管后连接通用Datex-Ohmeda 7100麻醉机行机械通气,监测呼气末二氧化碳分压(PETCO2)。麻醉维持:D组给予右美托咪啶2.0μg/(kg·h),C组给予丙泊酚100μg/(kg·min),2组均根据BIS调整使其维持在40~60。同时采用微量泵连续输注瑞芬太尼0.25μg/(kg·min),维库溴铵 0.1mg/(kg·min),调整呼吸机参数,使PETCO2维持在35~45 mmHg。血流动力学变化处理:收缩压(SBP)超过或下降术前20%,给予相应的血管活性药物,包括麻黄素、去氧肾上腺素、硝酸甘油等。心率(HR)<60次/min,给予阿托品0.25~0.5mg;HR>100次/min,给予艾司洛尔20mg。手术结束前半小时给予芬太尼2μg/kg,所有维持药物使用至手术结束。
1.3 监测指标 记录麻醉前(T0)、麻醉诱导后(T1)、气管插管后即刻(T2)、切皮后(T3)、打开腹腔时(T4)、冲洗腹腔时(T5)以及关腹时(T6)患者的有创动脉 BP、HR、CVP、心输出量(CO)、心脏排血指数(CI)、每搏量(SV)、每搏指数(SVI)、每搏量变异度(SVV),记录心血管事件的发生率及血管活性药物的用量。
2 结果
2.1 血流动力学指标变化 术中2组患者的BIS值均维持在40~60。与 D组相比,C组 T1时点 SBP、DBP、MAP、CI、SVI显著下降(P <0.05),在 T5、T6 时点HR显著上升(P<0.05)。与T0时点比较,D组各血流动力学指标无明显变化(P>0.05)。C组T1时点 SBP、DBP、MAP、CO、CI、SV、SVI显著下降(P <0.05),T3时点CVP 显著上升(P <0.05),T3、T4、T5、T6时点CO显著下降(P<0.05),T2、T5、T6时点SVI显著下降(P<0.05)。与T1时点比较,D组T5时点CVP显著上升(P<0.05),C组 T2、T3、T4时点 SBP、DBP、MAP、CO、CI、SV、SVI显著上升(P <0.05),T5 时点 DBP、CO、SV、SVI显著上升(P <0.05),见表1。
2.2 用药情况 手术过程中C组患者去氧肾上腺素用量显著多于D组;D组患者硝酸甘油用量显著多于C组(P<0.05),2组患者阿托品、麻黄碱用量无统计学差异(P>0.05)。见表2。
表1 2组术中血流动力学指标比较,n=20)
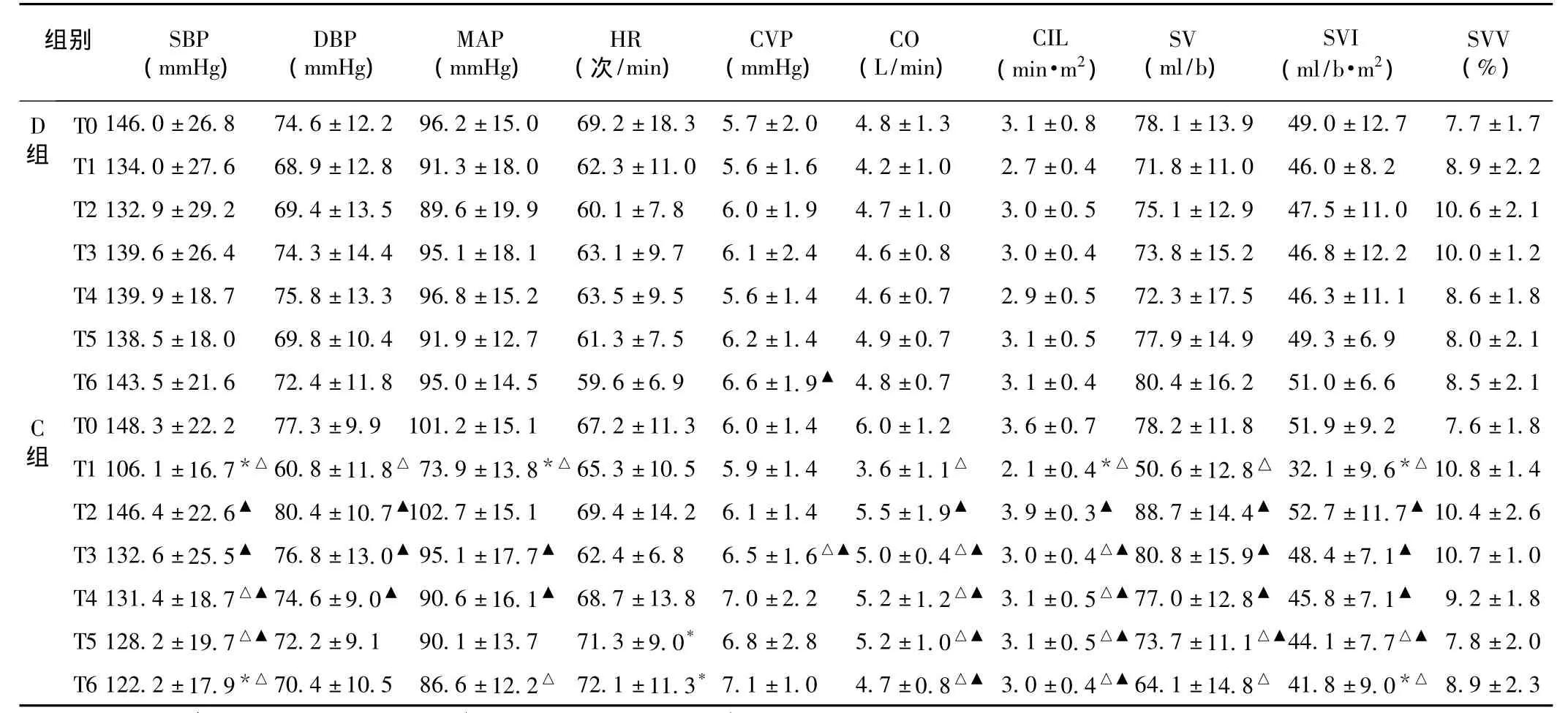
表1 2组术中血流动力学指标比较,n=20)
注:与D组比较,*P<0.05;与T0时比较,△P<0.05;与T1时比较,▲P<0.05
组别 SBP(mmHg)DBP(mmHg)MAP(mmHg)HR(次/min)CVP(mmHg)CO(L/min)CIL(min·m2)SV(ml/b)SVI(ml/b·m2)SVV(%)D组T0 146.0±26.8 74.6±12.2 96.2±15.0 69.2±18.3 5.7±2.0 4.8±1.3 3.1±0.8 78.1±13.9 49.0±12.7 7.7±1.7 T1 134.0±27.6 68.9±12.8 91.3±18.0 62.3±11.0 5.6±1.6 4.2±1.0 2.7±0.4 71.8±11.0 46.0±8.2 8.9±2.2 T2 132.9±29.2 69.4±13.5 89.6±19.9 60.1±7.8 6.0±1.9 4.7±1.0 3.0±0.5 75.1±12.9 47.5±11.0 10.6±2.1 T3 139.6±26.4 74.3±14.4 95.1±18.1 63.1±9.7 6.1±2.4 4.6±0.8 3.0±0.4 73.8±15.2 46.8±12.2 10.0±1.2 T4 139.9±18.7 75.8±13.3 96.8±15.2 63.5±9.5 5.6±1.4 4.6±0.7 2.9±0.5 72.3±17.5 46.3±11.1 8.6±1.8 T5 138.5±18.0 69.8±10.4 91.9±12.7 61.3±7.5 6.2±1.4 4.9±0.7 3.1±0.5 77.9±14.9 49.3±6.9 8.0±2.1 T6 143.5±21.6 72.4±11.8 95.0±14.5 59.6±6.9 6.6±1.9▲4.8±0.7 3.1±0.4 80.4±16.2 51.0±6.6 8.5±2.1 C组T0 148.3±22.2 77.3±9.9 101.2±15.1 67.2±11.3 6.0±1.4 6.0±1.2 3.6±0.7 78.2±11.8 51.9±9.2 7.6±1.8 T1 106.1±16.7*△60.8±11.8△ 73.9±13.8*△65.3±10.5 5.9±1.4 3.6±1.1△ 2.1±0.4*△50.6±12.8△ 32.1±9.6*△10.8±1.4 T2 146.4±22.6▲ 80.4±10.7▲102.7±15.1 69.4±14.2 6.1±1.4 5.5±1.9▲ 3.9±0.3▲ 88.7±14.4▲ 52.7±11.7▲10.4±2.6 T3 132.6±25.5▲ 76.8±13.0▲ 95.1±17.7▲ 62.4±6.8 6.5±1.6△▲5.0±0.4△▲ 3.0±0.4△▲80.8±15.9▲ 48.4±7.1▲ 10.7±1.0 T4 131.4±18.7△▲74.6±9.0▲ 90.6±16.1▲ 68.7±13.8 7.0±2.2 5.2±1.2△▲ 3.1±0.5△▲77.0±12.8▲ 45.8±7.1▲ 9.2±1.8 T5 128.2±19.7△▲72.2±9.1 90.1±13.7 71.3±9.0* 6.8±2.8 5.2±1.0△▲ 3.1±0.5△▲73.7±11.1△▲44.1±7.7△▲ 7.8±2.0 T6 122.2±17.9*△70.4±10.5 86.6±12.2△ 72.1±11.3*7.1±1.0 4.7±0.8△▲ 3.0±0.4△▲64.1±14.8△ 41.8±9.0*△8.9±2.3
表2 2组患者术中使用血管活性药物比较,n=20)
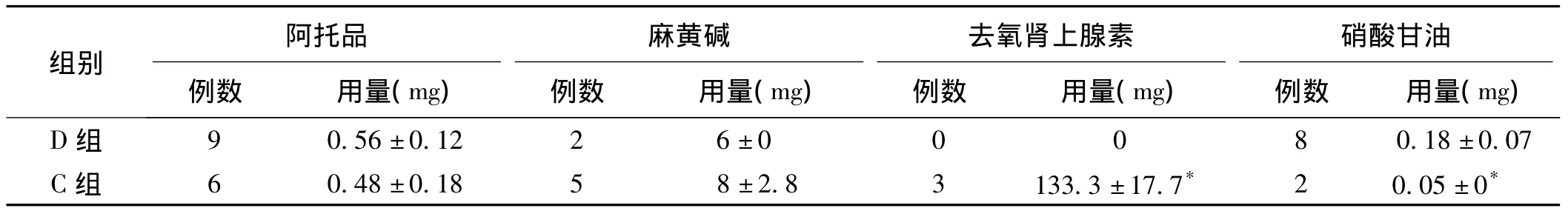
表2 2组患者术中使用血管活性药物比较,n=20)
注:与D组比较,*P<0.05
组别阿托品例数 用量(mg)麻黄碱例数 用量(mg)去氧肾上腺素例数 用量(mg)硝酸甘油例数 用量(mg)D组9 0.56±0.12 2 6±0 0 0 8 0.18±0.07 C组 6 0.48±0.18 5 8±2.8 3 133.3±17.7* 2 0.05±0*
3 讨论
老年患者抵抗力下降,各系统器官发生退行性改变,对麻醉药物的代谢和清除减慢,具有较低的麻醉耐受力和较大的麻醉风险[1],如何既保证麻醉质量又能对患者的生理功能干扰最小,麻醉药物及方法的选择起着重要作用。
右美托咪啶目前用于全身麻醉辅助用药的推荐剂量为负荷剂量1μg/kg,10 min内缓慢注射完毕,维持剂量0.2~0.7μg/(kg·h)。右美托咪啶对血流动力学影响较为复杂,它不仅通过激活交感神经末梢的突触前膜α2肾上腺素能受体,产生血管舒张作用,而且通过激动位于动脉血管壁平滑肌细胞上的α2肾上腺素能受体,产生血管收缩作用,其对HR和BP的影响呈双相和剂量依赖性[2-3]。
本试验选用VigileoCCO/SvO2持续心排量监护仪用于监测术中血流动力学指标,该监测系统准确、简便、微创,可以为尚未使用肺动脉导管(PAC)监测的重症患者提供血流动力学监测,更可以扩展到术中全麻的患者进行相应指标的监测。
右美托咪啶可减少手术期间多种刺激(如气管插管、手术操作、气管拔管等)引起的应激反应[4]。临床研究已证实,全身麻醉中右美托咪啶能明显降低其他麻醉剂的用药剂量尤其是丙泊酚用量[5],改善手术中血流动力学的稳定性和降低心肌局部缺血的发生率,是一种理想的辅助镇静用药[6]。Naguib等[7]研究使用右美托咪啶在1~2μg/(kg·h)剂量作为小儿心脏手术麻醉主要维持用药,血流动力学平稳,镇静深度满意。以右美托咪啶作为一线镇静药物维持全身麻醉在国内外鲜有报道,本试验应用负荷剂量为0.6μg/kg,维持剂量2.0μg/(kg·h)的右美托咪啶,复合瑞芬太尼完成老年开腹手术的麻醉,为全身麻醉的实施提供新的选择。
本研究结果显示,D组患者麻醉方案过程更为平稳,而不存在丙泊酚组血压的较大波动。本研究还发现右美托咪啶在整个麻醉诱导和维持期对CO/CI、SV/SVI的影响轻微,有利于患者的脏器保护,对心功能减退及老年患者尤为适用。
本研究结果还表明了良好的安全性:血管活性药物麻黄碱、阿托品的用量与C组比较无明显差异,无一例需应用去氧肾上腺素,但D组硝酸甘油用量明显大于C组,考虑可能原因为右美托咪啶激动位于动脉血管壁平滑肌细胞上的α2肾上腺素受体,产生血管收缩作用[8],另与高剂量右美托咪啶维持麻醉有关。有报道显示,高剂量右美托咪啶可引起儿童心动过缓,在成人,随着右美托咪啶血浆浓度增加,可引起HR、CO和SV下降,这些改变可引起系统血管阻力增加,从而引起动脉血压增高[9]。Ebert等[10]发现右美托咪啶对血压的影响是双相的,右美托咪啶血浆浓度在0.5、0.8 ng/ml时,MAP平均下降13%,但当MAP≥1.25 ng/ml的浓度时,MAP平均较基线上升12%[11]。
右美托咪啶维持血流动力学稳定,提高麻醉安全的主要机制可能与右美托咪啶降低交感神经活性,均衡减弱α和β肾上腺素能的张力等有关[12];另外通过激动位于动脉血管壁平滑肌细胞上的α2肾上腺素受体,产生血管收缩作用预防血压下降,从而保证了血流动力学的相对平稳,复合瑞芬太尼可能提供协同镇静的作用[13]。这种麻醉方案的优点是在手术过程中将应激反应调控在允许的较低水平,并且可维持稳定的血糖浓度和乳酸浓度,并可减少术后阿片类药物的需求[14]。但右美托咪啶应用于外科手术时需要仔细评估风险与收益,在用于可能引起不良反应的高危患者,例如合并心脏传导阻滞或肾上腺皮质功能减退的患者,可能造成术中低血压或心动过缓[15],需慎用,且其在血浆浓度较高时可能升高MAP。
综上所述,右美托咪啶复合瑞芬太尼维持的全凭静脉麻醉在BIS监测下应用于老年患者开腹手术,麻醉过程平稳,镇静深度充分,为老年患者全身麻醉的实施提供新的选择。
[1]Sophie S.Anaesthesia for the elderly patient[J].Pak Med Assoc,2010,57(4):196-201.
[2]Arcangeli A,D'AlòC,Gaspari R.Dexmedetomidine use in general anaesthesia[J].Curr Drug Targets,2009,10(8):687-695.
[3]Snapir A,Posti J,Kentala E.Effects of low and high plasma concentrations of dexmedetomidine on myocardial perfusion and cardiac function in healthy male subjects[J].Anesthesiology,2006,105(5):902-910.
[4]Yildiz M,Tavlan A,Tuncer S,etal.Effect of dexmedetomidine on haemodynamic responses to laryngoscopy and intubation:perioperative haemodynamics and anaesthetic requirements[J].Drugs R D,2006,7(1):43-52.
[5]Ngwenyama NE,Anderson J,Hoernschemeyer DG,etal.Effects of dexmedetomidine on propofol and remifentanil infusion rates during total intravenous anesthesia for spine surgery in adolescents[J].Paediatr Anaesth,2008,18(12):1190-1195.
[6]Wijeysundera DN,Bender JS,Benttie WS.Alpha-2 adrenergic agonists for the prevention of cardiac complications among patients undergoing surgery[J].Cochrane Database Syst Rev,2009(4):CD004126.
[7]Naguib A,McKee C,Phillips A,etal.Dexmedetomidine as the primary anesthetic agent during cardiac surgery in an infant with a family history of malignant hyperthermia[J].Saudi JAnaesth,2011,5(4):426-429.
[8]Hogue CW Jr,Talke P,Stein PK,etal.Autonomic nervous system responses during sedative infusions of dexmedetomidine[J].Anesthesiology,2002,97(3):592-598.
[9]Mason KP,Zgleszewski S,Forman RE,etal.An exaggerated hypertensive response to glycopyrrolate therapy for bradycardia associated with high-dose dexmedetomidine[J].Anesth Analg,2009,108(3):906-908.
[10]Ebert TJ,Hall JE,Barney JA,etal.The effects of increasing plasma concentrations of dexmedetomidine in humans[J].Anesthesiology,2000,93(2):382-394.
[11]Kamibayashi T,Maze M.Clinical uses of alpha2-adrenergic agonists[J].Anesthesiology,2000,93(5):1345-1349.
[12]刘海龙,张跃,郑国龙.右旋美托咪唑用于食道癌手术麻醉的临床研究[J].中国应用生理学杂志,2011,27(4):495-497.
[13]KangWS,Kim SY,Son JC,etal.The effect of dexmedetomidine on the adjuvant propofol requirement and intraoperative hemodynamics during remifentanil-based anesthesia[J].Korean JAnesthesiol,2012,62(2):113-118.
[14]Pestieau SR,Quezado ZM,Johnson YJ,etal.High-dose dexmedetomidine increases the opioid-free interval and decreases opioid requirement after tonsillectomy in children[J].Can JAnaesth,2011,58(6):540-550.
[15]Gerlach AT,Murphy CV,Dasta JF.An updated focused review of dexmedetomidine in adults[J].Ann Pharmacother,2009,43(12):2064-2074.
