α-synuclein(A53T)蛋白调控自噬诱导神经元凋亡☆
2013-11-23荆婧王雪晶马耀华祝应俊丁晓岚滕军放
荆婧 王雪晶 马耀华 祝应俊 丁晓岚 滕军放
帕金森病(Parkinson’s disease,PD)是一种常见神经退行性疾病,致残率高,严重的威胁中老年人的健康。PD主要的神经病理学特征是中脑黑质致密部多巴胺能神经元进行性变性坏死,以及残存神经元胞浆中嗜酸性包涵体—路易小体(Lewy body,LB)的形成。
α-突触核蛋白(α-synuclein)是LB的纤维组成成分,PD的发生、发展、以及受累脑区的变性均与α-synuclein的异常聚集有密切的联系[1]。常染色体显性遗传家族性PD与α-synuclein基因错义突变型A53T相关,α-synuclein(A53T)通过破坏多巴胺存储与释放、调控囊泡再循环、增加氧化应激水平导致神经变性的发生[2]。自噬和凋亡虽然在形态学方面有明显区别,但在功能上又存在联系,自噬可保护细胞免受凋亡和坏死,也可向凋亡转化共同促进细胞死亡[3]。本研究着眼于α-synuclein(A53T)突变蛋白对神经元自噬水平的调控,进一步探讨α-synuclein(A53T)突变蛋白的致病机制。
1 材料与方法
1.1 细胞培养及转染 人神经母细胞瘤细胞(SH-SY5Y,中南大学湘雅医院唐北沙教授馈赠)常规培养于10%FBS(GIBCO)的DMEM(GIBCO)完全培养液中,置于37℃、体积分数为5%CO2细胞培养箱中培养,以4×105/mL接种于六孔板里,次日转染,转染具体操作参考脂质体Lipofectamine TM2000(Invitrogen)说明书进行。
1.2 Western blot检测 SH-SY5Y细胞分别转染EGFP-N1、EGFP-α-synuclein(WT)、EGFP-α-synuclein(A53T)(质粒为苏州大学王光辉教授馈赠)48 h后,提取细胞总蛋白,各组样品采取总蛋白25μg,进行SDS-PAGE电泳,将蛋白样本转移至硝酸纤维滤膜上。膜用5%脱脂奶粉封闭1 h,TBST洗 3次,加入抗 Beclin 1(Abcam,1:800)、抗 LC3(Eptimics,1:300)抗体,4℃过夜。次日加入过氧化物酶标记山羊抗兔IgG(Promega,1:5000),ECL光化学法显色,暗室中行X线胶片曝光。
1.3 MDC检测 单丹磺酰尸胺(monodan-sylcadaverine,MDC,Sigma)是一种自噬空泡的标志物,可以通过MDC染色观察判断细胞自噬过程的发生。SH-SY5Y细胞分别转染EGFP-N1、EGFP-α-synuclein (WT) 及 EGFP-α-synuclein(A53T)24 h后,以4%多聚甲醛,4℃下固定10 min,PBS洗3遍,加入终浓度为50 μmol/L的MDC染色液,在荧光倒置显微镜(Olympus IX70)下观察荧光,并在400倍视野下,各组细胞随机抽取10个不相重复的视野观察拍照。
1.4 细胞免疫荧光化学 将稳定表达蛋白的SH-SY5Y细胞转染4%多聚甲醛固定10 min,用荧光显微镜(Olympus IX70)观察并分析,并在400倍视野下,各组细胞随机抽取10个不相重复的视野观察拍照。
1.5 流式细胞仪检测细胞凋亡 SH-SY5Y细胞随机分为两组,两组细胞分别转染EGFPN1、EGFP-α-synuclein(WT)、EGFP-α-synuclein(A53T)。其中一组24 h后用0.14 g/L EDTA消化,另一组转染后12 h给予10 mmol/L自噬抑制剂3-甲基腺嘌呤(3-MA,Sigma)处理,制成单细胞悬液,调整细胞浓度为 5×105/mL,取100 μL 细胞悬液加入 5 μL Annexin-/FITC 和20 μg/mL PI溶液10 μL,孵 育 15 min,流 式 细 胞 仪 PI/Annexin-V-FITC检测细胞凋亡情况(Ex=488nm,Em=530nm)。
1.6 细胞活力测定 调节SH-SY5Y细胞密度约5×104/mL,以100 μL/孔接种至96孔板内,随机分成两组,24 h后两组细胞分别转染EGFP-N1、EGFP-α-synuclein(WT)、EGFP-α-synuclein(A53T)其中一组12 h后给予10 mmol/L3-MA处理,24 h后每孔加5 mg/mL噻唑蓝(MTT,Sigma)溶液(PBS配制,PH=7.4)20 μL,继续孵育4 h。弃上清培养基,每孔加100 μL二甲基亚砜(DMSO),选择570 nm波长测定各孔光吸收值。
2 结果
2.1 Western blot检测细胞内源性Beclin 1、LC3-Ⅱ/LC3-Ⅰ的表达 SH-SY5Y细胞过表达EGFP-N1、EGFP-α-synuclein (WT) 及 EGFP-αsynuclein(A53T),Western blot结果显示,与转染EGFP-N1组相比,过表达α-synuclein(WT)或αsynuclein(A53T)使SH-SY5Y细胞中Beclin 1蛋白的表达明显上调,差异有统计学意义(P<0.05);并且LC3-Ⅱ/LC3-Ⅰ的比值增高,差异有统计学意义(P<0.05)。与EGFP-α-synuclein(WT)相比,过表达 EGFP-α-synuclein(A53T)后 Beclin1蛋白明显上调,差异有统计学意义(P<0.05);并且LC3-Ⅱ/LC3-Ⅰ的比值增高,差异有统计学意义(P<0.05)。如图1所示。
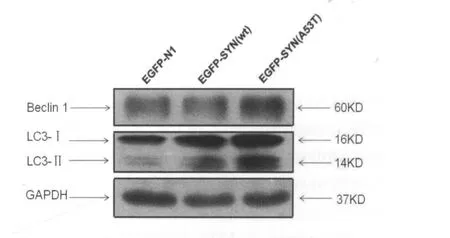
图1 Western blot检测SH-SY5Y细胞内源性Beclin 1蛋白及LC3-Ⅱ、LC3-Ⅰ蛋白的表达
表1 Western blot测定各组细胞Beclin 1蛋白表达平均灰度值及LC3-Ⅱ/LC3-Ⅰ比值()
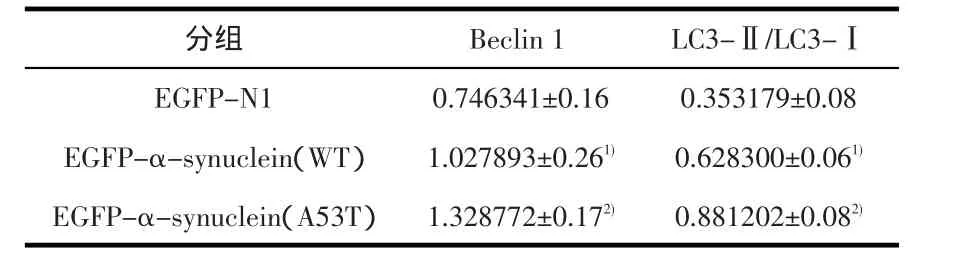
表1 Western blot测定各组细胞Beclin 1蛋白表达平均灰度值及LC3-Ⅱ/LC3-Ⅰ比值()
1)与EGFP-N1组比较,P<0.05;2)与EGFP-α-synuclein(WT)组比较P<0.05
分组EGFP-N1 EGFP-α-synuclein(WT)EGFP-α-synuclein(A53T)Beclin 10.746341±0.161.027893±0.261)1.328772±0.172)LC3-Ⅱ/LC3-Ⅰ0.353179±0.080.628300±0.061)0.881202±0.082)
2.2 MDC染色检测自噬空泡的变化 在SH-SY5Y细胞内过表达 EGFP-N1、EGFP-α-synuclein(WT)及EGFP-α-synuclein(A53T),MDC染色及统计学结果显示,自噬空泡积聚平均灰度值分别为(1.01±0.23)、(1.12±0.12)、(1.57±0.28)。与转染EGFP-N1组相比,过表 达α-synuclein(WT)及α-synuclein(A53T)致MDC染色信号增强,自噬空泡聚集增多,平均灰度值增高,差异有统计学意义(P<0.05);表明 EGFP-α-synuclein(WT)、EGFP-αsynuclein(A53T)上调了细胞自噬水平;与转染EGFP-α-synuclein(WT)相比,过表达 EGFP-αsynuclein(A53T)导致MDC染色信号增强,自噬空泡聚集增多,平均灰度值增多,差异有统计学意义(P<0.05)。如图2所示。
2.3 免疫荧光检测细胞外源性LC3蛋白的表达 在SH-SY5Y细胞内将EGFP-N1、EGFP-α-synuclein(WT)及EGFP-αsynuclein(A53T)与RFP-LC3共同转染。免疫荧光结果显示,α-synuclein与LC3存在亚细胞共定位;与EGFP-N1组相比,转染EGFP-α-synuclein(WT)或EGFP-α-synuclein(A53T)细胞胞浆内LC3蛋白表达上调;与EGFP-α-synuclein(WT)相比,过表达 EGFP-α-synuclein(A53T)细胞胞浆内LC3蛋白的表达进一步上调。如图3所示。
荧光结果显示,EGFP-α-synuclein(WT)、EGFP-α-synuclein(A53T)与mito存在共定位;与EGFP-α-synuclein(WT)相比 ,过表达EGFP-αsynuclein(A53T)可导致mito表达下调,表明过表达EGFP-α-synuclein(A53T)可致线粒体损伤。如图4所示。
2.4 PI/Annexin-V-FITC检测细胞凋亡 与转染EGFP-α-synuclein(WT)相比,过表达EGFP-αsynuclein(A53T)使细胞凋亡率上调,差异具有统计学意义(P<0.05);而在体系中加入自噬抑制剂3-MA之后,发现过表达EGFP-α-synuclein(A53T)较加入3-MA之前细胞凋亡率均有所下降,差异有统计学意义(P<0.05)。如表2所示。

图2 MDC染色检测SH-SY5Y细胞中自噬空泡的变化(400×)A1、B1、C1为过表达 EGFP-N1组 ,A2、B2、C2为过表达EGFP-α-synuclein(WT)组,A3、B3、C3为过表达EGFP-α-synuclein(A53T)组。箭头所示为自噬空泡。

图3 免疫荧光检测细胞外源性LC3蛋白表达(400×)A1、B1、C1、D1为过表达EGFP-N1组 ,A2、B2、C2、D2为 过 表 达EGFP-α-synuclein(WT)组 ,A3、B3、C3、D3为过表达EGFP-α-synuclein(A53T)组。箭头所示为RFP-LC3蛋白

图4 免疫荧光检测线粒体形态改变(400×)A1、B1、C1、D1为 过 表 达 EGFP-N1组 ,A2、B2、C2、D2为过表达EGFP-α-synuclein(WT)组 ,A3、B3、C3、D3为过表达EGFP-α-synuclein(A53T)组。
表2 PI/Annexin-V-FITC检测细胞凋亡率的变化()

表2 PI/Annexin-V-FITC检测细胞凋亡率的变化()
1)与 EGFP-N1比较,P>0.05;2)与 EGFP-α-synuclein(WT)比较,P<0.01;3)与 EGFP-N1+3-MA 比 较 ,P>0.05;4)与 EGFP-α-synuclein(WT)+3-MA比较,P<0.05;5)与 EGFP-N1比较 ,P<0.05;6)与EGFP-α-synuclein(WT)比较,P<0.05;7)与 EGFP-α-synuclein(A53T)比较,P<0.05
组别EGFP-N1 EGFP-α-synuclein(WT)EGFP-α-synuclein(A53T)EGFP-N1+3-MA EGFP-α-synuclein(WT)+3-MA EGFP-α-synuclein(A53T)+3-MA细胞凋亡率3.92±0.895.63±0.691)19.98±5.982)2.11±0.475)3.11±0.193)6)14.26±3.984)7)
2.5 MTT检测细胞活力 过表达EGFP-N1、EGFP-α-synuclein(WT)及 EGFP-α-synuclein(A53T),MTT检测细胞活力分别为(91.23±7.25)、(87.23±8.25)、(58.93±4.01)。而在体系中加入自噬抑制剂3-MA之后,MTT检测细胞活力分别为(82.01±10.27)、(77.10±7.68)、(72.26±6.03)。MTT检测结果显示,与EGFP-N1相比,EGFP-α-synuclein(WT)组细胞相对活力有所减弱,差异无统计学意义(P>0.05);与EGFP-α-synuclein(WT)相比,过表达EGFP-α-synuclein(A53T)可导致细胞相对活力减弱,差异具有统计学意义(P<0.05);加入3-MA后,过表达EGFP-α-synuclein(A53T)较加入 3-MA之前细胞相对活力增强,差异具有统计学意义(P<0.05)。
3 讨论
α-synuclein是一种伴侣蛋白,可抑制异常蛋白的聚集,促进蛋白聚积体的解聚,维护突触正常功能,调节多巴胺的生物合成[4]。目前研究发现α-synuclein可调节突触前神经末梢跨膜转运,影响多巴胺在神经末梢摄取的效率,调节小胶质细胞活性,并可保护细胞免于温度和氧化应激的影响[5]。α-synuclein(A53T)最早是1996年Polymeropoulos等[6]在对一个呈常染色体显性遗传的意大利PD家系研究中发现的。Guo等[7]在研究中发现,上调α-synuclein(A53T)的表达可削弱磷脂膜结合力,抑制囊泡单胺转运体2(vesicular monoamine transporter,VMAT2)的活力,干扰多巴胺的代谢。Lotharius等[8]在人胚胎中脑细胞MESC2.10中转染α-synuclein(A53T)发现α-synuclein(A53T)可通过降低囊泡储存释放功能,使胞质内多巴胺异常增多,影响多巴胺内环境的稳定,并发现α-synuclein(A53T)可增加合成多巴胺的细胞对氧化应激的敏感性,导致细胞氧化应激死亡。
自噬(autophagy)是细胞内的大分子营养物质和细胞器在溶酶体内降解的过程,能够满足细胞内营养和能量需求,维持能量平衡。自噬广泛存在于正常的生理过程中,又是细胞对不良环境的一种防御机制;研究证实其在神经退行性疾病中可参与异常蛋白质的降解,防止神经元内异常蛋白质的蓄积。在巨自噬形成过程中,LC3蛋白的修饰过程对自噬泡形成起着至关重要的作用,当自噬发生时,细胞内LC3的表达明显增多,且LC3-Ⅱ/LC3-Ⅰ比值明显增高[9-10]。Beclin 1是哺乳动物自噬的特异性基因[11],通过与Vps34结合激活P13K促进自噬体的形成[12],是自噬通路的必要步骤[13]。
以往的研究发现,在PD等神经变性疾病患者的脑中,存在自噬体的积聚,即自噬异常调控参与了PD等神经变性疾病的病理过程[14]。本实验过表 达 EGFP-α-synuclein(WT)及 EGFP-α-synuclein(A53T),与EGFP-N1组相比均可上调Beclin 1蛋白的表达,LC3-Ⅱ/LC3-Ⅰ比值增高。过表达EGFP-α-synuclein(A53T)与 α-synuclein(WT)组相比,Beclin 1蛋白及LC3-Ⅱ/LC3-Ⅰ比值进一步上调。以上结果证实α-synuclein(A53T)上调SHSY5Y细胞巨自噬水平。α-synuclein通过自噬转入溶酶体腔内降解,而α-synuclein(A53T)与溶酶体膜表面受体Lamp2A亲和力异常高,可阻断溶酶体摄取,从而抑制自噬底物降解,激活巨自噬途径[15]。
自噬与凋亡是两种程序性细胞死亡方式,在参与维持机体正常的生理平衡和内环境稳定中发挥着重要作用,然而近年来研究提示,二者在某些情况下可以相互拮抗或促进。以往研究中发现,TNF-α可诱导白血病细胞系CCRF-CEM发生自噬和凋亡,且自噬早于核黄素片出现,3-MA可完全抑制DNA片段化和胞浆降解,而天冬酰胺(溶酶体和自噬体融合抑制剂)不能阻断TNF-α诱导的凋亡[16],证明在某些条件下,自噬先于凋亡出现,进而启动凋亡。本研究过表达EGFP-α-synuclein(A53T)较 EGFP-α-synuclein(WT)组细胞凋亡率明显增高,细胞活力减弱。而加入自噬抑制剂后,细胞凋亡率有所减少,细胞活力有所增强。考虑可能的机制为:作为自噬的标记蛋白Beclin 1可以提高caspase-9的活性[17],进一步激活caspase-3、caspase-6、caspase-7等效应caspase,进而促进凋亡的发生。
本研究着眼于α-synuclein(A53T)对SH-SY5Y细胞自噬及凋亡的调控,并发现α-synuclein(A53T)通过上调SH-SY5Y中Beclin 1蛋白及LC3-Ⅱ/LC3-Ⅰ比值,上调自噬水平,进一步促进细胞凋亡。由此我们认为,调控自噬可能成为PD一个新的治疗方向。
[1]Spillantini MG,Schmidt ML,Lee VM,et al.Alpha-synuclein in Lewy bodies[J].Nature,1997,388(6645):839-840.
[2]张克忠.α-synuclein与帕金森病[J].中国临床神经科学,2004 ,12(4):434-437.
[3]郑海燕,王兴芬,孙保存.自噬与凋亡相互关系的分子机制探讨[J].医学综述,2011,17(1):22-24.
[4]钱进军,程言博,刘春风,等.人SNCA及其致病突变基因的逆转录病毒pEGZ/MCSHA载体的构建[J].中国临床神经科学 2006,14(6):561-565.
[5]熊中奎,胡雅儿.α-突触核蛋白的生物学功能及其在帕金森病中的作用[J].中国病理生理杂志,2010,26(9):1855-1858.
[6]Polymeropoulos MH,Lavedan C,Leroy E,et al.Mutation in the α-syn gene identified in families with Parkinson’s disease[J].Science,1997,276(5321):2045-2047.
[7]Guo JT,Chen AQ,Kong Q,et al.Inhibition of vesicular mono⁃amine transporter-2 activity in alpha-synuclein stably transfect⁃ed SH-SY5Y cells[J].Cell Mol Neurobiol,2008,28(1):35-47.
[8]Lotharius J,Barg S,Wiekop P,et al.Effect of mutant al⁃pha-synuclein of dopamine homeostasis in a new human mesen⁃cephalic cell line[J].J Biol Chem,2002,277(41):38884-38894.
[9]伍静,赵勇,师长宏,等.自噬的形态特征及分子调控[J].现代生物医学进展,2010,10(20):3941-3944.
[10]王海杰,谭玉珍.细胞自噬的形态学特征和功能意义[J].解剖学报,2009,40(5):844-849.
[11]Luo S,Rubinsztein DC.Apoptosis blocks Beclin 1-dependent autophagosome synthesis:an effect rescued by Bcl-xl[J].Cell Death Differ,2010,17(2):268-277.
[12]Meijer AJ,Codogno P.Regulation and role of autophagy in mammalian cells[J].Int J Biochem Cell Biol,2004,36(12):2445-2462.
[13]Shintani T,Klionsky DJ.Autophagy in health and disease:a double-edged sword[J].Science,2004,306(5698):990-995.
[14]Rubinsztein DC,Gestwicki JE,Murphy LO,et a1.Potential ther⁃apeutic applications of autophagy[J].Nat Rev Drug Diseov,2007,6(4):304-312.
[15]Lindersson E,Lundvig D,Petersen C,et al.p25alpha Stimu⁃lates alpha-synuclein aggregation and is co-localized with ag⁃gregation and is co-localized with aggregated alpha-synuclein in alpha-synucleinopathies[J].J Biol Chem,2005,280(7):5703-5715.
[16]Besson A,Dowdy SF,Roberts JM.CDK inhibitors:cell cycle regulators and beyond[J].Dev Cell,2008,14(2):159-169.
[17]Furuya D,Tsuji N,Yagihashi A,et a1.Beclinl augmented cis-diamminedichlo-roplatinum induced apoptosis via erdaancing caspase-9 activity[J].Exp Cell Res,2005,307(1):26-40.
