搁板温度对人血小板冻干保存的影响
2013-11-22徐梦洁许先国张绍志陈光明
王 波, 周 正, 徐梦洁, 许先国, 张绍志, 陈光明
(1.解放军第117医院 危重病医学科,杭州 310013;2.浙江大学 能源工程学系,杭州 310027;3.浙江省血液中心 输血研究所,杭州 310006)
血小板输注在临床治疗上有重要应用,然而,现有的血小板保存方法都存在很大的局限性,冷冻干燥将为血小板的长期保存提供一种较为理想的方法,相关研究近年来在国内外都得到了重视.影响冻干血小板复水后恢复率和功能的因素有很多,如保护剂 种 类 和 浓 度[1-3]、冻 结 速 率[4]、复 水 条 件[5]等.冻干过程的其它工艺参数,如温度、压力和干燥持续时间,可能对血小板冻干的效果也有影响,但目前研究还很少.其中,一次干燥温度是一个十分重要的参数,该温度过高可能导致物料出现塌陷.但一次干燥温度也不能过低,有文献指出,该温度每降低1 ℃,升华干燥时间将增加13%[6].干燥时间的延长,不仅影响生产效率,而且可能影响冻干效果.本文作者曾在-38~-40 ℃的搁板温度下进行过1mL 血小板悬浮液的冻干,效果较好,但由于一次干燥温度位低,干燥持续时间长达16~18h.如果增加血小板的容量,或加厚冻干瓶内装液的高度,持续时间会更长.为了缩短一次干燥时间,本文将尝试采用比-38 ℃高的搁板温度进行血小板的一次干燥,根据冻干血小板复水后的数值恢复率、凋亡及活化情况,来寻找更加合适的一次干燥参数.
1 材料和方法
1.1 血小板洗涤
新鲜浓缩血小板(1.0×109~1.5×109血小板/mL)来自健康无偿献血者,由浙江省血液中心提供.将富含血小板的血浆离心15 min,使血小板沉淀并去除上层血浆;而后加适量生理盐水,将血小板打散使之悬浮;之后再离心10min,收集血小板,重复此操作两次.
1.2 海藻糖载入血小板
用 含 有 50 mmol/L 海 藻 糖 的 缓 冲 液(100mmol/L NaCl、10mmol/L KCl和10mmol/L EGTA)将洗涤后的血小板重悬,制成浓度约为1×109个/mL 的孵化悬浮液;将上述处理后的血小板孵化悬浮液置于37℃的恒温震荡水浴中孵化,震荡频率为40次/min,得到的血小板内海藻糖浓度达到约13mmol/L[7].
1.3 血小板的冷冻干燥
冻干保护液的基准缓冲液(PBS 缓冲液)由9.5mmol/L HEPES、 142.5mmol/L NaCl、4.8mmol/L KCl及1mmol/L MgCl2组成.以上述冻干缓冲液作为基准液,加入1%牛血清白蛋白(BSA,上海生工)作为塑性剂,加入20%海藻糖(C10H22O11·2H2O,北京经科宏达生物技术有限公司)作为细胞外保护剂,浓度百分比以w/v(g/100mL)表示,配置成血小板冻干保护液.将已载入海藻糖的血小板洗涤后重悬于该冻干保护液中,调整细胞悬浮液浓度为1×109个/mL左右.
取1mL血小板冻干悬浮液装入直径为25mm的玻璃瓶中,放入-60 ℃低温冰箱中进行预冻,其冷却速率约为10 ℃/min[8].维持2h之后,迅速取出冻结的血小板样品,置于预先冷却至一次干燥温度的FreeZone12plus型冻干机(LabConco,美国)冻干箱内隔板上,进入预先设定好的程序,一次干燥时间为20h.一次干燥结束后以0.2 ℃/min的加热速率使搁板温度升至二次干燥温度20℃,二次干燥时间为10h.一次干燥参数见表1.

表1 血小板一次干燥温度参数Tab.1 Primary drying temperatures of platelet lyophilization ℃
1.4 冻干血小板复水
将PBS缓冲液和蒸馏水以3:1 比例混合制成血小板冻干复水液,将1 mL 的复水液在室温下直接加入冻干样品瓶中,轻轻震荡,样品迅速完全溶解于复水溶液中.
1.5 冻干复水血小板血液学分析
用CELL-DYN1700型血球计数仪(Abbott,美国)分别对冻干前的血小板和冻干复水后的血小板计数,血小板冻干保存的数值恢复率(RP)的计算公式为

式中,Na表示冻干复水后的血小板计数;Nb表示冻干前的血小板计数.
利用血球计数仪测定复水后的血小板平均体积(MPV)以及分布宽度(PDW),得到PDW 曲线.
1.6 冻干复水血小板活化的三色流式分析
1.6.1 冻干复水血小板凋亡检测
本实验以1mL新鲜富含血小板血浆(PRP)为阴性对照,1mL冻干后的血小板为实验样品,采用流式细胞仪FACSCalibur(BD,美国)进行检测,步骤如下:
a.样本制备.实验组和对照组的血小板悬液样品离心3min(1 500转/min),用0.5mL 结合缓冲液(Binding Buffer)重悬.
b.荧光染色.取10μL该溶液加入流式专用管(BD,美国),再依次向管中加入10μL PI染色剂和5μL Annexin V-FITC试剂,添加试剂后的BD 管室温避光15 min进行染色.
c.避光染色后的BD 管中加入500μL生理盐水稀释,1 h之内上机检测.
d.数据结果使用CellQuest软件进行分析.
1.6.2 冻干复水血小板活化检测
本实验以1mL新鲜富含血小板血浆(PRP)为阴性对照,1 mL 核苷酸(ADP)处理后的活化血小板为阳性对照,1mL 冻干后的血小板为实验样品,采用流式细胞仪进行检测,步骤如下:
a.样本制备.实验组和对照组的血小板悬液样品离心3min(1 500转/min),用0.5mL 结合缓冲液(Binding Buffer)重悬.
b.荧光染色.取10μL 该溶液加入流式专用管,再依次向管中加入7.5μL CD62p-PE和PAC-1 FITC,添加试剂后的BD 管室温避光15 min 进行染色.
c.避光染色后的BD 管中加入500μL生理盐水稀释,1 h之内上机检测.
d.数据结果使用CellQuest软件进行分析.
1.7 统计分析
实验结果以5次独立实验的平均值±标准差表示,组间统计显著性差异P 用异方差假设t检验进行比较.
2 结 果
2.1 一次干燥温度位对血小板数值恢复率的影响
将密封保存于室温下的冻干血小板复水,7 种不同温度位下的血小板冻干复水后的数值恢复率分别为(60.4±8.0)%a,b,(80.8±3.9)%b,c,(84.1±4.4)%c,d,(89.0±3.2)%a,d,e,(89.5±2.1)%,(89.6±1.6)%,(89.9±1.4)%e,如图1所示.(注:a:P=0.000;b:P=0.001;c:P=0.233;d:P=0.365;e:P=0.572)
结果表明,冻干复水后的血小板数值恢复率随着温度的降低而增加,到达-30 ℃时基本不变,达到89%左右.随着干燥温度的上升,冻干复水后血小板恢复率迅速下降,达到-20 ℃时下降至61%.
2.2 一次干燥温度位对血小板形态分布的影响
表2表示血小板的MPV和PDW 值随一次干燥温度的变化关系.
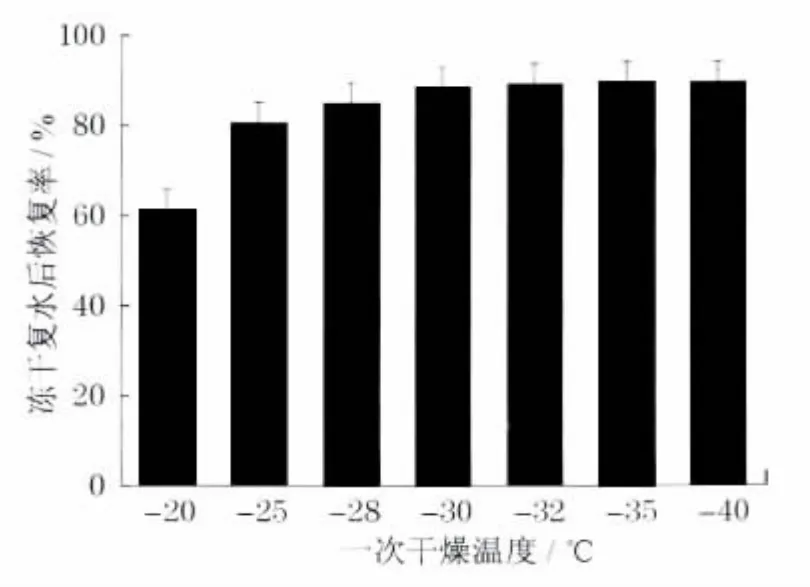
图1 冻干复水后血小板的数值恢复率(n=5)Fig.1 Numerical recovery rate of platelets after freezedrying and rehydration(n=5)

表2 冻干前后血小板的MPV 和PDW(n=5)Tab.2 MPV and PDW of platelets before and after lyophilization(n=5)
实验结果表明,不论一次干燥温度的取值为多少,血小板冻干复水后的MPV 和PDW 值均较复水前偏大,一部分实验组的值甚至超过了人体血小板的正常标准参考值,说明血小板冻干和复水过程对其形态和体积分布影响较大.
2.3 冻干血小板凋亡标志物的表达
使用流式细胞仪对-30℃作为一次干燥温度的冻干血小板进行凋亡检测,检测结果用CellQuest软件进行分析,结果如图2(见下页)所示.首先根据血小板大小和颗粒性在前向角/测向角散射光(FSC/SSC)中设门R2(图2(a)中横坐标和纵坐标分别代表前向角与测向角散射光信号强度).由于CD61能与血小板细胞特异性结合,对R2区域中的细胞,在图2(b)中标志CD61-PerCP为阳性的细胞设门R1(图2(b)中横坐标表示PerCP 荧光信号强度),区分血小板细胞和其它碎片及污染物,对R1区域中的血小板进行凋亡和活化分析.

图2 流式细胞术(FCM)检测冻干复水后的血小板凋亡率Fig.2 Apoptosis rate of platelets detected by FCM
AnnexinV-FITC能与细胞膜上凋亡早期的标志物磷脂酰丝氨酸结合呈阳性,PI染色剂能进入细胞膜被破坏的细胞中,与染色体结合呈阳性.根据新鲜血小板将图2(c)分为4个象限,左下象限为非活化的存活血小板,右下象限为早期凋亡的血小板,左上和右上象限PI染色呈阳性,表示晚期凋亡或死亡的血小板.图2(c),(d)中横坐标与纵坐标分别表示FITC与PI荧光信号强度.
结果表明,实验组和对照组的活细胞数均占血小板总数的85%以上,但是冻干复水后血小板的细胞凋亡率显著高于新鲜血小板的自然凋亡率.详细数据参见表3.

表3 Annexin V/PI荧光标记法检测血小板的凋亡(n=5)Tab.3 Apoptosis rate of rehydrated platelets detected by Annexin V/PI fluorescent mark method(n=5)
2.4 冻干血小板活化标志物的表达
PAC-1-FITC和CD62P-PE分别为血小板表面活化早期标志物和活化晚期的标志物.根据新鲜血小板阴性对照同样将图3(a)分为4个象限,左下象限为非活化血小板,右下象限为活化早期血小板,右上象限为活化晚期血小板.利用流式细胞术(FCM)检测血小板 活 化 标 志 物PAC-1 和CD62p 的 表 达,图3 为CellQuest分析结果,图中横坐标和纵坐标分别表示FITC和PE荧光信号强度.最终详细数据参见表4.

表4 PAC-1/CD62p荧光标记法检测血小板的活化(n=5)Tab.4 Activation rate of rehydrated platelets detected by PAC-1/CD62p fluorescent mark method(n=5)

图3 FCM 检测冻干复水后的血小板活化率Fig.3 Activation of rate platelets detected by FCM
3 讨 论
冷冻干燥法保存血小板可以大大延长血小板的保存期限,并且具有轻便易带、复水后可以直接使用等优点,近年来成为血小板保存技术研究的热点[9].目前国内关于血小板冷冻干燥保存的研究主要是针对保护剂配方优化而进行的.周新丽等研究了海藻糖作为细胞内外保护剂的冻干配方问题[7].曹伟等研究了乙醛前处理和海藻糖载入血小板的问题[10],刘景汉等研究了海藻糖加载技术和测定方法[8].优化冻干参数方面的研究目前仍很少,虽然已有学者对冷冻速率、退火等预冻过程中的操作参数进行了一定的研究,但是对于干燥过程的参数几乎无涉及,尤其是一次干燥温度的选取.在食品、药品和微生物冷冻干燥领域,有学者认为物料的温度在整个冻干过程必须始终低于其部分玻璃化转变温度Tg’[11-12],也就是说一次干燥的温度必须低于Tg’.另有学者认为,结晶型系统的一次干燥温度要低于物料的共晶温度Te,无定形系统的一次干燥温度要低于物料的Tg’[13-16].对于无定形系统,Tang 等还提供了另外一种观点,他们根据一种蛋白质的冻干试验结果,指出一次干燥温度高于Tg’也是可行的[17].
血小板冻干样品的临界温度与许多因素相关,包括预冻的进程、保护剂种类和浓度等.因此,可以通过实验的方法选择合适的一次干燥温度,一方面提高血小板冻干复水后的恢复率和功能,另一方面加快干燥过程的进程.
由上述实验结果可以看出,经过预冻的血小板保存液在-30℃左右的数值恢复率达到较满意的水平(>85%),即使温度下降到-40 ℃,恢复率提高的也并不多,但是相应的水蒸气升华驱动力却从12.9Pa提高到了38.0Pa[13],大大加快了干燥进程.虽然冻干血小板保存液的玻璃化转变温度为-34.3 ℃,但是经过冻结形成的血小板并不是完全的无定形系统,干燥过程中的临界温度也不再是其相应的玻璃化转变温度了.实验结果表明,略微提高干燥温度,并不会对样品的存活率产生很大的影响.但是,当温度上升到-25 ℃甚至-20 ℃时,会对血小板冻干后的存活率产生极大的影响,存活率明显下降,这说明温度高到已使冻结样品产生了融化现象.
对于一次干燥温度为-30 ℃以下的实验组,测得的冻干后血小板MPV 值都在正常参考范围内.但是-30 ℃和-32 ℃组比较接近正常范围的上限,血小板的体积在冻干后有明显的变大趋势.当干燥温度高于-30 ℃后,冻干后血小板的MPV 值则均偏离了正常范围,比12.5fL 的上限要大出许多.针对血小板分布宽度PDW,只有-40℃实验组的冻干后血小板在正常的15.5~18.1fL范围内,但是也比较接近正常范围的上限18.1fL,这说明冻干后血小板体积变异较明显,虽然其数值恢复率达到了90%左右,但是血小板细胞由于冻干而产生了明显的肿胀现象,血小板的功能可能会出现一定的损失.
经过冻干后的血小板绝大部分集中于Annexin V 阴性和PI阴性区,说明绝大多数的细胞仍然为活细胞,且结果与之前使用血球计数仪得到的结果相差不大(89.0%).早期凋亡的细胞约占所有血小板细胞的7.8%,说明冻干和复水过程对血小板存在影响,使得存在于细胞膜磷脂双分子层中的PS外翻暴露于细胞膜外层,细胞进入凋亡早期阶段.PI阳性的血小板细胞占总数的4.7%,这说明部分血小板的细胞膜已经破裂,这些血小板在复水后将完全失去其原有的功能.但是,总体而言,-30 ℃作为一次干燥温度,细胞的凋亡率比较低,仍在临床检验可接受范围之内.
-30 ℃冻干后的血小板复水后非活化率可以达到80%左右,说明约有20%的冻干后血小板失去了活性.荧光标记的CD62p(这里使用PE 作为荧光素)抗体阳性表达的血小板百分率可反映血小板活化程度[18].有人研究发现,保存血小板CD62p阳性率与血小板体内存活率及存活期呈负相关[19].这表明,-30 ℃作为一次干燥温度保存的血小板虽然数值恢复率较高,达到了89%,但是,输注后的止血效果和存活时间可能会受到影响.刘景汉等人认为,CD62p的表达率较高,血小板在输注入体内后,不能很好地满足提高外周血血小板数目的临床需求,但仍然具有较好的聚集活性和促凝血活性,可以作为临时血小板代替品进行输注[8].他们认为,加入适量的可逆性血小板功能抑制剂可以有效地抑制血小板的体外活化,并且抑制作用是可逆的,保证了在输入体内后具有原有的黏附、释放、聚集等功能,并且具有一定的存活时间[20].
[1]曹伟,王艳,靳鹏,等.冷冻干燥血小板保存技术研究[J].中国实验血液学杂志,2005,13(5):883-888.
[2]周新丽,刘宝林,张绍志,等.糖的浓度和种类对人血小板冷冻干燥保存的影响[J].上海理工大学学报,2007,29(6):534-538.
[3]Zhou X L,Zhu H,Zhang S Z,et al.Freeze-drying of human platelets:influence of intracellular trehalose and extracellular protectants[J].Cryo-Letters,2006,27(1):43-50.
[4]周新丽,祝宏,张绍志,等.冻结速率对血小板冷冻干燥保存的影响[J].细胞生物学杂志,2006,28(3):481-485.
[5]Fan J L,Xu X G,Zhang S Z,et al.Experimental study on rehydration conditions of freeze-dried platelets[J].Journal of Zhejiang University:Science A,2009,10(5):697-703.
[6]Pikal M J.Use of laboratory data in freeze drying process design:heat and mass transfer coefficients and the computer simulation of freeze drying[J].Journal of Parenteral Science and Technology,1985,39(3):115-139.
[7]周新丽,张绍志,陈光明.人血小板的冷冻干燥保存:细胞内外保护剂的作用[J].制冷学报,2008,29(2):33-37.
[8]周俊,刘景汉,欧阳锡林,等.血小板胞内海藻糖测定方法的建立和评价[J].中国实验血液学杂志,2004,12(6):837-840.
[9]刘景汉,周俊,王冬梅,等.冷冻干燥保存血小板的实验研 究[J].中 国 实 验 血 液 学 杂 志,2007,15(5):1098-1101.
[10]曹伟,王艳,靳鹏,等.冷冻干燥血小板保存技术研究[J].中国实验血液学杂志,2005,13(5):883-888.
[11]刘占杰,华泽钊,陈建明,等.药品冷冻干燥过程中的玻璃化作用[J].中国医药工业杂志,2000,31(8):380-383.
[12]Hancock B C,Shambli S L,Zografi G.Molecular mobility of amorphous pharmaceutical solids below their glass transition temperatures[J].Pharmaceutical Research,1995,12(6):799-806.
[13]华泽钊.冷 冻 干 燥 新 技 术[M].上 海:科 学 出 版社,2006.
[14]Patel S M,Doen T,Pikal M J.Determination of end point of primary drying in freeze-drying process control[J].AAPS PharmSciTech,2010,11(1):73-84.
[15]毕殿洲.药剂学[M].北京:人民卫生出版社,1999.
[16]李华,骆艳娥,刘延琳.真空冷冻干燥微生物的研究进展[J].微生物学通报,2002,29(3):78-82.
[17]Tang X L,Pikal M J.Design of freeze-drying processes for pharmaceuticals:practical advice[J].Pharmaceutical Research,2004,21(2):191-200.
[18]彭黎明,杨菁.血小板功能检测及其应用的研究进展[J].中国实验诊断学,2001,5(5):214-217.
[19]Holme S,Sweeney J D,Sawyer S.The expression of pselectin during collection,processing,and storage of platelet concentrates:relationship to loss of in vivo viability[J].Transfusion,1997,37(1):12-17.
[20]王冬梅,刘景汉,周俊,等.腺苷对血小板体外激活的抑制作用[J].中国实验血液学杂志,2005,13(6):1094-109.
