KPC1和胞质p27Kip1在上皮性卵巢癌中的表达及临床意义
2013-11-22吴爱民韩云陈燕周红
吴爱民,韩云,陈燕,周红
(南通市第一人民医院妇产科,江苏南通226001)
卵巢癌是妇科最常见的恶性肿瘤之一,发病率仅次于宫颈癌和子宫内膜癌,但死亡率却超过了后两者之和,严重威胁女性的健康。p27Kip1是细胞周期蛋白依赖性激酶(CDK)抑制蛋白之一,在细胞核中能够与细胞周期蛋白E-CDK2结合,发挥阻滞细胞周期的作用[1],作用于包括卵巢癌在内的多种肿瘤细胞[2]。已有研究显示,胞质中的p27Kip1与卵巢癌的不良预后相关[3]。Kip1泛素-促进复合体 1(Kip1 ubiquitination-promoting complex,KPC1)是一种E3泛素酶复合体亚基之一,能够降解从胞核转运至胞质中的 p27Kip1[4]。
本研究拟采用免疫组织化学法检测卵巢癌组织中KPC1和胞质p27Kip1的表达情况,并分析其表达与患者临床病理因素之间的关系。
1 材料和方法
1.1 组织标本
收集2008年1月至2011年12月于我院妇产科行手术切除,经病理证实、甲醛固定、石蜡包埋的卵巢癌切片标本64例;患者年龄32~77岁(平均61岁),术前均未做任何辅助性治疗。病理资料如下:高分化14例,中分化31例,低分化19例;浆液性癌36例,黏液性癌14例,子宫内膜样腺癌8例,透明细胞癌6例;发生转移40例,未发生转移24例;有腹腔积液21例,无腹腔积液43例。
1.2 抗体
兔抗人p27Kip1多克隆抗体购自 Santa Cruz公司,鼠抗人KPC1单克隆抗体购自Abcam公司,二抗及DAB显色试剂盒购自Dako公司。
1.3 免疫组织化学分析
病理组织切片置于60℃烤箱烘烤6~8 h,然后经二甲苯脱蜡、梯度乙醇(浓度由高到低)水化后,高压锅柠檬酸盐(pH=6.0)修复抗原。室温孵育一抗(KPC1,1 ∶100;p27Kip1,1 ∶500)2 h,洗涤。室温孵育二抗30 min,DAB显色液显色5 min,自来水冲洗终止反应。苏木素复染细胞核,盐酸乙醇脱色。梯度乙醇(浓度由低到高)脱水、二甲苯透明、中性树胶封片。用PBS代替一抗作为阴性对照。
1.4 免疫组织化学评分
采用Leica正置显微镜拍摄。切片阳性表现为细胞核和(或)细胞质出现棕黄色颗粒,阴性对照则无棕黄色反应物出现,仅仅细胞核染成蓝紫色。所有切片评价由笔者和两位未知患者资料的病理专家独立进行,三者评价综合考虑作为该切片的染色分级。
KPC1阳性表现为广泛胞质着色。根据切片的染色深度分为不同的等级:0,无着色;1,轻度着色;2,中度着色;3,重度着色。0和1为低表达,2和3为高表达。计数方法:每张切片选取5个有代表性的高倍镜视野(400×),向同一个方向移动切片,不重复,不重叠。
p27Kip1阳性表现为细胞核和(或)细胞质出现棕黄色颗粒。评分按照阴性、核染和质染3种计算。胞质和胞核染色分开评分,不叠加。计数方法:每张切片选取5个有代表性的高倍镜视野(400×),向同一个方向移动切片,不重复,不重叠,每个视野随机计数300个肿瘤细胞,共计算1 500个肿瘤细胞内的阳性细胞百分率。阴性定义为胞质不着色,阳性核<5%;胞质染色分级同KPC1;当染色出现在胞核而不在胞质时,切片定义为“仅仅核染”。核染色定义 >5%为高表达,<5%为低表达。
1.4 统计学处理
采用SPSS 15.0统计软件,数据采用 Pearson χ2检验,检验水准为α=0.05。采用Spearman相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 卵巢癌组织中KPC1和胞质p27Kip1的表达
免疫组织化学结果显示,KPC1呈胞质定位,低分化组织内可见密集棕黄色颗粒,呈强阳性表达;中分化组织内可见较多棕黄色颗粒,KPC1呈中等阳性表达;高分化组织内可见弥散分布的棕黄色颗粒,KPC1呈弱阳性表达。p27Kip1散在分布于组织切片内,呈胞核和(或)胞质定位,高分化组织中p27Kip1主要是胞核着色,胞质少见着色,而低分化组织中明显见到胞质着色。从不同组织病理类型来看,p27Kip1和KPC1在浆液性癌、黏液性癌及子宫内膜样癌中表达明显,而在透明细胞癌中几乎无表达。见图1和图2。
2.2 KPC1及胞质p27Kip1的表达与临床病理因素的相关性
如表1所示,KPC1表达与FIGO分期、肿瘤分化程度、病理类型、转移情况相关(P均<0.05),而与年龄、肿瘤残灶、腹腔积液等无相关性(P均>0.05)。胞质p27Kip1的表达与患者的FIGO分期、肿瘤分化程度、病理类型相关(P均<0.05),而与年龄、转移情况、肿瘤残灶、腹腔积液等无相关性(P>均0.05)。
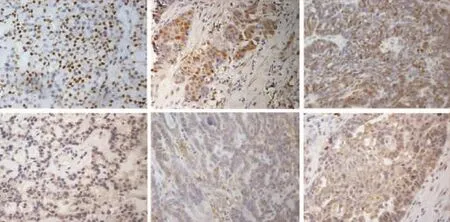
图1 KPC1和p27Kip1在不同分化癌组织中的表达(400×)Fig 1 The expressions of KPC1 and p27Kip1in various differentiated neoplasm

图2 免疫组织化学检测KPC1和p27Kip1在上皮性卵巢癌组织中的表达(400×)Fig 2 Immunohistochemical analysis of KPC1 and p27Kip1expression in epithelial ovarian cancer

表1 KPC1和胞质p27Kip1的表达与上皮性卵巢癌临床病理参数间的关系Tab 1 The relationship between the expression of KPC1 and cytoplasmic p27Kip1 and the clinical pathological parameters of epithelial ovarian cancer
2.3 KPC1与胞质p27Kip1的相关性
KPC1和胞质 p27Kip1属于等级资料,采用Spearman相关分析显示,KPC1与胞质p27Kip1表达呈正相关(r=0.493,P <0.01)。
3 讨论
细胞周期紊乱是癌症进程中的首要事件。p27Kip1作为一种CDK抑制蛋白,能够阻滞细胞从G1期进入S期[1],并且其表达丢失与各种肿瘤的进程有密切关系。p27Kip1转运至胞核外往往失去了周期抑制作用。在卵巢癌中,胞质亚细胞定位的p27Kip1在浆液组织中表达多于黏液组织。多因素生存分析显示,胞质p27Kip1而不是胞核p27Kip1,是独立的预后指标[3]。本研究检测了不同病理标本中p27Kip1的表达,结果显示,胞质p27Kip1在低分化组织中的表达较高分化组织高,其表达与肿瘤分化程度相关(P<0.05),与之前的研究结果一致[5]。
本研究结果表明,KPC1在卵巢癌细胞质中表达,肿瘤分化程度越低其表达深度越强。病理因素分析结果显示,KPC1与FIGO分期、肿瘤病理类型等因素有关(P均<0.01)。此外,Spearman相关性分析结果显示,KPC1与胞质p27Kip1表达呈正相关(r=0.493,P <0.01)。上述结果提示,KPC1 与胞质中p27Kip1呈共表达。当细胞处于G1期时,有丝分裂信号刺激p27Kip1Ser10磷酸化,然后借助Jab1/CRM1由核内转运至胞质[6-7];进而被一种未确定的E3泛素酶复合物泛素化,经由蛋白酶体降解。而在S期和G2期,胞核中周期蛋白 E-CDK2刺激p27Kip1Thr187磷酸化,SCFskp2使其泛素化,最后由蛋白酶体降解[8]。Kamura 等[4]发现,E3 复合体命名为Kip1泛素-促进复合体,由KPC1和KPC2两个亚基组成。KPC1是催化亚基,其羧基端环指结构域能够与胞质 p27Kip1相互作用,促进 p27Kip1泛素化[9]。KPC2发挥衔接蛋白的作用,参与p27Kip1多聚泛素化与26S蛋白酶体的传递[10]。机体内 p27Kip1的 mRNA表达在增殖细胞的整个细胞周期是恒定的,基于翻译后修饰的调节作用,其蛋白水平因所处周期的不同而不同。分化程度越高,胞核内Ser10发生磷酸化的p27Kip1表达越多,致使其出核转运增加,进而引起胞质中p27Kip1表达增加。胞质中p27Kip1在Tyr74和Tyr78发生磷酸化后重新进入胞核,而KPC1促进胞质p27Kip1泛素化降解,负反馈抑制入核,扰乱了出入核平衡,从而促进了肿瘤细胞异常增殖。
本研究综合考查了胞质p27Kip1与其降解蛋白KPC1的表达关系。研究结果提示,二者共表达的上皮性卵巢癌组织的分化程度差,病情严重。
[1] Sgambato A,Cittadini A,Faraglia B,et al.Multiple functions of p27Kip1and its alterations in tumor cells:a review[J].J Cell Physiol,2000,183(1):18 -27.
[2] Radu M,Soprano DR,Soprano KJ.S10 phosphorylation of p27 mediates atRA induced growth arrest in ovarian carcinoma cell lines[J].J Cell Physiol,2008,217(2):558-568.
[3] Duncan TJ,Al-Attar A,Rolland P,et al.Cytoplasmic p27 expression is an independent prognostic factor in ovarian cancer[J].Int J Gynecol Pathol,2010,29(1):8-18.
[4] Kamura T,Hara T,Matsumoto M,et al.Cytoplasmic ubiquitin ligase KPC regulates proteolysis of p27Kip1at G1 phase[J].Nat Cell Biol,2004,6(12):1229 -1235.
[5] Kruck S,Merseburger AS,Hennenlotter J,et al.High cytoplasmic expression of p27Kip1is associated with a worse cancer-specific survival in clear cell renal cell carcinoma[J].BJU Int,2012,109(10):1565 -1570.
[6] Pan Y,Zhang Q,Tian L,et al.Jab1/CSN5 negatively regulates p27 and plays a role in the pathogenesis of nasopharyngeal carcinoma[J].Cancer Res,2012,72(7):1890-1900.
[7] Connor MK,Kotchetkov R,Cariou S,et al.CRM1/Ran-mediated nuclear export of p27Kip1involves a nuclear export signal and links p27 export and proteolysis[J].Mol Biol Cell,2003,14(1):201 -213.
[8] Iwahori S,Murata T,Kudoh A,et al.Phosphorylation of p27Kip1by Epstein-Barr virus protein kinase induces its degradation through SCFSkp2ubiquitin ligase actions during viral lytic replication[J].J Biol Chem,2009,284(28):18923-18931.
[9] Lu Y,Adegoke OA,Nepveu A,et al.USP19 deubiquitinating enzyme supports cell proliferation by stabilizing KPC1,a ubiquitin ligase for p27Kip1[J].Mol Cell Biol,2009,29(2):547 -558.
[10] Hara T,Kamura T,Kotoshiba S,et al.Role of the UBL-UBA protein KPC2 in degradation of p27 at G1 phase of the cell cycle[J].Mol Cell Biol,2005,25(21):9292-9303.
