幽门螺杆菌cag1基因缺陷株的构建与鉴定
2013-11-22凌峰王晓春陈珵余敏朱虹罗彩凤邵世和
凌峰,王晓春,陈珵,余敏,朱虹,罗彩凤,邵世和
(1.江苏大学基础医学与医学技术学院,江苏镇江212013;2.昆山市中医医院检验科,江苏苏州215300;3.江苏大学临床医学院,江苏镇江212013)
幽门螺杆菌(Helicobacter pylori,H.pylori)为人类胃部常见致病菌之一,其感染在世界范围内流行。H.pylori感染与多种胃肠道疾病的发生密切相关,如胃炎、消化性溃疡、胃癌和胃黏膜相关淋巴样组织淋巴瘤[1]。高致病性H.pylori存在一个细胞毒素相关基因致病岛(cytotoxin associated gene pathogenicity island,cag PAI)结构,编码重要的 H.pylori相关毒力蛋白和1种Ⅳ型分泌系统[2]。该Ⅳ型分泌系统中的部分蛋白与根癌农杆菌 (Agrobacterium tumefaciens,A.tumefaciens)的经典Ⅳ型分泌系统——VirB/D4系统存在同源性[3]。目前仍有许多cag PAI基因编码蛋白仅存在于H.pylori中,且功能未知,cag1基因即为其中之一。
本研究以cag PAI首个编码基因cag1作为研究对象,拟用同源重组技术构建cag1基因缺陷的自杀质粒;通过电击转化细菌,抗性筛选出cag1基因缺陷株,并将其破坏GES-1细胞的能力与野生株进行比较。
1 材料与方法
1.1 材料
1.1.1 菌株、细胞株与质粒 H.pylori NCTC11637由中国疾病预防控制中心传染病研究所张建中教授馈赠,人胃上皮GES-1细胞由江苏大学周天戟教授馈赠,H.pylori自杀质粒pBluescript SKⅡ(-)载体由韩国国立庆尚大学微生物学教研室Seung-chul Baik教授馈赠。大肠埃希菌(E.coli)DH5α由江苏大学基础医学与医学技术学院实验室保存。
1.1.2 主要试剂 哥伦比亚培养基、微需氧袋、胰蛋白胨、酵母提取物购自Oxoid公司;小牛血清购自杭州四季青生物工程材料生物公司;三羟甲基氨基甲烷(Tris)、SDS购自国药集团化学试剂有限公司;平衡酚、RNA酶购自Generay生物公司;1 000 bp DNA标准参照物、限制性核酸内切酶EcoR I、BamH I、Kpn I、Xho I购自 Thermo公司;DL2000 DNA 标准参照物、Taq DNA聚合酶、dNTP、T4DNA连接酶、胶回收试剂盒购自TaKaRa公司;引物由上海英潍捷基生物工程有限公司合成。
1.1.3 主要仪器 核酸检测仪(Eppendorf公司);基因扩增仪(Applied Biosystems公司);凝胶成像系统(Syngene公司);高速冷冻离心机(Heraeus公司);恒温水箱(上海医疗器械公司);摇床(上海福玛实验设备有限公司);电穿孔仪(Bio-Rad公司);电泳仪(南京驰顺科技有限公司);CO2细胞培养箱(Thermo公司);倒置生物显微镜系统(Nikon公司)。
1.2 方法
1.2.1 cag1基因两侧同源臂的扩增 根据基因库中的H.pylori全基因组序列,设计cag1基因上游和下游同源臂序列F1、F2的引物(表1),cag1基因全长348 bp,引物P1/P2用于扩增F1,引物P3/P4用于扩增F2。以H.pylori NCTC11637基因组DNA为模板,进行PCR扩增。扩增条件:95℃ 5 min,95℃30 s,50 ℃ 30 s,72 ℃ 60 s,35 个循环,72 ℃10 min;PCR产物经2%琼脂糖凝胶电泳,EB染色后通过凝胶电泳图像分析系统分析鉴定,使用胶回收试剂盒回收产物,-20℃保存。

表1 引物序列Tab 1 Sequence of primers
1.2.2 自杀质粒 pBluescript/Δcag1 ∶∶Kmr的构建
胶回收上下游同源臂片段与pMD-18T载体,通过T4DNA连接酶4℃连接16 h。将连接后的混合物,通过热击转化入 E.coli DH5α,然后涂布于含100 μg/mL氨苄西林的LB固体培养基,37℃培养12 h。长出阳性菌落后,挑下继续接种于含100 μg/mL氨苄西林的LB液体培养基内,37℃振摇过夜,按照分子克隆指南中碱裂解法抽提细菌质粒,并进行酶切鉴定。胶回收上下游同源臂F1与F2,酶切两个片段与含卡那霉素抗性(Kmr)片段的pBluescript载体,分步进行连接,连接产物转化至E.coli DH5α感受态细胞,转化后涂布于含50 μg/mLKmr的LB平板上,37℃培养12 h,挑取单个菌落接种于含50 μg/mLKmr的LB液体培养基,37℃振摇过夜后抽提质粒,进行酶切鉴定,构建自杀质粒pBluescript/Δcag 1 ∶∶Kmr。
1.2.3 cag1基因缺陷株的构建 H.pylori NCTC11637在哥伦比亚固体培养基上培养72 h后,刮取细菌至1 mL 10%蔗糖与甘油的混合溶液,4℃ 5 000 r/min离心10 min(重复3次);沉淀重悬于100 μL 10%蔗糖甘油混合溶液中,4℃或冰上孵育10~15 min;加自杀质粒约25 μg,4℃或冰上再次孵育5~10 min;移入冰预冷的0.2 cm规格大小的电击杯,准备点击转化。将电击杯放入电击仪器上的正确位置,确保正负极连接正确,将仪器工作条件设为25 F,2.5 kV,200 Ω,电击5 s后,立即将电击杯中的液体全部均匀涂布于含12.5 μg/mL卡那霉素的哥伦比亚平板上,37℃微需氧培养72 h。
收集培养细菌后进行尿素酶以及细菌革兰染色鉴定,提取基因组DNA进行PCR鉴定。以上游同源臂F1的上游引物P1和下游同源臂F2的下游引物P4,进行 PCR扩增。反应条件:94℃ 5 min,94 ℃ 30 s,50 ℃ 30 s,72 ℃ 60 s,35个循环,72 ℃10 min,以野生株作为PCR扩增对照。扩增结果送上海英潍捷基生物工程公司测序。鉴定无误后,证明突变株构建成功,将其命名为Δcag1。
1.2.4 胃上皮 GES-1细胞与 H.pylori野生株及cag1基因缺陷株共培养 胃上皮GES-1细胞按照常规方法培养2 d,H.pylori野生株和缺陷株Δcag1按照微需氧方法培养3 d,然后按照MOI=300∶1的比例,于细胞中加入细菌,培养8 h。倒置显微镜观察细胞形态。
2 结果
2.1 cag1基因两侧同源臂的制备
以H.pylori NCTC11637基因组DNA为模板,引物P1/P2、P3/P4分别用于扩增上游同源臂F1(598 bp)和下游同源臂F2(737 bp)。扩增产物见图1。
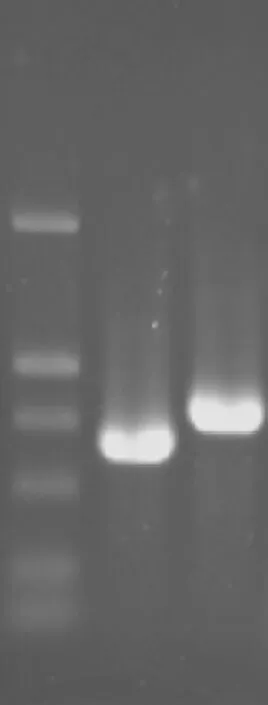
图1 cag1基因上下游同源臂PCR产物Fig 1 PCR amplification of F1 and F2 fragments of cag1 gene
2.2 cag1基因缺陷自杀质粒的构建与酶切鉴定
自杀质粒 pBluescript/Δcag1∶∶Kmr由上下游同源臂与pBlueKM40载体连接后构建完成,进行酶切鉴定。经KpnⅠ、XhoⅠ双酶切后,出现约598 bp片段,即为F1片段;经EcoRⅠ、BamHⅠ双酶切后,出现约737 bp片段,即为F2片段;经KpnⅠ、BamHⅠ酶切后,出现约2 700 bp大小的片段,即为F1、F2、Kmr基因相加片段。符合设计结果。见图2。

图2 自杀质粒的酶切鉴定Fig 2 Identification of the suicide vector by restricted enzyme digestion
2.3 cag1基因缺陷株的鉴定
使用野生株、经卡那霉素筛选的阳性细菌为模板,通过cag1基因同源臂F1上游引物P1和F2下游引物P4作PCR鉴定。结果显示,野生株PCR产物约为1 400 bp,缺陷株PCR产物约为2 700 bp,与设计结果相符。扩增产物测序结果也符合预期结果,证明cag1基因缺陷株构建成功。见图3。
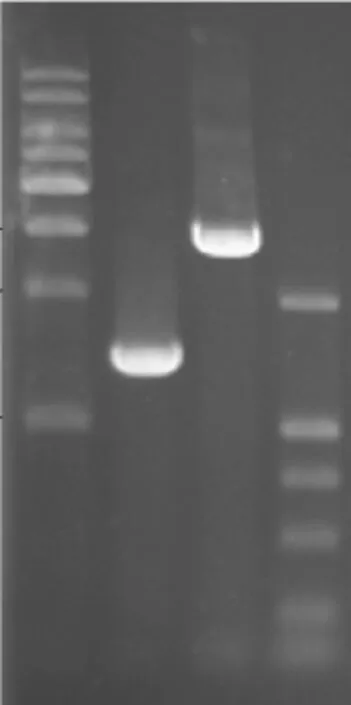
图3 H.pylori cag1基因缺陷株的产物鉴定Fig 3 Identification of H.pylori cag1 gene mutant
2.4 H.pylori野生株和cag1基因缺陷株与GES-1细胞共培养后细胞形态的变化
H.pylori NCTC11637野生株和cag1基因缺陷株分别与GES-1细胞共培养8 h的结果显示,野生株感染后的细胞几乎都被破坏,无正常形态,出现破碎、分散、延长和不规则变化的现象;而cag1基因缺陷株感染的细胞更接近于未感染细胞,仍存在大量梭形的正 常细胞,较少出现细胞破坏的现象。见图4。

图4 GES-1细胞与H.pylori野生株和cag1基因缺陷株共培养后的形态学观察Fig 4 Morphological image of GES-1 cells infected with the H.pylori wild-type strain and cag1 gene mutant strain
3 讨论
H.pylori是胃部疾病的重要病原体,其全球感染率高达50%,已成为世界重大公共卫生问题。国际癌症研究机构(IARC)将其列为第一类致癌原[4]。近期文献报道了cag PAI及其编码的相关毒力蛋白CagA 在 H.pylori感染致病中的重要性[5-6]。流行病学研究证明,cag PAI阳性的H.pylori菌株致病性明显高于cag PAI阴性株[7]。整个cag PAI区域长达35 000 ~40 000 bp,包含29 ~31 个基因[8-9]。其编码蛋白构成一种类似菌毛样结构的Ⅳ型分泌系统,该结构伸出细菌表面,可将毒力因子注入宿主细胞[10]。该Ⅳ型分泌系统的蛋白中有11个与A.tumefaciens中的经典 VirB/D4系统同源[3]。
目前,关于cag1基因功能的研究甚少。但在H.pylori感染的胃组织标本中,cag1基因表达水平极高。与其相似的高表达基因还有尿素酶基因和过氧化氢酶基因等,上述基因功能与细菌存活和生长密切相关,说明在恶劣环境下cag1基因可能对维持细菌存活具有重要的作用[11]。生物信息学分析结果显示,cag1编码蛋白存在信号肽,在N端第21和22个氨基酸位置有切割位点,并且预测其可能是一种新型的分泌蛋白[12]。
本研究以cag PAI首个编码基因cag1作为研究对象,利用同源重组原理,构建cag1基因的缺陷株。选用克隆质粒 pBluescript SKⅡ(-)构建自杀质粒,并在载体中插入一个含启动子的Kmr基因片段,采用PCR方法扩增得到cag1基因两侧片段F1(598 bp)与F2(737 bp),作为同源臂连接于载体抗性基因片段的上下游,成功构建cag1基因缺陷自杀质粒[13]。采用电击转化技术将该质粒转化入野生株。由于pBluescript SKⅡ(-)在H.pylori中无法复制,但具有自杀性,致细菌染色体与载体发生同源重组,使Kmr基因置换野生株的cag1基因,通过 Kmr筛选cag1基因敲除的缺陷株 pBluescript/Δcag1∶∶Kmr得以建立,并用 PCR方法鉴定该缺陷株。H.pylori感染宿主细胞后,会诱导细胞形态发生变化,导致细胞死亡。这种细胞形态延长的变化称为蜂鸟样改变。为了检测cag1基因缺失对细菌毒力的影响,在获得cag1基因缺陷株后,观察H.pylori野生株和cag1基因缺陷株与GES-1细胞共培养后细胞形态的变化。结果显示,野生株感染细胞后8 h,细胞破碎、分散、延长且形态不规则;而cag1基因缺陷株感染后,细胞大多形态正常。以上结果说明,cag1基因缺失后,共培养的GES-1细胞破坏减少。因此,我们认为cag1基因缺失使H.pylori的毒力减弱,但毒力减弱的具体机制尚有待进一步研究。
[1] Peek RM Jr,Crabtree JE.Helicobacter infection and gastric neoplasia[J].J Pathol,2006,208(2):233 -248.
[2] Basso D,Plebani M,Kusters JG.Pathogenesis of Helicobacter pylori infection[J].Helicobacter,2010,15(Suppl 1):14-20.
[3] Akopyants NS,Clifton SW,Kersulyte D,et al.Analyses of the cag pathogenicity island of Helicobacter pylori[J].Mol Microbiol,1998,28(1):37 -53.
[4] Vogiatzi P,Cassone M,Luzzi I,et al.Helicobacter pylori as a class I carcinogen:physiopathology and management strategies[J].J Cell Biochem,2007,102(2):264-273.
[5] Hatakeyama M.The role of Helicobacter pylori CagA in gastric carcinogenesis[J].Int J Hematol,2006,84(4):301-308.
[6] Cendron L,Zanotti G.Structural and functional aspects of unique type IV secretory components in the Helicobacter pylori cag-pathogenicity island[J].FEBS J,2011,278(8):1223-1231.
[7] Kusters JG,Van Vliet AH,Kuipers EJ.Pathogenesis of Helicobacter pylori infection[J].Clin Microbiol Rev,2006,19(3):449-490.
[8] Covacci A,Telford JL,Del Giudice G,et al.Helicobacter pylori virulence and genetic geography[J].Science,1999,284(5418):1328-1333.
[9] Censini S,Lange C,Xiang Z,et al.cag,a pathogenicity island of Helicobacter pylori,encodes type I-specific and disease-associated virulence factors[J].Proc Natl Acad Sci U S A,1996,93(25):14648-14653.
[10] Tegtmeyer N,Wessler S,Backert S.Role of the cagpathogenicity island encoded type IV secretion system in Helicobacter pylori pathogenesis[J].FEBS J,2011,278(8):1190-1202.
[11] Boonjakuakul JK,Syvanen M,Suryaprasad A,et al.Transcription profile of Helicobacter pylori in the human stomach reflects its physiology in vivo[J].J Infect Dis,2004,190(5):946-956.
[12] Olbermann P,Josenhans C,Moodley Y,et al.A global overview of the genetic and functional diversity in the Helicobacter pylori cag pathogenicity island[J].PLoS Genet,2010,6(8):e1001069.
[13] Kim KM,Lee SG,Park MG,et al.Gamma-glutamyltranspeptidase of Helicobacter pylori induces mitochondria-mediated apoptosis in AGS cells[J].Biochem Biophys Res Commun,2007,355(2):562-567.
