含杂原子杯芳烃的合成研究进展
2013-11-21霍书华李德鹏张晓辉
霍书华,李德鹏,张晓辉
(大连大学 环境与化学工程学院,辽宁 大连 116622)
大环化合物在超分子领域中占有重要的地位,新颖大环化合物的发现常常推动超分子化学的发展. 杯芳烃类大环化合物因其制备简单、构象灵活、杯腔独特和识别性能优良等特点,在分子开关[1]、蛋白质识别[2]、药物载体[3]、高效色谱柱[4]、纳米材料[5]等方面得到广泛的应用. 随着研究的深入,不断有新型骨架结构的杯芳烃分子被设计与合成出来,其中杯芳烃骨架结构的改变与修饰已经成为杯芳烃合成研究的一个热点. 杯芳烃中的芳环被芳杂环如吡咯、吡啶、呋喃、噻吩等所取代,或者在杯芳烃桥链中引入杂原子如B、Si、Ge、Sn、N、P、O、S、Se等而形成杂杯芳烃[6](图1),其中有关Si、N、O、S桥联的杯芳烃报道文献较多. 杯芳烃骨架结构的改变会起到改变构象、增强配位能力和包合能力的作用,如对磺酸基杯[4]芳烃水溶性良好,它能够与蛋白质相互作用,识别蛋白质中的赖氨酸[2],这对于蛋白质的改性意义非凡;对磷脂类的杯[4]芳烃能够作为药物载体向大鼠肾上腺嗜铬瘤细胞输送药物[3]. 因此,改变与修饰杯芳烃的骨架结构,不但为杯芳烃的合成以及功能化研究提供了方法,而且拓宽了杯芳烃化合物的应用领域.
杂原子杯芳烃类化合物可以分为三类,桥联原子为杂原子的杯芳烃称为杂杯芳烃;碳原子桥联芳杂环的杯芳烃称为杯杂芳烃;杂原子桥联芳杂环的杯芳烃称为杂杯芳杂烃. 根据杯芳烃的一般命名方法[7],苯酚通过亚甲基桥联的大环化合物被命名为杯[n]芳烃(图2),如杯[4]芳烃1;若这类化合物为开环结构则被命名为假杯芳烃;若相邻两个芳环间由多个原子相连被命名为同杯[n]芳烃,如全-同杯[4]芳烃2;含芳杂环的杯芳烃类化合物被命名为杯[n]杂芳烃,如杯[4]吡咯3;桥联原子为杂原子的杯芳烃类化合物被命名为杂杯[n]芳烃,如硫杂杯[4]芳烃4;桥联原子为杂原子且含芳杂环的杯芳烃类化合物被命名为杂杯[n]芳杂烃,如硅杂杯[4]磷杂芳烃5.
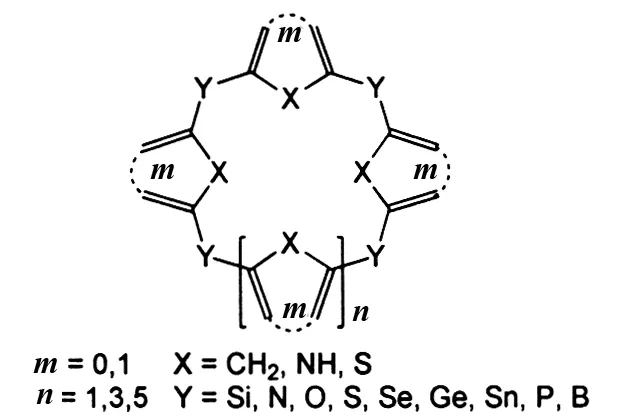
图1 含杂原子的杯芳烃Fig.1 Hetero-atoms calixarenes

图2 一些典型的杯芳烃类化合物Fig.2 Some typical calixarenes
1 杯芳烃的合成进展
1.1 杯杂芳烃的合成


图3 世界上首次合成的杯[4]吡咯Fig.3 The first synthesis of calix[4]pyrrole in the world

图4 杯[1]噻吩[3]吡咯的合成Fig.4 The synthesis of calix[3]thieno[1]pyrrole
1955年,BROWN等[12]报道杯[4]呋喃的合成,用呋喃和脂肪族酮在酸性条件下缩合制得(图5),但产率很低(18%~20%). CHASTRETTE等[13]认为合成杯[4]呋喃8过程中存在金属离子的模板作用,而REST等[14-15]认为是反应过程中的H+而不是金属模板作用对产率起决定作用,将杯[4]呋喃产率提高到了35%. 2000年,KOHNKE等[16]采取杯[6]呋喃氧化开环-还原合环的方法,对氮杂杯吡啶类大环化合物的合成、结构及分子识别性能进行了研究,合成了杯[6]吡咯9、杯[3]吡咯[3]呋喃10和杯[4]吡咯[2]呋喃11(图6). 2001年,TANIGUCHI等[17]采取“[3+1]片段偶联法”分别合成了杯[4]吡咯12和杯[3]吡咯[1]呋喃13(图7).

图5 杯[4]呋喃的合成Fig.5 The synthesis of calix[4]furan

图6 氮杂杯吡咯类化合物的合成Fig.6 The synthesis of calix[m]furan[n]pyrroles from calix[6]furans

图7 杯[m]吡咯[n]呋喃的合成Fig.7 The synthesis of calix[m]furan[n]pyrrole by fragment coupling methods
1.2 杂杯芳烃的合成
硫桥联杯芳烃和亚甲基桥联杯芳烃相比,在电子云密度和结构上完全不同,这使得它作为大环主体分子具备许多新的功能[18]. 1993年,KUMAGAI等[19]采用“多步法”首次合成了硫桥杯[4]芳烃,但产率很低,改用“一锅法”[20]合成硫桥杯[4]芳烃14,产率达到54%(图8). 该方法是在NaOH存在下,将对叔丁基苯酚和升华硫(S8)在Me(OCH2CH2O)4Me中在4 h升温至230 ℃,保持230 ℃反应3 h,冷却得到硫桥杯[4]芳烃,同时还得到了少量的硫桥杯[5]芳烃和硫桥杯[6]芳烃. 2002年,MIYANO等[21]用二聚硫醚合成出硫桥杯[4]芳烃,其产率高达83%(图9). 同年,HOSSEINI等[22]首次用X-ray对硫桥杯[4]芳烃进行单晶衍射实验,其研究表明硫桥杯[4]芳烃拥有比传统杯芳烃更大的环,导致其框架结构更易发生变化.

图8 硫桥杯[4]芳烃的合成Fig.8 The synthesis of p-tert-butylthiacalix[4]arene by one-pot reaction

图9 硫桥杯[n]芳烃的合成Fig.9 The synthesis of p-tert-butylthiacalix[n]arene from a sulfur-bridged acyclic dimer
为了研究具有高度刚性结构和弱碱性键合位点的冠醚对金属阳离子的识别性能,人们合成出来了全芳烃冠醚. 1974年,LEHMANN等[23]利用间苯二酚和活化的芳烃直接发生亲核取代反应得到大环化合物17和18,产率分别为13%和7%(图10). 同年,SINGH等[24]用4-溴苯酚或硫酚在Cu2O催化下发生Ullmann反应合成全芳烃冠醚和全芳烃冠硫醚,其产率分别为4%和8%. 1989年,SERGEEV等[25-26]用硫化钠和联苯硫醚类化合物合成出一系列全芳烃冠硫醚19-21(图11),并用X-ray对硫杂杯芳烃进行单晶衍射研究,认为硫杂杯芳烃产率很低,主要是由于含硫大环化合物的分子能量高、不稳定所致.

图10 全芳烃冠醚的合成Fig.10 The synthesis of a calix[4]arene-crown

图11 全芳烃冠硫醚的合成Fig.11 The synthesis of thiacalix[n]arene-crowns
1.3 杂杯芳杂烃的合成
硅原子作为碳原子的同族元素,广泛应用于含有芳环或者芳杂环的杯芳烃的合成. 1973年,KAUFFMANN等[27]报道了硅杂杯[4]噻吩22的合成. 1992年,CORRIU等[28]在研究聚合反应时,硅杂杯[4]噻吩22和硅杂杯[6]噻吩23作为副产物分离得到(图12). 1995年,KÖNIG等[29]发展了芳环或芳杂环双负离子与二甲基二氯硅烷合成硅杂杯芳烃的方法:一般先合成二聚体,之后与二氯二甲基硅烷反应,以制备相应的硅杂芳烃(图13). 在反应中,先将双负离子溶解在石油醚中,然后慢慢滴加二氯二甲基硅烷,硅杂芳烃24、25分别以12%和16%的收率得到.

图12 硅杂杯[4]噻吩和硅杂杯[6]噻吩Fig.12 The synthesis of sila-bridged calix[4 or 6]thiophene macrocyclic compounds

图13 硅杂杯芳烃的合成Fig.13 The synthesis of sila-calixarenes
氮杂杯杂芳烃桥联氮原子可以采取sp2及sp3两种杂化形式,它能与相连的芳环形成不同程度的共轭,生成不同键长和键角的桥联单元,从而可以调控该类主体分子的构象及其识别性能[30]. 2002年,YAMAMOTO等[31]报道了钯催化“一锅法”合成了氮杂杯[4]吡啶26和氮杂杯[6]吡啶27,但该方法产率很低,仅为1.5%和10.1%(图14). 2004年,王梅祥等[30]也通过钯催化采用“片段偶联法”合成甲基氮杂杯[2]吡啶[2]芳烃28和甲基氮杂杯[4]吡啶[4]芳烃29,其产率有所提高,分别为26%和22%(图15),X-ray晶体衍射分析表明该类分子具有独特的结构:甲基氮杂杯[2]芳烃[2]吡啶28采取扭曲的1,3-交替构象,而甲基氮杂杯[4]芳烃[4]吡啶29采取类似“双头汤匙”形状的1,2,3-部分锥式构象(图16). UV-Vis及荧光光谱表明化合物29对富勒烯类分子(C60和C70)有非常好的识别作用.
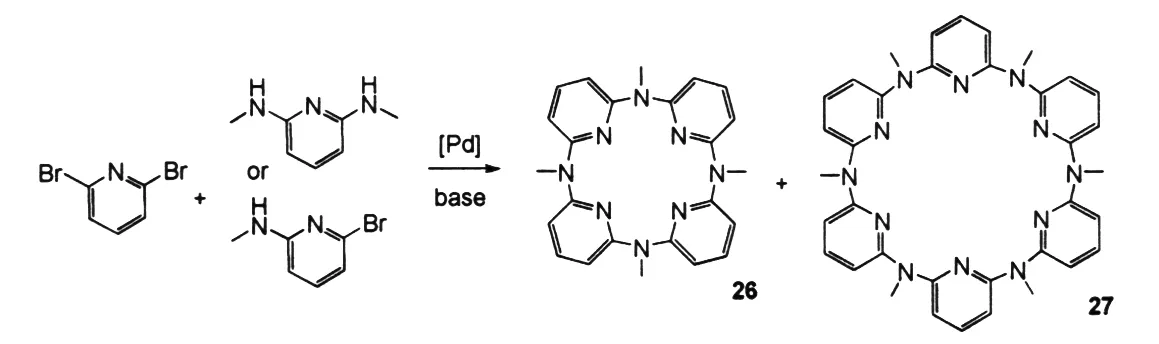
图14 氮杂杯[4]吡啶和氮杂[6]吡啶Fig.14 The synthesis of nitrogen-bridged calix[4 or 6]pyridine macrocyclic compounds

图15 甲基氮杂杯[2]吡啶[2]芳烃和甲基氮杂杯[4]吡啶[4]芳烃Fig.15 The synthesis of nitrogen-bridged calixpyridine macrocyclic compounds by fragment coupling methods

图16 甲基氮杂杯[4]芳烃[4]吡啶29采取类似“双头汤匙”形状Fig.16 2,6-bis(methylamino)pyridine resembling a double-ended spoon
2004年,王梅祥等[32]由便宜易得的雷锁辛及其类似物与三聚氰氯出发,采用“[1+3]片段偶联法”有效地合成了一系列氧和(或)氮原子桥联杯[2]芳烃[2]三嗪衍生物30-38(图17). X-ray单晶衍射结果表明该类环状主体在固相中均采取1,3-交替构象,四个桥联杂原子几乎处于同一平面,它们更倾向与三嗪环共轭,从而形成了两种结构单元:孤立的苯环单元、与相邻两个杂原子共轭的三嗪环单元. 通过这种排列形式构成空腔,桥联氧原子和氮原子通过电子效应、共轭性能和立体位阻等性质共同作用,精细调节着空腔的大小,空腔上沿两个苯环之间的距离从0.5到0.8 nm不等.

图17 氧和(或)氮桥联杯[2]芳烃[2]三嗪衍生物Fig.17 The synthesis of a number of aza- and/or oxo-bridged calix[2]arene[2]triazines
2010年GONG等[33]报道了该组独立设计并高效合成的“得州分子箱”大环分子(图18),它是一个含有许多孤对电子、构象灵活的项链状大环分子,其通过阴离子导向作用进行分子识别. 2011年,龚汉元报道了该大环分子对环境敏感,在不同的温度及pH下其对阴离子具有不同的响应[34]. 2012年,龚汉元等[35]报道了该大环分子对中性分子及阴离子进行分子识别和构筑准轮烷及金属链接的超分子衍生物的过程.

图18 “得州分子箱”大环分子Fig.18 A ‘Texas-sized’ molecular box
硼作为典型的缺电子非金属元素,其杯芳烃合成始于1996年,由CORRIU等[36]报道(图19). N,N-二异丙基二(2-噻吩)硼胺与LiTMP作用生成负离子,再与Cl2BN(i-Pr)2反应得到硼桥联芳杂环化合物39,产率为62%,X-射线晶体衍射测定它是1,2-交替的. 2002年,KOEHLER等[37]和SIEBERT等[38]分别用类似的方法将N-甲基吡咯单元引入大环合成了噻吩和N-甲基吡咯单元交替的硼桥联杯[4]芳烃.

图19 硼桥联芳杂环化合物Fig.19 The synthesis of a boron-bridged tetrathiaporphyrinogen
含有其他杂原子的杯芳烃类化合物报道的比较少. 1995年,KÖNIG等[39]报道了锡桥联杯芳烃和磷桥联杯芳烃,但是它们均在空气中不稳定会迅速发生分解. 2年后,KÖNIG等[40]首次报道合成了锗桥联杯芳烃 (图20). 随着对杯芳烃化学的深入研究,将来会有更多种的元素参与到建构新型杯芳烃骨架中来.

图20 锡桥联杯芳烃和锗桥联杯芳烃Fig.20 The synthesis of stannum-bridged and germanium-bridged calixarenes
2 展望
桥联杂原子及芳杂环的引入,不仅使超分子领域中出现了许多新型骨架结构的杯芳烃类大环化合物,并且这些大环化合物呈现出了许多与传统杯芳烃不同的性能及分子识别特性. 比如,在杯芳烃引入桥联氮原子,它能采取sp2、sp3或介于这两者之间的杂化状态,能与相邻芳(杂)环形成不同程度的共轭作用,使其键长、键角发生改变,导致大环分子构象变化,进而实现对其空腔的精细调控. 构象和空腔大小调控所需能量较低,与客体作用时,大环主体分子通过自身构象调控以达到与客体之间的最佳匹配,实现最强的作用. 总之,桥联杂原子及芳杂环的引入不仅改变了杯芳烃的大环结构和性能,而且其对客体分子的亲和力和选择性也发生了改变. 研究这些变化不仅能够深入地理解超分子现象和作用,并且对设计新型超分子化合物具有指导意义.
参考文献:
[1] SHARE A I, FLOOD A H. Supramolecular chemistry: thinking inside and outside the box[J]. Nature Chem, 2010, 2(5):349-350.
[2]SCHRADER T. Protein recognition calixarene connection[J]. Nature Chem, 2012, 4(7):519-520.
[3]MARTIN A D, HOULIHAN E, MORELLINI N , et al. Synthesis and toxicology ofp-phosphonic acid calixarenes ando-alkylated analogues as potential calixarene-based phospholipids[J]. Chempluschem, 2012, 77(4):308-313.
[4]SHI Jie Hua, JIA Qian Qian, XU Shui Xing. Characterization of calixarene/ionic liquid mixture as gas chromatographic stationary phase through thermodynamic parameters[J]. Chromatographia, 2012, 75(13-14):779-787.
[5]LIU Mei, LIAO Wu Ping, HU Chun Hua, et al. Calixarene-based nanoscale coordination cages[J]. Angew Chem Int Edit, 2012, 51(7):1585-1588.
[6]王梅祥. 新型与功能化杂原子桥连杯芳烃的超分子化学[C]. 有机化学: 中国化学会第七届有机化学学术会议图文摘要集. 北京:科学出版社,2011:5.
[7]GUTSCHE C D. Chapter 1 from resinous tar to molecular baskets[M]. Calixarenes: An Introduction, 2nd Edition, London: The Royal Society of Chemistry, 2008:24-26.
[8]BAEYER A. Ueber ein condensations product von pyrrol mit aceton[J]. Berichte der Deutschen Chemischen Gesellschaft, 1886, 19(2):2184-2185.
[9]GALE P A, SESSLER J L, KRL V, et al. Calix[4]pyrroles: old yet new anion-binding agents[J]. J Am Chem Soc, 1996, 118(21):5140-5141.
[10] SESSLER L J, ANZENBACHER P, JURSIKOVA K, et al. Functionalized calix[4]pyrroles[J]. Pure Appl Chem, 1998, 70(12):2401-2408.
[11] DE NAMOR A, ABBAS I, HAMMUD H H. Anion complexation by calix[3]thieno[1]pyrrole: the medium effect[J]. J Phys Chem B, 2006, 110(5):2142-2149.
[12] ACKMAN R G, BROWN W H, WRIGHT G F. The condensation of methyl-ketones with furan[J]. J Org Chem, 1955, 20:1147-1158.
[13] CHASTRETTE M, CHASTRETTE F. Template effect in synthesis of furan compounds[J]. Chem Commun, 1973(15):534-535.
[14] REST A J, SMITH S A, TYLER I D. The template synthesis of 2,2,7,7,12,12,17,17-octamethyl-21,22,23,24-tetraoxaquaterene: factors affecting the choice of template agent[J]. Inorg Chim Acta, 1976, 16:L1-L2.
[15] DE S H M, REST A J. Role of metal salts in the synthesis of 1,1,7,7,13,13,19,19-octamethyl[1.1.1.1](2,5)furanophan[J]. Chem Commun, 1981(4):149-150.
[16] CAFEO G, KOHNKE F H, TORRE G L, et al. From large furan-based calixarenes to calixpyrroles and calix[n]furan[m]pyrroles: syntheses and structures[J]. Angew Chem Int Ed, 2000, 39(8):1496-1498.
[17] TANIGUCHI S, HASEGAWA H, YANAGIYA S, et al. The first isolation of unsubstituted porphyrinogen and unsubstituted 21-oxaporphyrinogen by the '3+1' approach from 2,5-bis(hydroxymethyl)pyrrole and tripyrrane derivatives[J]. Tetrahedron, 2001, 57(11):2103-2108.
[18] MOROHASHI N, NARUMI F, IKI N, et al. Thiacalixarenes[J]. Chem Rev, 2006, 106(12):5291-5316.
[19] SONE T, OHBA Y, MORIYA K, et al. Abstract book of workshop on calixarenes and related compounds[Z]. Fukuoka, Japan:1993.
[20] KUMAGAI H, HASEGAWA M, MIYANARI S, et al. Facile synthesis ofp-tert-butylthiacalix[4]arene by the reaction ofp-tert-butylphenol with elemental sulfur in the presence of a base[J]. Tetrahedron Lett, 1997, 38(22):3971-3972.
[21] KON N, IKI N, MIYANO S. Synthesis ofp-tert-butylthiacalix[n]arenes (n=4, 6, and 8) from a sulfur-bridged acyclic dimer ofp-tert-butylphenol[J]. Tetrahedron Lett, 2002, 43(12):2231-2234.
[22] AKDAS H, BRINGEL L, BULACH V, et al. Molecular baskets based on tetramercaptotetrathiacalix[4]arene and tetrathiacalix[4]arene[J]. Tetrahedron Lett, 2002, 43:8975-8979.
[23] A LEHMANN F P. Conformations of highly hindered aryl ethers-xix: synthesis and NMR study of some cyclic aryl polyethers[J]. Tetrahedron, 1974, 30(6):727-733.
[24] BIRD C W, SINGH M. Synthesis of macrocyclic compounds using the Ullmann reaction[J]. Chemi Indus, 1974(18):749-750.
[25] SERGEEV V A, OVCHINNIKOV Y E, NEDEL'KIN V I, et al. Synthesis and crystal structure of cyclotris(m-phenylene sulfide)[J]. Izvestiya Akademii Nauk SSSR, Seriya Khimicheskaya, 1988(7):1625-1629.
[26] SERGEEV V A, NEDEL'KIN V I, ASTANKOV A V, et al. Directed synthesis of macrocyclic phenylene sulfides[J]. Izvestiya Akademii Nauk SSSR, Seriya Khimicheskaya, 1990(4):854-858.
[27] KAUFFMANN T, KNIESE H H. Sila-thiopheno-protophane und-phane[J]. Tetrahedron Lett, 1973(14):4043-4046.
[28] CHICART P, CORRIU R J P, MOREAU J J E, et al. Selective synthesis and some electroconductive properties of organosilicon polymers containing aromatic units[J]. NATO ASI Series, Series E: Applied Sciences, 1992, 206(Inorg Organomet Polym Spec Prop):179-190.
[29] KÖNIG B, RÖDEL M, BUBENITSCHEK P, et al. Silicon-bridged macrocycles-synthesis of sila-calixarenes[J]. Angew Chem Int Ed, 1995, 34(6):661-662.
[30] WANG Mei Xiang, ZHANG Xiao Hang, ZHENG Qi Yu. Synthesis, structure, and [60]fullerene complexation properties of azacalix[m]arene[n]pyridines[J]. Angew Chem Int Ed, 2004, 43:838-842.
[31] MIYAZAKI Y, KANBARA T, YAMAMOTO T. preparation of new type of azacalixarene, azacalix[n](2,6)pyridine[J]. Tetrahedron Lett, 2002, 43:7945-7948.
[32] WANG Mei Xiang, YANG Hai Bo. A general and high yielding fragment coupling synthesis of heteroatom-bridged calixarenes and the unprecedented examples of calixarene cavity fine-tuned by bridging heteroatoms[J]. J Am Chem Soc, 2004, 126(47):15412-15422.
[33] GONG Han Yuan, RAMBO B M, KARNAS E , et al. A 'texas-sized' molecular box that forms an anion-induced supramolecular necklace[J]. Nature Chem, 2010, 2(5):406-409.
[34] GONG Han Yuan, RAMBO B M, KARNAS E , et al. Environmentally responsive threading, dethreading, and fixation of anion-induced pseudorotaxanes[J]. J Am Chem Soc, 2011, 133(5):1526-1533.
[35] GONG Han Yuan, RAMBO B M, LYNCH V M , et al. Neutral and anionic guests and their effect on the formation of pseudoro-taxanes by using a flexible tetracationic imidazolium macrocycle[J]. Chem Eur J, 2012, 18(25):7803-7809.
[36] CARRE F H, CORRIU R J P, DEFORTH T, et al. A boron-bridged tetrathiaporphyrinogen[J]. Angew Chem Int Ed, 1998, 37:652-654.
[37] KOEHLER T, PRITZKOW H, SIEBERT W. [3+1]Cycloadditions with formation of tetraboraporphyrinogenes[J]. Zeitschrift fuer Naturforschung, Teil B:Chemi Sci, 2002, 57:1101-1107.
[38] ECKERT A, PRITZKOW H, SIEBERT W. Synthesis and structure of diboraporphyrinogenes[J]. Eur J Inorg Chem, 2002:2064-2068.
[39] KÖNIG B, RÖDEL M, BUBENITSCHEK P, et al. Synthesis, structure, and coordination properties of silicon-bridged macrocycles[J]. J Org Chem, 1995, 60(23):7406-7410.
[40] KÖNIG B, RÖDEL M. Synthesis and properties of me2Ge-bridged arenes[J]. Chemische Berichte, 1997, 130(3):421-424.
