海藻酸盐-壳聚糖复合微/纳米凝胶研究进展
2013-11-21朱红娜周莉莉李建法
李 洁,朱红娜,周莉莉,李建法
(绍兴文理学院 化学系,浙江 绍兴 312000)
凝胶是由一些无机或有机高分子经化学或物理交联形成的聚合物网络结构,由于聚合物功能基团、交联程度和相对分子质量大小的变化,凝胶表现出不同的亲水或疏水性、及在不同介质环境下的收缩或膨胀能力. 利用凝胶的这些特性,可以用作药物、蛋白质等活性物质的载体,从而提高活性成分的稳定性或延长其持效期. 微/纳米凝胶是指粒径为几十纳米至几百微米之间的凝胶颗粒,它将凝胶和微/纳米粒子的优点有效结合在一起. 不仅可以保持凝胶的高负载能力和稳定性,同时获得良好的分散性和透过能力,进而提高活性成分的生物利用率和靶向定位效果. 微/纳米凝胶从结构上可分为实心球和胶囊两种,对活性成分的负载方式以包埋为主,另有少量表面吸附(图1). 制备微/纳米凝胶的原料很多,既有合成类的高分子如聚乙烯醇、聚异丙基丙烯酰胺等,也有天然来源高分子如海藻酸盐、壳聚糖和纤维素衍生物. 其中海藻酸盐和壳聚糖具有良好的生物相容性、黏附性和降解性,在药物、蛋白质输送、酶固定化等领域具有独特的优势. 利用海藻酸盐阴离子和壳聚糖阳离子之间的相互作用,不仅可以方便地制备复合微/纳米凝胶,而且可以避免使用那些具有潜在毒害作用的交联组分. 因此,近年来,以海藻酸盐与壳聚糖为原料制备的微/纳米凝胶引起了研究者们的广泛兴趣. 本文作者在简单介绍海藻酸盐、壳聚糖及单一组分微/纳米凝胶的基础上,重点讨论两者复合制备微/纳米凝胶的研究进展及在生物医学领域的应用前景.

(A)实心球,(B)胶囊,(C)实心球表面吸附图1 微/纳米凝胶结构示意图Fig.1 Schematic structure of micro- / nano-gels
1 海藻酸盐微/纳米凝胶
海藻酸是来源于褐藻的天然多糖,是由β-(1,4)-D-甘露糖醛酸(M)和α-(1,4)-L-古罗糖醛酸(G)等两种结构单元构成的线性共聚物. 海藻酸分子结构中含有大量羧酸基,在碱性条件下可水解形成海藻酸钠等水溶性海藻酸盐,后者的性质与其M/G两种结构单元的比例和分子量等密切相关. 海藻酸钠与多价金属阳离子如钙离子反应时,可通过多价阳离子的桥联作用,发生快速交联形成具有“蛋箱”结构的凝胶. 基于这一凝胶特性,海藻酸盐经常被用作药物、蛋白质、细胞等的载体,具有缓释、稳定及提高活性等多种功能[1]. 例如,利用海藻酸盐的原位凝胶技术,可将其用于眼用或口服药物的输送[2-3];将血管内皮生长因子(VEGF)包载到海藻酸盐微球中,可以提高药物活性,并有望用于组织修复工程[4].
自20世纪90年代,人们对海藻酸盐纳米凝胶颗粒的研究越来越多. RAJAONARIVONY等[5]采用氯化钙和聚-L-赖氨酸做交联剂制备了粒径在250~850 nm的海藻酸盐凝胶颗粒,并将其用作阿霉素的载体. AHMAD等[6]将海藻酸盐纳米凝胶颗粒用于包载抗结核药物,可以延长药效、提高药物活性. 与常规尺寸的凝胶颗粒相比,制备纳米凝胶颗粒时所用的海藻酸盐溶液浓度较低、黏度较小,从而获得更好的分散性. 采用的交联技术与常规凝胶基本相同,主要采用氯化钙化学交联方法. 但是,采用单一海藻酸盐组分的微/纳米凝胶机械强度低、尺寸和结构稳定性较差,影响了对药物等活性成分的缓释效果,因此,近年来,利用海藻酸盐与其他材料一起制备复合型微/纳米凝胶受到了人们的更多关注[7-8].
2 壳聚糖微/纳米凝胶
壳聚糖是甲壳素经脱乙酰化处理后的产物,化学结构是2-氨基-2-脱氧-D-葡萄糖(D-葡萄糖胺)和2-乙酰氨基-2-脱氧-D-葡萄糖(N-乙酰-D-葡萄糖胺)经β-(1,4)-糖苷键位相连的共聚物,酸性条件下壳聚糖分子上的氨基质子化,使其溶解性能大大改善,形成阳离子型的聚电解质. 因此,溶解后的壳聚糖可与阴离子型聚合物形成聚电解质络合物[9],或与聚阴离子化合物如三聚磷酸盐发生 “离子凝胶反应”[10]. 壳聚糖无毒且具有良好的生物相容性,它可以黏附在黏膜表面,又可以穿透上皮细胞,这一系列特性使壳聚糖基凝胶成为重要的生物医学材料[11].
制备壳聚糖微/纳米凝胶颗粒最常用的方法是利用壳聚糖和三聚磷酸盐的离子凝胶反应. CALVO等[12]将含有三聚磷酸盐的弱碱性水溶液直接与含壳聚糖的酸性溶液在室温下混合,由于磷酸根与壳聚糖氨基之间的静电相互作用,导致壳聚糖的分子内或分子间交联,随即形成粒径在200~1 000 nm的凝胶颗粒. 该纳米凝胶对牛血清白蛋白(BSA)的包载效率可达80%,连续释放时间长达1周. 离子凝胶法条件温和、操作简便,所制备的壳聚糖纳米凝胶可用于敏感药物的输送体系. 例如,此法制备的壳聚糖纳米凝胶有助于提高胰岛素在肠道中的吸收即生物利用率[13],也可以用于寡核苷酸的口服给药系统[14]及基因输送系统[15]. 除了采用三聚磷酸盐做交联剂外,硫酸钠、戊二醛、硫酸软骨素[16]等也曾用作交联剂制备壳聚糖微/纳米凝胶颗粒.
另外一种制备壳聚糖微/纳米凝胶的重要方法是反相胶束法. 该方法利用W/O型微乳液的良好分散作用,使反相胶束成为制备纳米凝胶的微反应器. 通常,先在有机溶剂中加入表面活性剂形成反相胶束,再缓慢加入壳聚糖溶液形成W/O型微乳液,然后再滴加交联剂. 最后将有机溶剂和表面活性剂除去,得到粒径在几十纳米的凝胶颗粒[17].
3 海藻酸盐-壳聚糖复合微/纳米凝胶的制备
海藻酸盐分子链上含有大量的阴离子型羧酸根,而壳聚糖分子链上有大量的氨基,两者分别带正、负电荷,混合后阴、阳离子对间产生静电结合,形成聚电解质络合物[18]. 利用壳聚糖的络合作用可改善海藻酸盐凝胶的致密度,不仅有利于强化对药物等活性成分的缓释作用,而且有助于改善海藻酸盐在碱性条件下的稳定性、防止其溶解;同时,壳聚糖自身在酸性条件下的稳定性也得到改善. 因此,采用海藻酸盐和壳聚糖经适当方式制备复合微/纳米凝胶受到大家的关注[19-20].
3.1 一步交联法
该方法利用海藻酸盐与钙离子的交联反应、海藻酸盐与壳聚糖之间的静电相互作用制备复合凝胶颗粒. 基本步骤是,首先将壳聚糖溶解并加入氯化钙,形成混合交联剂溶液,然后将海藻酸钠溶液滴入,再经后续干燥等过程制备凝胶颗粒. VANDENBERG等[21]将牛血清白蛋白和海藻酸钠的混合溶液通过针孔滴入壳聚糖/氯化钙混合溶液中,再经抽滤和酸洗,制备了表面交联的复合微胶囊制剂,由于未经干燥处理,微胶囊的粒径较大,为1 080~5 430 μm. WITTAYA-AREEKUL等[22]将皮质类固醇药物Prednisolone分散在海藻酸钠溶液中,然后滴入含氯化钙的壳聚糖溶液中,得到粒径为1 000~2 000 μm的凝胶微球. 研究表明,凝胶粒径大小主要与载药量有关,而氯化钙和壳聚糖浓度对粒径的影响相对较小. 与分别采用氯化钙和壳聚糖交联相比,一步交联得到的微凝胶有更好的黏膜黏附性,有望用于结肠定位给药系统. 为了制备粒径更小的凝胶,YU等[23]将一步法制备的海藻酸盐-壳聚糖复合珠状凝胶,用搅拌机打碎,再经冷冻干燥制得粒径为100~200 μm的微凝胶. 与未经壳聚糖处理的海藻酸盐凝胶相比,复合凝胶可以明显延缓对药物的释放.
由于滴制凝胶颗粒的大小很大程度上取决于滴孔尺寸,进一步降低凝胶尺寸受到限制. 为此,MLADENOVSKA等[24]将包载5-氨基水杨酸(5-ASA)的海藻酸钠溶液经喷雾干燥器喷嘴注入壳聚糖和氯化钙混合交联剂中,得到粒径<10 μm的凝胶颗粒. 经激光共聚焦扫描显微镜观察,壳聚糖主要位于颗粒外层,形成了双层实心球结构(图2). DODOV等[25]则直接将海藻酸钠溶液、氯化钙和壳聚糖的混合交联液等两份溶液通过一个双流体喷嘴直接混合后,喷雾干燥得到粒径为6~15 μm的复合凝胶颗粒.
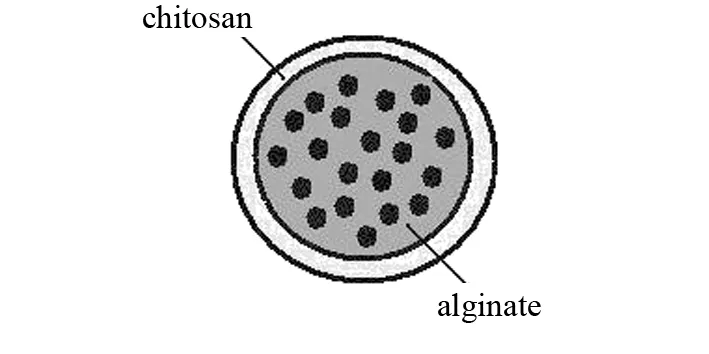
图2 海藻酸盐/壳聚糖复合凝胶的双层结构Fig.2 Double-layered structure of alginate/chitosan composite gel
区别于常见的通过海藻酸盐交联反应制备复合凝胶,GOYCOOLEA等[26]通过对壳聚糖进行交联制备复合凝胶颗粒. 主要步骤包括:分别制备壳聚糖、三聚磷酸盐和海藻酸钠的溶液,首先将三聚磷酸盐与海藻酸钠溶液混合,然后再与壳聚糖溶液混合,将得到的复合凝胶颗粒离心分离,冷冻干燥后颗粒的粒径在270~390 nm之间,且粒径大小随海藻酸钠相对分子质量和用量的提高而增大. 李国明等[27]采用乙二醇二缩水甘油醚为交联剂,先将混有药物的海藻酸钠溶液均匀乳化到液体石蜡中,再加入壳聚糖和交联剂混合液,加热反应,制备了粒径在20 μm以下的复合微球,产品对盐酸阿米替林具有较好的缓释作用. 此外,在一步交联法制备的复合微凝胶中加入纳米磁粒有助于利用磁场调控凝胶中所含活性成分的释放速率[28].
3.2 两步交联法
该方法中,海藻酸钠溶液首先经钙离子交联形成海藻酸钠微/纳米球,再与壳聚糖结合制备复合凝胶颗粒. COPPI等[29]利用喷雾干燥技术制备了包载牛血清白蛋白(BSA)的海藻酸盐微球,平均直径小于10 μm,然后分别经氯化钙溶液和壳聚糖溶液交联得到稳定的凝胶颗粒. 采用该方法制备的药物颗粒可作为口服制剂,一方面减少蛋白质药物在胃内的降解,另一方面可以提高药物在肠道中的吸收. DE和ROBINSON等[30]先用氯化钙溶液预交联海藻酸钠,同时超声波震动形成颗粒状凝胶,后者再经壳聚糖进行表面处理,最后得到粒径为300~600 nm的凝胶颗粒. 研究表明,氯化钙、壳聚糖的用量是形成纳米颗粒的关键,它们与海藻酸盐的质量比均不能超过0.1∶1,否则形成的凝胶颗粒较大.
TAQIEDDIN和AMIJI[31]以钙离子交联的海藻酸盐凝胶为核,包裹壳聚糖后再用三聚磷酸盐交联制备了核/壳结构的微胶囊,作为酶的固定化载体,其颗粒粒径超过2 mm,且中心部分呈液态. 邢楠等[32]则将海藻酸钙/壳聚糖微胶囊用于包封牛血清白蛋白(BSA),其通透性与制备微胶囊时壳聚糖的浓度有关. 壳聚糖浓度越小,通透性越好. LIU等[33]则分别采用内交联法和外交联法制备了海藻酸盐-壳聚糖复合微胶囊,结果显示,内交联法制备的微胶囊其壳聚糖壁层较厚,水中膨胀度较小.
BORGES等[34]则以壳聚糖为核制备了复合纳米凝胶颗粒,并将其用作乙肝表面抗原的载体. 首先,在壳聚糖溶液中加入硫酸钠得到凝胶颗粒,经冷冻干燥后,再将凝胶颗粒分散到海藻酸钠溶液中,最后经氯化钙交联,得到粒径为460~820 nm的复合凝胶颗粒. 与一步交联法制备复合微/纳米凝胶相比,两步交联法操作较为复杂,但相对容易控制复合凝胶颗粒的组成与结构,进而改进对药物、蛋白质等释放行为的调控[35].
3.3 其他方法
除了上述两种通过化学交联制备海藻酸盐-壳聚糖复合凝胶颗粒的方法外,DOUGLAS等[36]将低浓度的海藻酸盐溶液与壳聚糖溶液以1∶1.5的质量比混合,通过这两种大分子之间的静电作用,得到平均粒径为157 nm的凝胶颗粒,用作基因载体时可提高转染效率.
RIBEIRO等[37]采用乳化/内部交联技术制备了壳聚糖强化海藻酸盐微球,具体步骤如下:先将海藻酸钠分散到磷酸盐缓冲液中,加入微晶碳酸钙,将混合悬浮液加入到含乳化剂的液体石蜡中. 充分乳化后,加入冰醋酸使碳酸钙溶解,同时使海藻酸钠交联,再用壳聚糖乳液进行处理,得到粒径为20~250 μm的复合凝胶颗粒.
TAO等[38]以微米级的三聚氰胺甲醛树脂颗粒为核,利用海藻酸盐和壳聚糖之间的静电自组装能力制备壳层,然后用酸将核溶出,得到粒径在10 μm以下的凝胶壳体,该微壳体所特有的多层复合结构使它具有更好的稳定性.
4 复合微/纳米凝胶的优势与应用前景
海藻酸盐-壳聚糖复合微/纳米凝胶作为一种性能优异的载体,主要应用于药物控制释放、细胞和酶的固定化等多个领域. 与其他载体相比,该复合凝胶主要具有如下几个方面的优势:1) 海藻酸盐和壳聚糖均具有良好的生物相容性、黏附性和降解性,是安全性较高的生物材料;2) 复合凝胶具有更高的强度和稳定性,适用于包载更多种类的药物,包括蛋白质等大分子药物;3) 壳聚糖和海藻酸盐品种多样,在分子量大小、取代度等方面可供选择的余地较大,能够满足不同类型活性成分对载体的要求;4) 复合凝胶的微/纳米尺度使其更容易分散,可提高药物等活性成分的利用率;5) 海藻酸盐和壳聚糖原料来源丰富,具有一定的成本优势;6) 复合凝胶的制备方法,如一步交联法过程简单、条件温和,与喷雾干燥、冷冻干燥等技术相结合,可以制备粒径从几十纳米到上千微米的凝胶颗粒,为包载各种活性物质提供了充分的备选方案.
鉴于海藻酸盐-壳聚糖复合微/纳米凝胶的突出优势,该领域已成为国内外的研究热点之一. 目前,研究工作主要关注通过改进制备方法和工艺,尝试制备出粒径分布均匀、外形规整并具有良好包载能力的海藻酸钠-壳聚糖复合纳米凝胶. 相信随着对该复合凝胶结构、性能和应用方面的深入研究,海藻酸钠-壳聚糖纳米凝胶将在药物和蛋白质输送、酶固定等生物和医学领域显示出良好的应用前景.
参考文献:
[1] WEE S F, GOMBOTZ W R. Protein release from alginate matrices [J]. Adv Drug Deliv Rev, 1998, 31(3): 267-285.
[2] LIN H R , SUNG K C, VONG W J. In situ gelling of alginate/pluronic solutions for ophthalmic delivery of pilocarpine [J]. Biomacromol, 2004, 5: 2358-2365.
[3] LIEW C V, CHAN L W, CHING A L, et al. Evaluation of sodium alginate as drug release modifier in matrix tablets [J]. Int J Pharm, 2006, 309: 25-37.
[4] LEE K Y, PETERS M C, ANDERSON K W, et al. Controlled growth factor release from synthetic extracellular matrices [J]. Nature, 2000, 408: 998-1000.
[5] RAJAONARIVONY M, VAUTHIER C, COUARRAZE G, et al. Development of a new drug carrier made from alginate [J]. J Pharm Sci, 1993, 82: 912-917.
[6] AHMAD Z, SHARMA S, KHULLER G K. Chemotherapeutic evaluation of alginate nanoparticle encapsulated azole antifungal and antitubercular drugs against murine tuberculosis [J]. Nanomedicine, 2007, 3: 239-243.
[7] JOSHI A, KEERTHIPRASAD R, JAYANT R D, et al. Nano-in-micro alginate based hybrid particles [J]. Carbohydr Polym, 2010, 81: 790-798.
[8] WEN Y, GRNDAHL L, GALLEGO M R, et al. Delivery of dermatan sulfate from polyelectrolyte complex-containing alginate composite microspheres for tissue regeneration [J]. Biomacromol, 2012, 13: 905-917.
[9] ASSAAD E, BLEMUR L, LESSARD M, et al. Polyelectrolyte complex of carboxymethyl starch and chitosan as protein carrier: oral administration of ovalbumin [J]. J Biomater Sci Polym Edition, 2012, 23: 1713-1728.
[10] SHU Xiao Zheng, ZHU Kang Jie. A novel approach to prepare tripolyphosphate/chitosan complex beads for controlled release drug delivery [J]. Int J Pharm, 2000, 201: 51-58.
[11] MENG J, STURGIS T F, YOUAN B C. Engineering tenofovir loaded chitosan nanoparticles to maximize microbicide mucoadhesion [J]. Eur J Pharm Sci, 2011, 44: 57-67.
[12] CALVO P, REMUNAN-LOPEZ C, VILA-JATA J L, et al. Novel hydrophilic chitosan polyethylene-oxide nanoparticles as protein carriers [J]. J Appl Polym Sci, 1997, 63: 125-132.
[13] PAN Yan, LI Ying-jian, ZHAO Hui-ying, et al. Bioadhesive polysaccharide in protein delivery system: chitosan nanoparticles improve the intestinal absorption of insulin in vivo [J]. Int J Pharm, 2002, 249: 139-147.
[14] DUNG T H, LEE S R, HAN S D, et al. Chitosan-TPP nanoparticle as a release system of antisense oligonucleotide in the oral environment [J]. J Nanosci Nanotechnol, 2007, 7: 3695-3699.
[15] GAN Q, WANG T, COCHRANE C, et al. Modulation of surface charge, particle size and morphological properties of chitosan-TPP nanoparticles intended for gene delivery [J]. Colloids Surf B Biointerf, 2005, 44: 65-73.
[16] YEH M, CHENG K, HU C, et al. Novel protein-loaded chondroitin sulfate chitosan nanoparticles [J]. Acta Biomaterialia, 2011, 7: 3804-3812.
[17] MITRA S, GAUR U, GHOSH P C, et al. Tumor targeted delivery of encapsulated dextran doxorubicin conjugate using chitosan nanoparticles as carrier [J]. J Control Release, 2001, 74: 317-323.
[18] LI Xiao Xia, XIE Hong Guo, LIN Jun Zhang, et al. Characterization and biodegradation of chitosan alginate polyelectrolyte complexes [J]. Polym Degrad Stab, 2009, 94: 1-6.
[19] LUCINDA-SILVA R M, SALGADO H R N, EVANGELISTA R C. Alginate chitosan systems: In vitro controlled release of triamcinolone and in vivo gastrointestinal transit [J]. Carbohydr Polym, 2010, 81: 260-268.
[20] LIU Bo, LUO Ji Wen, WANG Xiao Ying, et al. Alginate/quaternized carboxymethyl chitosan/clay nanocomposite microspheres: preparation and drug-controlled release behavior [J]. J Biomater Sci Polym Edition, DOI: 10.1080/09205063.2012.701160
[21] VANDENBERG G W, DROLET C, SCOTT S L, et al. Factors affecting protein release from alginate chitosan coacervate microcapsules during production and gastric/intestinal simulation [J]. J Control Release, 2001, 77: 297-307.
[22] WITTAYA-AREEKUL S, KRUENATE J, PRAHSARN C. Preparation and in vitro evaluation of mucoadhesive properties of alginate-chitosan microparticles containing prednisolone [J]. Int J Pharm, 2006, 312: 113-118.
[23] YU Cui Yu, ZHANG Xi Chen, ZHOU Fang Zhou, et al. Sustained release of antineoplastic drugs from chitosan-reinforced alginate microparticle drug delivery systems [J]. Int J Pharm, 2008, 357: 15-21.
[24] MLADENOVSKA K, CRUAUD O, RICHOMMED P, et al, 5-ASA loaded chitosan Ca alginate microparticles: preparation and physicochemical characterization [J]. Int J Pharm, 2007, 345: 59-69.
[25] DODOV M G, CALIS S, CRCAREVSKA M S, et al. Wheat germ agglutinin-conjugated chitosan Ca alginate microparticles for local colon delivery of 5-FU: development and in vitro characterization[J]. Int J Pharm, 2009, 381: 166-175.
[26] GOYCOOLEA F M, LOLLO G, REMUN-LPEZ C, et al. Chitosan-alginate blended nanoparticles as carriers for the transmucosal delivery of macromolecules [J]. Biomacromol, 2009, 10, 1736-1743.
[27] 李国明, 刘 聪, 林 跃, 等. 盐酸阿米替林海藻酸钠壳聚糖微球的制备及释放性能[J]. 应用化学, 2008, 25: 1351-1355.
[28] FINOTELLI P V, SILVA D D, SOLA-PENNA M, et al. Microcapsules of alginate/chitosan containing magnetic nanoparticles for controlled release of insulin [J]. Colloid Surf B Biointerf, 2010, 81: 206-211.
[29] COPPI G, IANNUCCELLI V, LEO E, et al, Chitosan-alginate microparticles as a protein carrier [J]. Drug Dev Ind Pharm, 2001, 27: 393-400.
[30] DE S, ROBINSON D. Polymer relationships during preparation of chitosan alginate and poly-l-lysine alginate nanospheres [J]. J Control Release, 2003, 89: 101-112.
[31] TAQIEDDIN E, AMIJI M. Enzyme immobilization in novel alginate chitosan core-shell microcapsules [J]. Biomaterials, 2004, 25: 1937-1945.
[32] 邢 楠, 田 丰, 刘圣军, 等. 海藻酸钙-壳聚糖微胶囊组成对BSA通透性能影响的研究[J]. 化学学报, 2007, 65: 2952-2958.
[33] LIU Xiu Dong, XUE Wei Ming, LIU Qun, et al. Swelling behaviour of alginate-chitosan microcapsules prepared by external gelation or internal gelation technology [J]. Carbohydr Polym, 2004, 56: 459-464.
[34] BORGES O, SILVA M, DE SOUSA A, et al. Alginate coated chitosan nanoparticles are an effective subcutaneous adjuvant for hepatitis B surface antigen [J]. Inter Immunopharm, 2008, 8: 1773-1780.
[35] GONG Ren Min, LI Cheng Cheng, ZHU Sheng Xue, et al. A novel pH-sensitive hydrogel based on dual crosslinked alginate/N-glutaric acid chitosan for oral delivery of protein [J]. Carbohydr Polym, 2011, 85: 869-874.
[36] DOUGLAS K L, PICCIRILLO C A, TABRIZIAN M. Effects of alginate inclusion on the vector properties of chitosan-based nanoparticles [J]. J Control Release, 2006, 115: 354-361.
[37] RIBEIRO A J, SILVA C, FERREIRA D, et al. Chitosan-reinforced alginate microspheres obtained through the emulsification/internal gelation technique [J]. Eur J Pharm Sci, 2005, 25: 31-40.
[38] TAO Xia, SUN Xue Jun, SU Jing Mei,et al. Natural microshells of alginate-chitosan: unexpected stability and permeability [J]. Polymer, 2006, 47: 6167-6171.
