大孔树脂柱层析法提取蛹虫草废弃培养基中的虫草素
2013-11-21陈作红
曾 昱,陈作红
(湖南师范大学生命科学学院,中国 长沙 410081)
蛹虫草[Cordycepsmilitaris(L.) Link] 又名北冬虫夏草、北虫草,含有多种活性化合物,如虫草素、麦角固醇、甘露醇等,因其容易栽培已成为冬虫夏草的替代品[1-2].虫草素(cordycepin)是蛹虫草的主要活性成分,具有抗肿瘤、抗病毒、抗真菌、免疫调节等药理作用[3-4].目前,虫草素主要从蛹虫草子实体中提取,从而导致虫草素的生产成本极高[5].栽培过蛹虫草的固体培养基中含有丰富的菌丝体,其中含有大量的活性物质,但这些固体培养基常作为废料处理,造成很大的浪费[6-7].
目前,大多数研究采用热水浸提法[8]、索氏提取法[9]、超临界萃取法[10]以及超声波水提法[11]等提取虫草素,但从这些方法得到的虫草素纯度不高,或者投入成本大,难以取得理想结果.刘红锦[12]等对大孔树脂分离纯化蛹虫草中虫草素的工艺进行了研究,考查了7种大孔吸附树脂对蛹虫草中虫草素吸附纯化的效果,再以高效液相色谱 (HPLC)法测定样液中虫草素含量,筛选出适宜的树脂.Ni He[13]等采用一种新的柱层析提取方法——循环柱层析提取法(CCE提取法),对蛹虫草固体培养基中的虫草素进行提取,进一步分离纯化这些提取物,得到了纯度为98%以上的虫草素晶体.
本文以蛹虫草废弃固体培养基为原料,利用热水浸提法和大孔树脂柱层析法分离虫草素,再用聚酰胺树脂进行精制,并优化提取步骤,为后续的扩大试验和规模生产提供参考依据.
1 材料与方法
1.1 材料、试剂与仪器
虫草素标样购自Sigma公司,蛹虫草废弃固体培养基由湖南益康生物高科技有限公司提供.
乙醇(分析级);甲醇(色谱级);超纯水;大孔树脂XAD16,XAD4,XAD7HP,XAD1180(北京慧德易科技有限公司), DM130(青岛利航树脂材料有限公司);聚酰胺树脂(浙江台州路桥四甲生化塑料厂).
Waters 600高效液相色谱仪(Waters公司);YWG C18(4.0 mm×300 mm,10 μm)色谱柱(大连依利特有限公司).
1.2 方法
1.2.1 色谱条件 色谱柱:YWGC18;流速:1 mL/min;检测波长:254 nm;进样量:20 μL;柱温:25 ℃;流动相:15%甲醇;洗脱时间:20 min.所有的样品在进样之前须过0.45 μm滤膜.
1.2.2 标准曲线的制备 取虫草素母液(1 g/L)适量,将其分别配制成0.005,0.025,0.05,0.1,0.25,0.5 g/L共6个梯度,在上述的色谱条件下进样20 μL,以进样量X(μg)与峰面积Y建立线性回归方程.
1.2.3 热水浸提粗提虫草素 采用热水浸提法对蛹虫草废弃固体培养基中的虫草素进行粗提.料液比(W/V),浸提时间和浸提温度是影响虫草素提取的重要因素,本实验设计了一个3因素3水平的正交试验,如表1所示.
1.2.4 大孔树脂柱层析分离纯化虫草素 选用XAD4,XAD16,XAD7HP,XAD1180和DM130 共5种树脂进行静态吸附和解吸附实验,再对筛选出来的树脂进行动态吸附实验,确定最佳洗脱pH值和洗脱剂.
(1)大孔树脂的静态吸附和解吸附 取5 g已预处理的大孔树脂,置于锥形瓶中,分别加入pH3.0,6.0,9.0,12.0的培养基浸提液50 mL,静态吸附24 h,期间定时振荡.HPLC检测滤液中虫草素质量浓度.将上述处理的大孔树脂置于锥形瓶中,分别加入对应pH的40%乙醇30 mL,静态解吸附24 h,期间定时振荡.HPLC检测滤液中虫草素质量浓度.综合静态吸附和解吸附能力,筛选出最合适的大孔树脂.
(2)大孔树脂的动态吸附 取适量预处理后的大孔树脂装入层析柱中,调节pH为3.0,6.0,9.0,12.0,浸提液上样前调至相同的pH,用对应pH的蒸馏水洗脱,再用50 mL对应pH的30%,40%,50%,60%的乙醇溶液(均为体积分数,下同)洗脱,收集乙醇洗脱液,定容至50 mL,HPLC检测洗脱液中虫草素质量浓度,由此得到最佳的洗脱液浓度和洗脱pH值.
1.2.5 虫草素的分离 将预处理后的大孔树脂装入层析柱,调至最佳pH,浸提液上样前调至最佳pH.待吸附至层析柱2/3处时停止上样;用4~5倍柱床体积的蒸馏水洗脱,再用乙醇溶液洗脱,分级收集洗脱液.
活化GF254硅胶板,用虫草素标样与洗脱液点板,在展开剂为V氯仿∶V甲醇=2∶1(每10 mL加2滴氨水)的体系中展开,置于254 nm紫外灯下显色,合并含虫草素的洗脱液.
浓缩洗脱液,加入4倍体积的无水乙醇,充分反应后除去沉淀,浓缩置于4 ℃冰箱中数日,直至析出晶体.用蒸馏水重结晶多次,直至晶体变为纯白.
1.2.6 虫草素的精制 将预处理后的聚酰胺树脂装入层析柱,用蒸馏水溶解虫草素晶体,上样,用2~3倍柱床体积的蒸馏水洗脱,收集洗脱液,浓缩后置于冷冻干燥机内干燥,-20 ℃冰箱内保存.
2 结果与讨论
2.1 回归线性方程
虫草素的标准曲线为y=3 312 350.30x+243 414.61(R2=1.00),线性范围为0.1~10 μg,在此范围内,线性关系良好.在选定的色谱条件下,虫草素的出峰时间为18 min左右.
2.2 优化的热水浸提条件
作者设计了一个3因素3水平正交实验优化热水浸提条件,结果如表1所示.
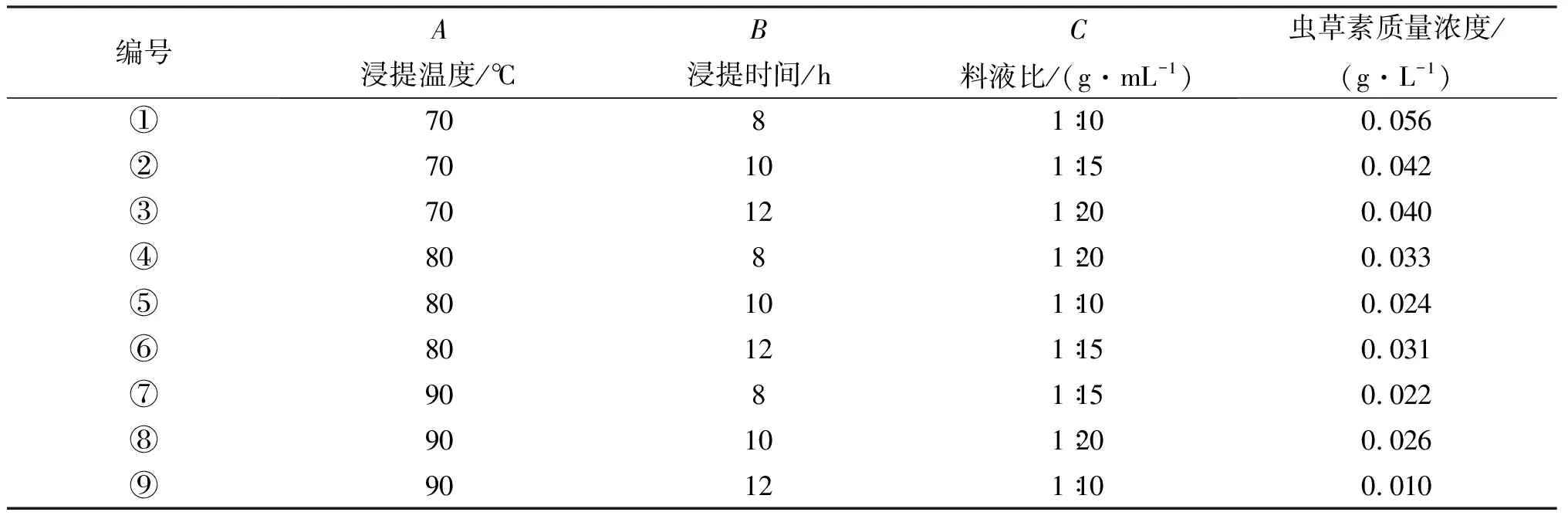
表1 正交试验结果
各因素不同试验水平对虫草素质量浓度的影响如表2所示.

表2 各因素不同试验水平对虫草素提取的影响

根据虫草素的质量浓度,作者选出了浸提实验的最佳条件组合,即浸提温度70 ℃,浸提时间8 h,料液比1 g∶20 mL.
2.3 虫草素的分离
根据5种大孔树脂对虫草素的吸附和解吸附能力对其进行了筛选,结果如图1及图2所示,可以看出, XAD16吸附后滤液中虫草素质量浓度最低, 解吸附后滤液中虫草素质量浓度最高,因此XAD16对虫草素静态吸附能力和解吸附能力最好.不同pH条件下各树脂的吸附和解吸附效果不同, 对于XAD16, pH为9和12时效果最好.

图1 大孔树脂对虫草素的吸附能力Fig.1 Adsorption of cordycepin on different macroporous resins

图2 大孔树脂对虫草素的解吸附能力Fig.2 Desorption of cordycepin on different macroporous resins
应用XAD16进行动态洗脱时,不同浓度的乙醇在不同pH下的洗脱效果如图3.可以看出,当乙醇体积分数为50%和60%,pH为9.0和12.0时,洗脱效果最明显.
综合以上的结果,作者最终选择XAD16树脂作为填料,50%乙醇作为洗脱剂,pH为9.0的柱层析体系对虫草素进行分离.
2.4 虫草素晶体的HPLC检测
按照优化的实验条件对虫草素进行提取和纯化,得到了纯白色晶体产物.HPLC检测虫草素水溶液,纯度达到了98%以上,见图4.

图3 XAD16动态实验Fig.3 Elution of cordycepin by XAD16 macroporous resin
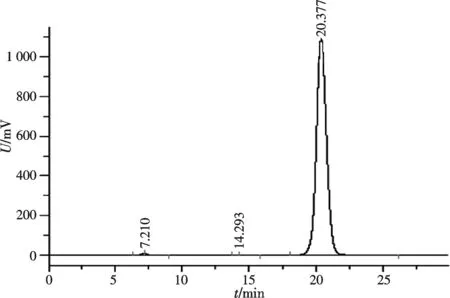
图4 晶体的HPLC分析Fig.4 HPLC analysis of cordycepin crystal
3 结论
本实验以废弃的蛹虫草固体培养基为提取材料,利用优化的热水浸提法,即料液比为1 g∶20 mL,温度70 ℃,浸提时间8 h,对虫草素进行粗提;然后在填料为XAD16树脂,pH9.0,洗脱剂为50%乙醇的层析柱体系中对其分离;再通过浓缩、结晶等步骤,得到了白色晶体;最后通过聚酰胺树脂精制,除去晶体中的残余色素后,得到的虫草素纯度达到了98%以上.本实验操作简单,不需要复杂的仪器设备.下一步将进行扩大实验,较大规模地从废弃的蛹虫草固体培养基中提取虫草素,并进一步确定提取和纯化工艺参数.
参考文献:
[1] DAS S K, MASUDA M, SAKURAI A,etal. Medicinal uses of the mushroomCordycepsmilitaris: Current state and prospects[J].Fitoterapia, 2010,81(8):961-968.
[2] 代君君,范 涛,吴传华,等. 人工栽培蛹虫草研究的概述[J].安徽农业科学, 2007,35(18):5469-5471.
[3] KIM H G, SHRESTHA B, LIM S Y,etal. Cordycepin inhibits lipopolysaccharide-induced in flammation by the suppression of NF-κB through Akt and p38 inhibition in RAW 264.7 macrophage cells[J].Eur J Pharmacol, 2006,545(2-3):192-199.
[4] 蔡友华,刘学铭. 虫草菌素的研究与开发进展[J].中草药, 2007,38(8):2159-2162.
[5] 韦会平,叶小利,张华英,等. 从废弃蛹虫草大米培养基中高效提取纯化虫草素工艺条件研究[J].菌物学报, 2009,28(2):220-225.
[6] 李祥玲,胡劲松,陈作红. HPLC测定人工蛹虫草及其培养基中虫草素和腺苷含量[J].湖南师范大学自然科学学报, 2010,33(2):107-111.
[7] 刘春泉,宋江峰,李大婧,等. 虫草素的提取纯化及测定方法研究进展[J].食品科学, 2007,28(11):569-599.
[8] 张丽艳,张春梅,张凤梅,等. 虫草素水提取工艺的研究[J].安徽农业通报, 2010,16(7):31-33.
[9] 钟艳梅,黄志全,温 凯. 人工蛹虫草固体培养基中虫草素的提取分离研究[J].现代食品科技, 2007,23(2):40-42.
[10] 陈顺志. 一种超临界萃取虫草脱氧核苷的生产方法: 中国,CN1339440[P].2002-03-13.
[11] 王英娟,李多伟,王义潮,等. 蛹虫草中虫草素、虫草多糖综合提取工艺研究[J].西北植物学报, 2005,25(9):1863-1867.
[12] 刘红锦,闫 征,蒋 宁,等.大孔树脂分离纯化蛹虫草中虫草素工艺研究[J].安徽农业大学学报, 2010,37(2):209-213.
[13] NI H, ZHOU X H, LI H H,etal. Column chromatographic extraction and preparation of cordycepin fromCordycepsmilitariswaster medium[J].J Chromatogr B, 2009,877(22):2135-2141.
