不同原料生产赖氨酸的研究进展
2013-11-21王欣许宏贤周鹏段钢
王欣,许宏贤,周鹏,段钢
(杰能科(中国)生物工程有限公司,江苏 无锡,214028)
赖氨酸是人和动物所必须的且自身不能合成的一种氨基酸,是目前全球使用量最大的氨基酸类饲料添加剂,约90%被用作饲料添加剂,约5%用作食品添加剂,其余5%用作医药中间体[1]。
直接发酵法是目前广泛采用的赖氨酸生产方法,目前国内使用该法生产赖氨酸的企业有长春大成集团、聊城希杰、宁夏伊品、山东金玉米、梅花集团、安徽丰原生化等,其中长春大成集团的赖氨酸生产能力已经居于世界前列。国外生产赖氨酸的企业主要有美国ADM公司、德国的Evonik和韩国希杰公司。工业生产中最高产酸率已经提高到180 g/L左右,提取收率也达到90%左右,用于工业大生产的菌株多为谷氨酸棒杆菌、黄色短杆菌、乳糖发酵杆菌等杆菌及其突变株[2]。
在赖氨酸生产中,能够作为碳源的物质很多,有淀粉、糖蜜、葡萄糖、醋酸、苯甲酸、乙醇和烃类等,但是目前实现产业化的只有糖蜜、淀粉和醋酸3种原料路线。中国大部分生产企业都用玉米淀粉作为原料,而随着玉米深加工业的迅速发展,玉米价格也一路上扬,并且国家发改委也对玉米深加工业进行了调整,提出了合理控制工业用玉米量增加的要求,这也对氨基酸生产企业造成了一定的压力[3]。对于工业氨基酸的生产,原料成本是影响整个企业成本的关键,约占50%以上,所以通过各种形式的拓展原料的方法都已经在研究中,比如通过代谢工程的方法寻找更廉价的原料,或者提高原料利用率和转化率。下面以谷氨酸棒杆菌为例,对于各种原料的代谢利用和目前比较关注的改进方向进行了阐述。
1 淀粉糖原料的代谢
1.1 葡萄糖
用发酵法生产赖氨酸,目前国内大部分企业是以玉米淀粉糖化液做原料,而糖化液中95%以上是葡萄糖。葡萄糖的吸收主要依靠PTS(phosphoenol pyruvate transferase system)转运系统(图1),该系统利用两种通常共享的胞质蛋白的组合——磷酸烯醇式丙酮酸依赖性蛋白激酶EI和HPr,它们和离散的膜结合EII蛋白复合物相互作用,EII分别被称为果糖-pts、蔗糖-pts和葡萄糖-pts,它们分别优先转运果糖、蔗糖和葡萄糖[4]。事实上,在谷氨酸棒杆菌中对于葡萄糖的转运除了PTS途径之外还保留着另外一种转运途径IMglu[5],此转运系统中肌醇透性Iol T1和Iol T2起着十分重要的作用,而培养基中的肌醇会诱导谷氨酸棒杆菌中IoI T1和IoI T2的表达。Lindner研究表明,在敲除了谷氨酸棒杆菌中PTS途径中HPr的编码基因之后,iol T1/iol T2和葡萄糖激酶的编码基因ppgK的过表达就能够提高赖氨酸的产量10% ~20%[6]。

图1 糖类的PTS转运系统Fig.1 Sugars uptake PTS system
通过PTS转运系统,葡萄糖进入细胞内并且磷酸化为6-磷酸-葡萄糖。一部分进入PPP途径生产足够的NADPH供赖氨酸合成使用,一部分进入TCA循环,在谷氨酸棒杆菌中,赖氨酸是由天冬氨酸经α,ε-二氨基庚二酸途径合成,合成途径如图2所示。
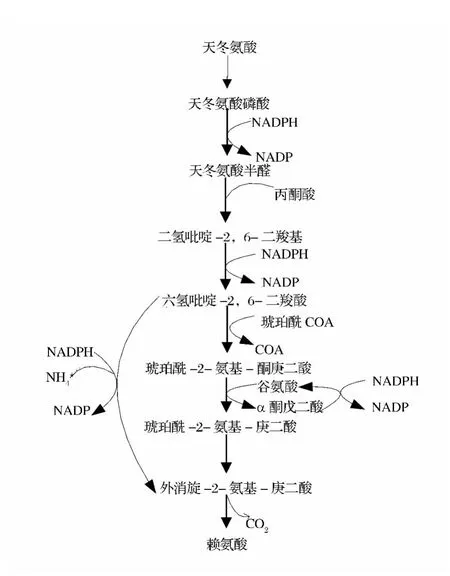
图2 赖氨酸合成途径Fig.2 Lysine synthesis pathway
可以看出,合成赖氨酸必须供应足够的NADPH,谷氨酸棒杆菌利用1 mol丙酮酸、1 mol草酰乙酸和2 mol NH4+,同时利用4 mol NADPH作为还原力开始合成L-赖氨酸[7]。而在细菌中除1 mol的丙酮酸在三羧酸循环中能够产生1 mol的NADPH外,其余的NADPH均要由磷酸戊糖途径(PPP)供给[8]。有研究表明,谷氨酸棒杆菌在以葡萄糖为碳源生成赖氨酸的过程中,大约65%的碳进入磷酸戊糖途径(PPP)用于生产NADPH[9]。在碳代谢产量方面,戊糖磷酸途径在经济上更有利,因为戊糖磷酸途径的2个循环释放1分子 CO2,并伴随产生2分子 NADPH,而每一个TCA循环释放2分子CO2,并伴随产生1分子NADPH。NADPH的主要来源是:PPP途径的葡萄糖-6-磷酸脱氢酶(G6DP)、6-磷酸葡萄糖酸脱氢酶(6PGDH)和TCA循环中的异柠檬酸脱氢酶[10]。
增加NADPH的量可以有效地提高L-赖氨酸合成途径中NADPH依赖性的酶的酶活力,进而提高L-赖氨酸的产量。在棒状杆菌中,NADPH的主要供应途径是TCA循环和戊糖磷酸途径。为了使更多的“C”流进PPP途径,从而提供更多的NADPH,对其基因进行基因改造是一个很好的选择。例如,为了解除G6PD的反馈抑制作用和提高G6PD的表达,通过定点突变,使zwf基因中的243位碱基由A突变成T可以有效解除ATP、磷酸烯醇式丙酮酸和果糖-1,6-二磷酸的抑制作用,增大NADPH的量,从而有效增加L-赖氨酸的量。也可以通过基因组替代方法将zwf基因中的启动子替换成sod中的强启动子,增强zwf基因的表达,从而有效地增加L-赖氨酸的产量[11]。
1.2 果糖
果糖不仅仅是淀粉质原料糖化后的产物之一,也是糖蜜原料中除了蔗糖之外的另一主要组成部分,一般在10%~20%,故果糖的有效代谢对原料的利用率是非常重要的。但是Kiefer等研究发现,在以果糖为唯一碳源时,赖氨酸产量会比以葡萄糖为唯一碳源少30%左右,同时菌体生物量也会少20%左右[12],认为谷氨酸棒杆菌中果糖的代谢与葡萄糖的代谢是十分不同的。当野生型谷氨酸棒状杆菌在果糖中生长时,认为90%的果糖会通过果糖-PTS系统进入细胞生成果糖-1-磷酸,然后再经磷酸化生成果糖-1.6-二磷酸,而果糖-1,6-二磷酸不经过PPP途径,很大一部分是因为6-磷酸果糖激酶主要是不可逆酶,因此,果糖-1,6-二磷酸将优先进入糖酵解和TCA循环。约10%的进入谷氨酸棒状杆菌的果糖被认为以果糖-6-磷酸的形式被葡萄糖PTS系统摄入[13],果糖-6-磷酸在葡萄糖-6-磷酸异构酶的作用下直接进入PPP途径,综上所述在以果糖为碳源时,只有一小部分进入PPP 途径生产还原力NADPH,Kiefer等人[9]利用C13标记的方法对以葡萄糖和果糖为碳源的代谢流进行了研究,发现在以果糖为碳源时进入PPP途径的C代谢流仅仅为14.4%,远远少于以葡萄糖为碳源时进入PPP途径的C代谢流(62.0%),NADPH的供应量也远远少于以葡萄糖为碳源时的供应量,并且由此导致副产物二羟基丙酮、甘油和乳酸的增加,所以赖氨酸的产量会比以葡萄糖为唯一碳源时少很多。
基于许多研究者的经验和自己的研究成果,Kiefer总结了对于以果糖为原料时增加赖氨酸产量的几种方法[9]:(1)改善果糖的运输途径,尽量增加通过葡萄糖PTS转运途径的比例,通过果糖6-磷酸进入PPP途径,增加NADPH还原力;(2)增加果糖1,6-二磷酸酶的活力,使果糖1,6-二磷酸水解为果糖-6-磷酸,然后异构为葡萄糖-6-磷酸进入PPP途径,增加NADPH还原力;(3)敲除以果糖为碳源时的主要副产物二羟基丙酮的磷酸酶活激酶的编码基因,减少分支代谢流。
1.3 麦芽糖
麦芽糖是由2个D-葡萄糖分子通过α构型的1,4键连接起来的双糖,是淀粉液化和糖化不完全的水解产物,已经有研究表明谷氨酸棒杆菌可以有效的利用以麦芽糖为唯一碳源的培养基中生长并生产氨基酸[14],其代谢途径一般是认为通过在4-α-葡聚糖转移酶(由cg2523编码)的催化下产生麦芽糊精和葡萄糖,产生的葡萄糖在葡萄糖磷酸化酶(glK)的催化下进入糖代谢,而产生的麦芽糊精在麦芽糊精磷酸化酶(malP)的催化作用下降解产生葡萄糖-1-磷酸,然后在葡萄糖磷酸变位酶的作用下生成葡萄糖-6-磷酸进入糖代谢[15]。有研究表明,glK和malP的失活会严重影响谷氨酸棒杆菌在麦芽糖为唯一碳源培养基上生长[16]。但是到目前为止,麦芽糖在谷氨酸棒杆菌中的转运途径并不十分明确,虽然在麦芽糖上的生长需要PTS-EI的酶活力,而PTS转运系统的其他酶的失活并不影响麦芽糖的转运。所以通过麦芽糖-H+同向转运或者通过ATP结合转运子转运是很有可能的。
2 糖蜜原料的代谢
糖蜜原料以其低廉的成本和丰富的来源正受到越来越多生产厂家的关注。甘蔗糖蜜和甜菜糖蜜是很好的发酵原料,而糖蜜的主要组成是蔗糖。
蔗糖的转运吸收如图3所示也是通过PTS系统转运和磷酸化为6-磷酸-蔗糖,然后在6-磷酸-蔗糖水解酶的作用下水解为6-磷酸-葡萄糖和果糖。事实上在谷氨酸棒杆菌中的ptsS(编码蔗糖特异性透性酶EIIABC)或者scrB(编码6-磷酸-蔗糖水解酶)染色体的失活可以造成谷氨酸棒杆菌在以蔗糖为唯一碳源的培养基上的不生长[17-18]。在谷氨酸棒杆菌中并没有果糖激酶活力,但是水解的果糖磷酸化是进行以后代谢的先决条件,所以一般在谷氨酸棒杆菌中水解后产生的果糖会从细胞中分泌出,然后通过果糖-PTS摄入系统并磷酸化为果糖-1-磷酸进入代谢,果糖的代谢我们在前面已经进行了阐述。

图3 谷氨酸棒杆菌中各种糖类的转运和代谢汇总Fig.3 The overview of carbon source uptake and metabolic pathway
在以蔗糖为碳源时,一般认为只有很小百分比的碳进入PPP途径,而其他的碳作为果糖-1,6-二磷酸进入糖酵解途径,故以蔗糖为碳源赖氨酸的产率并不如以葡萄糖为碳源,许多研究者希望通过加强果糖进入PPP途径代谢的方式来增加以蔗糖为碳源时赖氨酸的产量[19]。一方面,可以通过使用在编码果糖——PTS酶的ptsF基因上具有突变的菌株,使得果糖-PTS酶衰减或阻断果糖输入细胞,来实现由谷氨酸棒状杆菌生产的赖氨酸产量的提高,并且通过在发酵培养基中提供葡萄糖异构酶来提高产量,葡萄糖异构酶可以外源方式添加,也可以在菌株中表达并输出到培养基中。另一方面,可通过制备具有ptsF突变和在果糖输出蛋白功能中的第二突变的谷氨酸棒状杆菌来实现赖氨酸产量的提高,双突变将输入的果糖保留在细胞内,并且还在细胞内过量表达葡萄糖异构酶和葡萄糖激酶活性中的至少一种,以驱动输入的果糖去往PPP途径来提高L-赖氨酸产量。
3 新型原料的开发
3.1 纤维质原料的开发
考虑到国家对粮食用于工业生产的限制和原料成本的压力,企业和研究者对新原料的探寻一直没有停止过,植物木质纤维素就被认为是一个非常有前途的粮食替代者[20],不仅价格低廉,并且具有来源丰富,品种多,可再生时间短的特点。木质纤维素包括纤维素、半纤维素和木质素,其水解液是含有葡萄糖、半乳糖、甘露糖、木糖、阿拉伯糖和纤维二糖的混合液,所以戊糖的代谢对于纤维质用于氨基酸的发酵生产十分重要。
对于核糖的代谢应该存在于大部分谷氨酸棒杆菌中,核糖通过具有核糖特异性的ATP-结合转运子ABCrib(被rbsACBD编码)转运至细胞内。有研究表明,在缺失了rbsACBD的谷氨酸棒杆菌突变体SN1完全失去了利用核糖的能力,并且不能够在以核糖为唯一碳源的培养基上生长[21]。细胞内的核糖会被核糖激酶(RbsK1和RbsK2)催化生成PPP途径的中间产物5-磷酸-核糖,然后进入代谢。
除了谷氨酸棒杆菌ATCC31831,一般的赖氨酸产生菌不能够直接利用阿拉伯糖为碳源,有研究把大肠杆菌中分别负责编码阿拉伯糖异构酶、核酮糖激酶,5-磷酸-核酮糖异构酶的基因片段 araA,araB,araD,在谷氨酸棒杆菌中异源表达构建成基因工程菌,使阿拉伯糖异构并磷酸化为5-磷酸-木酮糖,然后进入PPP途径。但是在谷氨酸棒杆菌ATCC31831存在着编码阿拉伯糖代谢的基因簇(araE,araA,araB,araD),能够在以阿拉伯糖为唯一碳源的培养基中生长,而且它的生长速率是在同浓度葡萄糖培养基中的 2 倍[22-23]。
目前,大多的谷氨酸棒杆菌都不能直接以木糖为碳源,有报道称一个尚未定义的转运体(IMxyl)参与C.glutamicum R 对木糖的摄取[24-25]。有研究[26]把大肠杆菌中负责编码木糖异构酶的基因片段xylA和木酮糖激酶基因xylB在C.glutamicum R中异源表达构建成基因工程菌,能够直接利用木糖为碳源,木糖在C.glutamicum R中通过IMxyl转运体系进入细胞,然后直接被木糖异构酶(XI)异构为木酮糖,生成的木酮糖被木酮糖激酶(XK)磷酸化生成木酮糖-5-磷酸,进入PPP途径。
Gopinath等人[27]就通过构建基因工程菌把代谢戊糖的基因在谷氨酸棒杆菌中表达,构建的基因工程菌能够直接利用阿拉伯糖和木糖,并且能够利用大米秸秆和小麦麦麸水解液作为底物,生产赖氨酸,产量有42 mmol/L。
以纤维素为碳源发酵产赖氨酸还处于理论研究阶段,其赖氨酸产量也不能和糖质原料相比。基因工程菌也存在底物利用率低,酶活力不高等一些问题。如何提高酶与底物的亲和力以及提高酶活性从而增强产赖氨酸的代谢途径,是接下来要解决的问题。
3.2 工业副产物原料的开发
有许多研究者试图寻找其他的原料或者工业生产副产物来生产赖氨酸,Rittmann等[28]研究证明,通过基因工程技术构建的谷氨酸棒杆菌可以利用甘油产生赖氨酸,甘油是生物柴油生产中的主要副产物,而赖氨酸生产菌不能直接利用甘油,通过基因工程技术把大肠杆菌中控制表达甘油激酶和3-磷酸甘油脱氢酶的基因 glpD、glpK、glpF在谷氨酸棒杆菌中表达,使其能够在以甘油为唯一碳源的环境中生长并且产生赖氨酸。
乳清是乳产品行业的主要废弃物,其中含有5%以上的乳糖,而谷氨酸棒杆菌并没有能够分解乳糖的一系列酶,所以谷氨酸棒杆菌并不能分解利用乳糖。通过基因工程技术把在乳酸链球菌中控制表达的分解乳糖的一系列酶的基因(醛糖-1-差向异构酶,半乳糖激酶,UDP-葡萄糖-磷酸酯尿苷基转移酶,UDP-半乳糖-差向异构酶)在谷氨酸棒杆菌中表达[29],除此之外,还有控制乳糖透性酶表达的基因。虽然到目前用这种方法构建的基因工程菌的发酵效率和赖氨酸产率都比较低,但是随着分子技术的发展相信在不久的将来会越来越好。
4 现有原料新技术的开发
除了对非粮原料的探寻之外,节能减排也是国家鼓励和倡导的。对于淀粉质原料来说,氨基酸产生菌一般不能直接利用淀粉,所以淀粉需要经过一系列的分解反应变为可发酵型糖,这个过程中需要经过高温蒸煮液化和长时间的糖化工序,整个过程需要大量的热量,并且需要多次调节pH以便于酶的作用,所以有许多学者对于谷氨酸棒杆菌直接利用淀粉生产赖氨酸进行了研究,但是谷氨酸棒杆菌不能直接利用淀粉作为碳源,这就需要把分解淀粉需要的酶系在谷氨酸棒杆菌中异源表达,使其分解为谷氨酸棒杆菌可以利用的糖。
Seibold等人[30]通过把灰色链霉菌中的负责表达α-淀粉酶调控基因amy在谷氨酸棒杆菌DM1730中表达,能够产生足够高活力的淀粉酶,并且在淀粉培养基中能够生长。Tateno等人也[31-32]通过把链球菌中α-淀粉酶调控基因通过同源重组方法转移到氨基酸生产菌的染色体上的方法,使其表达产生胞外α-淀粉酶,并且能够在以淀粉为唯一碳源的培养基中生长,赖氨酸产量也达到了0.19 g/g淀粉。但是构建基因工程菌直接利用淀粉还存在着在培养基中超过35%的淀粉碳源没有被利用掉的问题[30],造成了原料利用率低和赖氨酸产率低。
工业界也在探讨是否可以直接利用全玉米去胚之后液化、制糖,然后直接进行赖氨酸发酵的可能,这样可以减去淀粉乳制备的繁杂过程,减少能源的消耗。随着新型酶制剂的应用,应该有可能在同一pH下液化制糖和发酵,省去调节pH的原料的消耗,这样既能简化生产工艺,又能减少生产成本。
5 展望
碳源的费用、糖酸转化率、提取收率和整个过程的生产效率是发酵法生产大宗氨基酸产品如味精和赖氨酸的经济性的决定性因素,国内虽然赖氨酸价格的涨幅较大,但生产厂家的利润并未因此增加,其主要原因是原料成本和物流费用的增加。随着国产赖氨酸技术不断改进,将会使产量增加,成本降低,质量改善,功能增强,酶活性提高,从而实现L-赖氨酸最大积累,在满足我国对L-赖氨酸的不断需求的同时进一步开拓国际市场。
[1]周伟.浅谈赖氨酸行业现状和发展趋势[J].发酵科技通讯,2007(03):31-35.
[2]刘晓飞,高学军,刘营,等.微生物产赖氨酸的研究进展[J].东北农业大学学报,2010(01):157-160.
[3]尤新.我国玉米深加工行业转型升级的发展道路[J].粮食加工,2011(04):1-4.
[4]Jojima T,Omumasaba C A,Inui M,et al.Sugar transporters in efficient utilization of mixed sugar substrates:current knowledge and outlook[J].Applied Microbiology and Biotechnology,2010,85(3):471-480.
[5]Gourdon P,Raherimandimby M,Dominguez H,et al.Osmotic stress,glucose transport capacity and consequences for glutamate overproduction in Corynebacterium glutamicum[J].Journal of Biotechnology,2003,104(1):77-85.
[6]Lindner S N,Seibold G M,Henrich A,et al.Phosphotransferase system-independent glucose utilization in Corynebacterium glutamicum by inositol permeases and glucokinases[J].Applied and Environmental Microbiology,2011,77(11):3 571-3 581.
[7]张伟国,徐建中.L-赖氨酸合成代谢中NADPH代谢的研究进展[J].食品与生物技术学报,2012,31(10):99-107.
[8]Becker J,Klopprogge C,Zelder O,et al.Amplified expression of fructose 1,6-bisphosphatase in Corynebacterium glutamicum increases in vivo flux through the pentose phosphate pathway and lysine production on different carbon sources[J].Applied and Environmental Microbiology,2005,71(12):8 587-8 596.
[9]Kiefer P,Heinzle E,Zelder O,et al.Comparative metabolic flux analysis of lysine-producing Corynebacterium glutamicum cultured on glucose or fructose[J].Applied and Environmental Microbiology,2004,70(1):229-239.
[10]Wittmann C,Becker J.The L-lysine story:from metabolic pathways to industrial production[J].In Amino Acid Biosynthesis Pathways,Regulation and Metabolic Engineering,2007,Springer:39-70.
[11]Becker J,Klopprogge C,Herold A,et al.Metabolic flux engineering of l-lysine production in Corynebacterium glutamicum over expression and modification of G6P dehydrogenase[J].Journal of Biotechnology,2007,132(2):99-109.
[12]Kiefer P,Heinzle E,Wittmann C.Influence of glucose,fructose and sucrose as carbon sources on kinetics and stoichiometry of lysine production by Corynebacterium glutamicum[J].Journal of Industrial Microbiology and Biotechnology,2002,28(6):338-343.
[13]Dominguez H,Rollin C,Guyonvarch A,et al.Carbon‐flux distribution in the central metabolic pathways of Corynebacterium glutamicum during growth on fructose[J].European Journal of Biochemistry,1998,254(1):96-102.
[14]Seibold G M,Wurst M,Eikmanns B J.Roles of maltodextrin and glycogen phosphorylases in maltose utilization and glycogen metabolism in Corynebacterium glutamicum[J].Microbiology,2009,155(2):347-358.
[15]Krause F S,Henrich A,Blombach B,et al.Increased glucose utilization in Corynebacterium glutamicum by use of maltose,and its application for the improvement of L-valine productivity[J].Applied and environmental microbiology,2010,76(1):370-374.
[16]Park S Y,Kim H K,Yoo S K,et al.Characterization of glk,a gene coding for glucose kinase of Corynebacterium glutamicum[J].FEMS Microbiology Letters,2000,188(2):209-215.
[17]Moon M W,Kim H J,Oh T K,et al.Analyses of enzyme II gene mutants for sugar transport and heterologous expression of fructokinase gene in Corynebacterium glutamicum ATCC 13032[J].FEMS Microbiology Letters,2005,244(2):259-266.
[18]Engels V,Georgi T,Wendisch V F.ScrB(Cg2927)is a sucrose-6-phosphate hydrolase essential for sucrose utilization by Corynebacterium glutamicum[J].FEMS Microbiology Letters,2008,289(1):80-89.
[19]汉克P D,宾 T P.在谷氨酸棒状杆菌中从蔗糖生产氨基酸的方法[P].CN,101855357 A.2008.
[20]石维忱.生物制造产业“十二五”时期发展展望[J].北京工商大学学报:自然科学版,2011(5):1-5.
[21]Nentwich S S,Brinkrolf K,Gaigalat L,et al.Characterization of the LacI-type transcriptional repressor RbsR controlling ribose transport in Corynebacterium glutamicum ATCC 13032[J].Microbiology,2009,155(1):150-164.
[22]Kawaguchi H,Sasaki M,Vertès A A,et al.Identification and functional analysis of the gene cluster for L-arabinose utilization in Corynebacterium glutamicum[J].Applied and Environmental Microbiology,2009,75(11):3 419-3 429.
[23]叶菁,许敬亮,肖波,等.谷氨酸棒杆菌戊糖代谢利用研究进展[J].中国生物工程,2012(11):138-142.
[24]Sasaki M,Jojima T,Kawaguchi H,et al.Engineering of pentose transport in Corynebacterium glutamicum to improve simultaneous utilization of mixed sugars[J].Applied Microbiology and Biotechnology,2009,85(1):105-115.
[25]Yukawa H,Omumasaba C A,Nonaka H,et al.Comparative analysis of the Corynebacterium glutamicum group and complete genome sequence of strain R[J].Microbiology,2007,153(4):1 042-1 058.
[26]Kawaguchi H,Vertès A A,Okino S,et al.Engineering of a xylose metabolic pathway in Corynebacterium glutamicum[J].Applied and environmental microbiology,2006,72(5):3418-3428.
[27]Gopinath V,Meiswinkel T M,Wendisch V F,et al.A-mino acid production from rice straw and wheat bran hydrolysates by recombinant pentose-utilizing Corynebacterium glutamicum[J].Applied Microbiology and Biotechnology,2011,92(5):985-996.
[28]Rittmann D,Lindner S N,Wendisch V F.Engineering of a glycerol utilization pathway for amino acid production by Corynebacterium glutamicum[J].Applied and environmental microbiology,2008,74(20):6 216-6 222.
[29]Barrett E,Stanton C,Zelder O,et al.Heterologous expression of lactose-and galactose-utilizing pathways from lactic acid bacteria in Corynebacterium glutamicum for production of lysine in whey[J].Applied and Environmental Microbiology,2004,70(5):2 861-2 866.
[30]Seibold G,Auchter M,Berens S,et al.Utilization of soluble starch by a recombinant Corynebacterium glutamicum strain:Growth and lysine production[J].Journal of Biotechnology,2006,124(2):381-391.
[31]Tateno T,Fukuda H,Kondo A.Production of L-lysine from starch by Corynebacterium glutamicum displaying αamylase on its cell surface[J].Applied Microbiology and Biotechnology,2007,74(6):1 213-1 220.
[32]Tateno T,Fukuda H,Kondo A.Direct production of L-lysine from raw corn starch by Corynebacterium glutamicum secreting Streptococcus bovis α-amylase using cspB promoter and signal sequence[J].Applied microbiology and biotechnology,2007,77(3):533-541.
