α-生育酚在花生油、芝麻油和菜籽油中的抗氧化效能*
2013-11-21朱雪梅吴俊锋胡蒋宁赵士强胡振瀛熊华
朱雪梅,吴俊锋,胡蒋宁,赵士强,胡振瀛,熊华
1(南昌大学食品科学与技术国家重点实验室,江西南昌,330047)2(南昌大学生命科学与食品工程学院,江西 南昌,330031)3(华南理工大学轻工与食品学院,广东广州,510640)
油脂是食品的重要组分之一,为人类营养、健康所必需。但是食用油极易发生氧化,油脂氧化所生成的氧化产物不仅影响油脂食品的风味、色泽、营养价值,还会对膜、酶、蛋白质造成破坏,诱发癌症等多种疾病[1]。为防止油脂氧化可采用密封、避光、低温或充入惰性气体保藏,但要求条件高,对批量的食用油和富含油脂的食品较难做到,目前最简便有效的方法是添加抗氧化剂。
现在我国通用的抗氧化剂主要是叔丁基羟基茴香醚(BHA)、二叔丁基羟基甲苯(BHT)、叔丁基苯二酚(TBHQ)等合成抗氧化剂。然而有研究报告指出这类化合物有害身体健康特别是引起癌症和心血管疾病[2-3],日本和韩国已禁止使用BHT和BHA,美国也已经禁止使用BHT[4]。因此用天然抗氧化剂代替合成抗氧化剂是我国油脂行业发展的必然趋势。
生育酚是植物油脂中普遍存在的天然抗氧化剂。它最主要抗氧化途径是向脂氧自由基或脂过氧自由基提供H,使链式氧化反应中断;其次,其本身具有产生酚氧基的结构,产生的酚氧基能够粹灭并能同单酰态氧反应,保护脂肪酸中的不饱和键免受单线态氧损伤;再者,生育酚本身被自由基氧化,避免不饱和键受自由基的进攻来抑制油脂氧化[5-6]。同其他抗氧化剂一样,生育酚的抗氧化效能不仅受光、热、和氧气浓度等外部因素影响,还受油脂结构的影响,不同脂肪酸组成的油脂氧化稳定性不同,生育酚的抗氧化效能不同,最佳抗氧化浓度也有差异,因此欲以天然生育酚代替合成抗氧化剂,必须从不同油脂中生育酚抗氧化效能出发研究生育酚的抗氧化规律。
本课题通过Schaal烘箱氧化实验,研究不同浓度生育酚对氧化过程中菜籽油、芝麻油和花生油的氧化值、酸价、茴香胺值和总氧化值(TOTOX)的抗氧化性能,探讨脂肪酸组成与油脂氧化稳定性的关系,脂肪酸组成对生育酚抗氧化效能的影响,初步了解油脂氧化及生育酚抗油脂氧化的规律。
1 材料与方法
1.1 实验原料、试剂
实验材料:芝麻油,花生油,菜籽油,当地超级市场;α-生育酚标准品,Sigma公司。
实验试剂:碘化钾、硫代硫酸钠、无水乙醇,天津市大茂化学试剂厂;三氯甲烷、冰乙酸,成都市科龙化工试剂厂;茴香胺,国药集团化学试剂有限公司;淀粉,天津市永大化学试剂有限公司;乙醚、无水乙醚、异辛烷,天津恒兴化学试剂制造有限公司(以上试剂均为分析纯);脂肪酸甲酯标准品GLC-461:美国Nu-Chekprep公司;正己烷、异辛烷,色谱纯,美国天地公司。
1.2 仪器和设备
HP6890气相色谱仪配有自动进样器和火焰离子化检测器,美国Agilent公司;DHG-9240型电热恒温鼓风干燥箱,江西鼎技科学仪器有限公司;HH-S4型电热恒温水浴锅:上海博迅实业有限公司医疗设备厂;BS 224S型电子天平,赛多利斯科学仪器(北京)有限公司;紫外可见分光光度计,北京普析通用仪器有限责任公司;WSL-2型比较测色仪,上海申光仪器仪表有限公司 ;RW20顶置式搅拌器、RV10旋转蒸发仪,德国IKA集团;电子万用炉,北京永光明医疗仪器厂。
1.3 实验方法
1.3.1 食用油的预处理
各称取500 g油样,加入5%(质量比)的工业白土和5%硅藻土脱色,室温下磁力搅拌20 min,抽滤,3 000 r/min的条件下离心10 min后吸取上层油样,离心去除残余白土,油样充氮密封保存。
1.3.2 脂肪酸组成分析
称取50 mg样品,加入1.5 mL 0.5 mol/L甲醇钠,充分混合后在95℃反应3 min,冷却,再加入2 mL BF3(三氟化硼)甲醇溶液(10%)继续在95℃下反应2 min,冷却后加入1 mL饱和NaCl和2 mL异辛烷,提取脂肪酸甲酯经过无水硫酸钠干燥后用于气相(GC)分析。
GC分析条件:分析柱使用CP-Sil88石英毛细管柱;载气为H2;进样口温度为250℃;程序升温:45℃下保持 4 min,再以13℃/min的速度升温至175℃,并保持27 min,然后再以4℃/min的速度升温至215℃,并保持35 min,检测时间86 min。利用面积归一法得到各个脂肪酸的相对百分含量。
1.3.3 样品的准备及生育酚抗氧化实验[7-9]
配制系列浓度的单一α-生育酚的乙醇溶液置于冰箱中备用。每种植物油各取6个规格一致的100 mL的烧杯,各称取50 g处理后的样,加入不同浓度的生育酚溶液,使α-生育酚在植物油中的浓度分别为25、50、100、200、400 mg/kg。对照样仅加入同量的乙醇溶剂。样品及对照样充分搅拌30 min后,在60℃加热下用氮气吹干乙醇溶剂。
Schaal烘箱氧化实验[9]:烘箱温度设为(60 ±1)℃,准备好的植物油样品或对照(50 g)置于100 mL 烧杯中,按照一定时间段(如 0,5,10,15,20,25,30,38 d)取样分析。
1.3.4 不皂化物、过氧化值、酸价和茴香胺值的测定[8,10-11]
按GB/T 5535.2-2008《动植物油脂 不皂化物测定第二部分:己烷提取法》测定不皂化物;按GB/T 5530-2005《动植物油脂酸值和酸度测定》测定酸价;过氧化值的测定,按GB/T 5538-2005《动植物油脂过氧化值的测定》测定过氧化值(POV)。茴香胺值(p-AV)的测定方法如下,首先称取0.5 g的油样置于25 mL容量瓶中,用异辛烷溶解并稀释到刻度成为未反应溶液,用移液管吸取未反应溶液5 mL置于10 mL试管中,另一试管加入5mL异辛烷溶剂,分别加入1 mL p-茴香胺冰乙酸溶液(准确称取0.25 g p-茴香胺置于100 mL容量瓶中,用冰乙酸定容)。10 min后,在350 nm处分别测定上述溶液吸光度A0和A1。

其中:V,溶解试样的体积,mL;m,油样的质量,g;Q,以茴香胺值为表达基础,测定溶液中样品量,g/mL,本文Q=0.01 g/mL;A0:未反应溶液吸光度;A1:反应溶液吸光度。
1.3.5 总氧化值的计算[12]
总氧化值(TOTOX)是2倍的POV加上p-AV,是经常用来表征油脂氧化程度的一个指标。总氧化值(TOTOX)衡量总氧化程度和生育酚的抗氧化效能,其中 TOTOX=2×POV+p-AV。
2 结果与讨论
2.1 不皂化物含量

图1 花生油、芝麻油和菜籽油的预处理对不皂化物值的影响Fig.1 The effects of pretreatment on peanut oil,sesame oil and rapeseed oil on unsaponiable matter
不皂化物主要是指脂溶性维生素、甾醇、多酚类化合物、萜类、萜烯醇类化合物。不皂化物中的天然抗氧化成分如脂溶性维生素和多酚类化合物会对油脂的氧化有一定的延迟作用。从图1可以发现预处理后的花生油、芝麻油和菜籽油的不皂化物比未处理的有所降低,但是大部分不皂化物残留在油中,表示预处理不彻底,还需寻找更好的方法如多层柱层析法。处理后芝麻油(0.011 63%)的不皂化物含量最高,花生油(0.005 04%)和菜籽油(0.005 02%)的不皂化物含量无明显差异。
2.2 脂肪酸组成分析
气相色谱分析结果(表1)表明,花生油、菜籽油和芝麻油的主要不饱和脂肪酸是油酸和亚油酸。但花生油中除了油酸和亚油酸外,含超长链脂肪酸如C22∶0和 C24∶0,总的饱和脂肪酸最高,含量高达20.69%;芝麻油中亚油酸最多(44.67%);菜籽油含油酸(64.48%)最多,且α-亚麻酸含量为5.96%,高于花生油(1.37%)和芝麻油(0.42%)。计算3种油的双键相对值为:芝麻油(131.39)>菜籽油(120.92)>花生油(109.60),根据“高碘值双键氧化理论”,可推断3种油的氧化容易程度为:芝麻油>菜籽油>花生油,即不饱和度越高的油脂越易氧化。

表1 花生油、芝麻油和菜籽油的脂肪酸组成(面积%)Table 1 The fatty acid composition of peanut oil,sesame oil and rapeseed oil(area%).
2.3 过氧化值
过氧化值表示油脂初级氧化产物氢过氧化物的含量,反映油脂初期氧化程度。从图3看出在38 d的氧化试验中,芝麻油的过氧化值增长幅度最小,氧化38 d后芝麻油对照(0 α-生育酚)POV值是12.57 meq O2/kg,明显低于花生油(332.02 meq O2/kg)和菜籽油(325.71 meq O2/kg)。而且芝麻油中,在氧化初期各浓度生育酚均无明显的抗氧化作用,直至氧化30 d,25 ppm的α-生育酚逐渐起抗氧化作用,而其他浓度的生育酚不仅无显著抗氧化作用,还促进芝麻油氧化,例如氧化38 d 后分别添加25,50,100,200,400 ppm的生育酚的芝麻油的 POV值分别为 7.33、16.25、13.18、13.60、23.59 meq O2/kg。

图2 添加不同浓度生育酚对芝麻油、花生油和菜籽油过氧化值的影响Fig.2 Addition of different amounts of α-tocopherol on the POV of peanut oil,sesame oil and rapeseed oil
与芝麻油不同的是,花生油和菜籽油的POV一直缓慢上升,在30 d后POV值成对数增长趋势。不同浓度的α-生育酚的抗氧化效能也是不同的。在菜籽油中,添加了200 mg/kg的α-生育酚的POV值最低,表明200 mg/kg的α-生育酚在菜籽油中的抗氧化能力最强,25~100 mg/kg的α-生育酚有抗氧化作用,且抗氧化作用随α-生育酚浓度增加而增强,但400 mg/kg的α-生育酚有明显的促进氧化的作用;在花生油中,25 mg/kg的α-生育酚抑制POV值的效果高于其他浓度,但各浓度的α-生育酚均有抗POV上升的作用。这些结果说明,在不同油脂中生育酚的抗氧化效能也是不同的。
2.4 酸价
酸价表示游离脂肪酸的含量,反应甘油三酯酸败水解程度。如图3所示,酸价的变化趋势与POV值类似,即在氧化初期,酸值缓慢增加,氧化30 d后以几何对数增加。3种油中,芝麻油最稳定,菜籽油和花生油的酸价较高,生育酚抑制3种油酸价的规律与抑制POV一致。
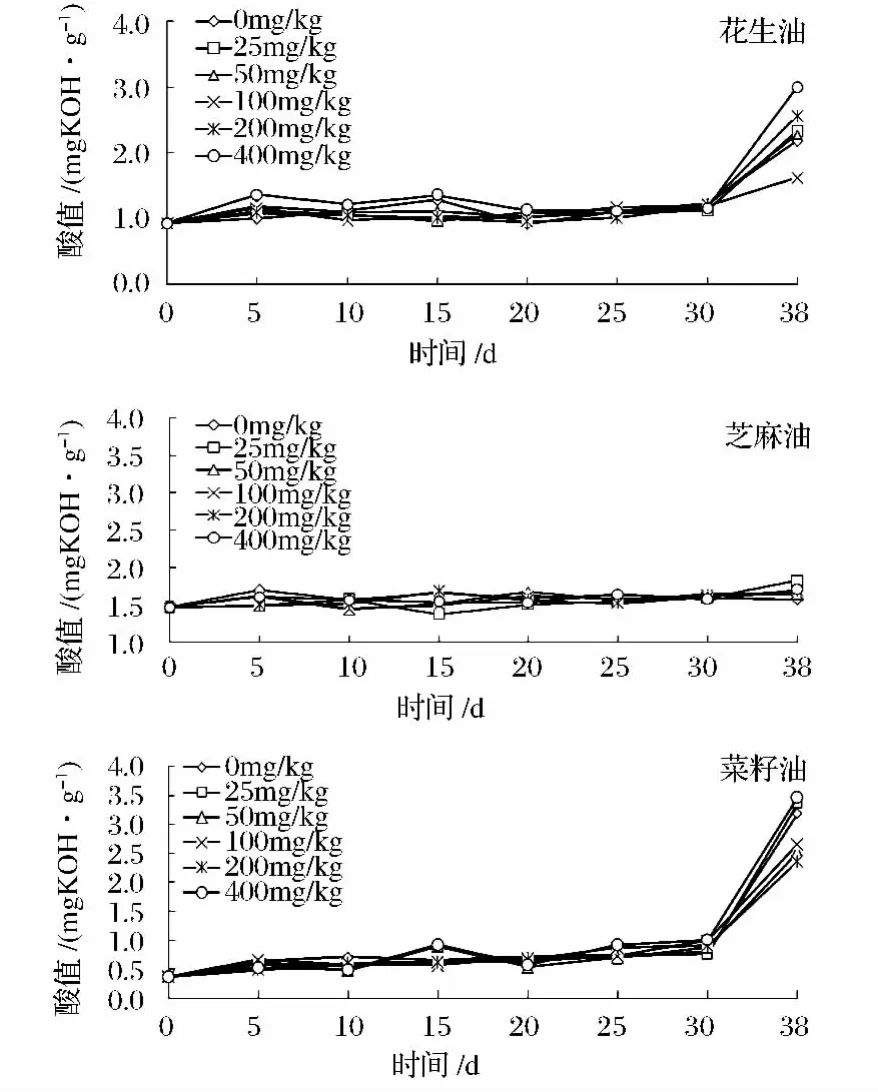
图3 添加不同浓度生育酚对芝麻油、花生油和菜籽油酸价的影响Fig.3 Addition of different amounts of α-tocopherol on the acid value of peanut oil,sesame oil and rapeseed oil
2.5 茴香胺值
氢过氧化物等初级氧化产物不稳定,在高温下易分解生成次级氧化产物,茴香胺值(p-AV)表示植物油中的次级氧化产物中羰基化合物的含量,羰基化合物与茴香胺生成的有色物在350 nm处有最大吸收值,如果茴香胺值超过10就表明食用油已严重变质,其数值越大,油脂的劣变程度越严重。由图4可知,茴香胺值的变化趋势与POV、酸价增长趋势一致。但是不同于POV的是,在菜籽油中,400 mg/kg和200 mg/kg的α-生育酚有效地的抑制茴香胺值,花生油中,100 mg/kg的α-生育酚抑制茴香胺值的能力最强,200和400 mg/kg的α-生育酚均有促进茴香胺值增加的作用。
2.6 总氧化值

图4 添加不同浓度生育酚对芝麻油、花生油和菜籽油茴香胺值的影响Fig.4 Addition of different amounts of α-tocopherol on the p-anisidine value of peanut oil,sesame oil and rapeseed oil
总氧化值涵括了初级氧化产物含量和次级氧化产物茴香胺值,用来综合表征油脂氧化程度的一个指标。与POV值和茴香胺值相比,不同浓度生育酚在3种油中的抑制TOTOX的规律更加明显,但总的增长趋势同POV、酸价、茴香胺值一致。由图5可知,在花生油中,100 mg/kg的α-生育酚抑制TOTOX值的效果最佳,而菜籽油中则200 mg/kg的α-生育酚的TOTOX最低,在芝麻油中25 mg/kg的α-生育酚抑制TOTOC的效能最佳。且在3种油中,当α-生育酚浓度低于最佳抗氧化浓度时,α-生育酚浓度逐渐升高则抗氧化效能逐渐增强,若α-生育酚浓度高于最佳抗氧化浓度后,再增加浓度则促进TOTOX增长明显,即促进油脂氧化。
3 结论与讨论
根据“高碘值双键氧化理论”,油脂的不饱和度越高,油脂越易氧化,氧化程度越深,通过脂肪酸分析结果计算花生油、芝麻油和菜籽油的双键相对值分别为:109.60、131.39和120.92,可推测花生油最稳定,其次是菜籽油,芝麻油最易氧化。当花生油和菜籽油之间比较时,schaal烘箱氧化数据(以-TOTOX为基准)与作者的推断一致。但是schaal烘箱氧化实验也表明,3种油中芝麻油却是最稳定的,与作者的推断截然相反,表明除了脂肪酸不饱和度以外,还有其他因素影响油脂的氧化,如多酚、维生素和甾醇等不皂化物。不皂化物的检测结果显示芝麻油中的不皂化物明显高于花生油和菜籽油,其他学者也报道芝麻油中含有芝麻酚、芝麻素等其他植物油没有的天然抗氧化剂[13],这一检测结果与油脂氧化实验相一致,证明除了脂肪酸组成外,不皂化物的成分也是影响油脂氧化稳定性的重要因素。

图5 添加不同浓度生育酚对芝麻油、花生油和菜籽油TOTOX值的影响Fig.5 Addition of different amounts of α-tocopherol on the p-anisidine value of peanut oil,sesame oil and rapeseed oil
油脂的脂肪酸组成不同,不皂化物含量不同,这些因素共同作用影响油脂的氧化稳定性,那么必然也会影响α-生育酚的抗氧化效能。本实验中,以α-生育酚的最佳抗氧化浓度反应生育酚的抗氧化效能。结果显示,油脂氧化稳定性不同,α-生育酚的最佳抗氧化浓度亦不同,当α-生育酚浓度低于最佳抗氧化浓度时,α-生育酚浓度逐渐升高则抗氧化效能逐渐增强,但当α-生育酚浓度高于最佳抗氧化浓度后,再增加α-生育酚的浓度则α-生育酚促进油脂氧化。其中,越稳定的油脂,需要添加的α-生育酚的量越低,而越不稳定的油脂需要添加的α-生育酚的量越高。
[1]Burton G W,Ingold K U.Autoxidation of biological molecules.1.antioxidant activity of vitamin E and related chain—breaking phenolic antioxidants in vitro[J].Journal of the American Chemical Society,1981,103(21):6 472-6 477.
[2]Hou D X.Potential mechanism of cancer chemoprevention by anthocyanin [J].Current Molecular Medicine.2003,3:149-159.
[3]Prior R L.Absorption and Metabolism of Anthocyanins:Potential Health Effects[M].Boca Raton:CRc Press Inc.,2004.
[4]吴雅茹.五种天然抗氧化剂对大豆油氧化的影响[D].北京:中国农业大学,2006.
[5]孙登文,雷炳福,刘福帧.维生素E抗油脂氧化的功能探讨[J].中国油脂,1996,21(3):23-27.
[6]Kamal-Eldin A,Appelqvist L A.The chemistry and antioxidant properties of tocopherols and tocotrienols[J].Lipids,1996,31(7):671-701.
[7]Martin D,Reglero G,Señoráns F J.Oxidative stability of structured lipids[J].Eur Food Res Technol,2010,231:635-653.
[8]Zhu Xue-Mei,Hu Jiang-Ning,Xue Ceng-Lian,et al.Physiochemical and oxidative stability of interesterified structured lipid for soft margarine fat containing Δ5-UPIFAs[J].Food Chem,2012,131(2):533-540.
[9]Karabulut I.Effects of α-tocopherol,β-carotene and ascorbyl palmitate on oxidative stability of butter oil triacylglycerols[J].Food Chem,2010,123:622-627.
[10]GB/T 21121-2007/ISO 6886:2006.动植物油脂氧化稳定性的测定(加速氧化实验)[S].
[11]American Oil Chemists’Society(AOCS).Official and Recommended Methods of the American Oil Chemists’Society[M].4th ed.Champaign:AOCS Press,1989.
[12]Shahidi F,Wanasundra UN.Methods for Measuring Oxidative Rancidity in Fats and Oils.In:Akoh CC,Min DB(eds)Food lipids,chemistry,nutrition,and biotechnology[M].2nd edn,New York:Marcel Dekker,2002:465-487.
[13]Zhou Jia-Chun,Feng Da-Wei,Zheng Guo-Sheng.Extraction of sesamin from sesame oil using macroporous resin[J].J Food Engineer,2010,100(2):289-293.
