透明血管型Castleman病的CT诊断
2013-11-21向先俊刘鹏程言伟强王成林
向先俊 刘鹏程 言伟强 黄 嵘 王成林
北京大学深圳医院医学影像科,广东 深圳 518036
Castleman病(Castleman disease),于1956年由Castleman等[1]首先报道并命名,是一种非常少见的良性淋巴组织增生性病变。Castleman病在病理学上按组织学特征分为透明血管型、浆细胞型和兼有二者特征的混合型,其中以透明血管型最多见,占90%以上。Castleman病缺乏特征性的临床表现,术前诊断主要依赖影像学检查。笔者收集8例经手术病理证实的病例,回顾性分析其CT表现并讨论鉴别诊断,以提高对本病的认识。
1 资料与方法
2006年9月至2012年7月经手术病理证实为Castleman病,术前经CT检查患者8例,其中女性5例,男性3例,年龄24-49岁,平均33.75岁。8例患者均无临床症状,2例颈部及1例腹部病例为无意中触及包块前来就诊发现病变,其余5例为体检发现。
采用Toshiba Aquilion 16层螺旋CT扫描。矩阵 512×512,管电压120kV,管电流280mA,层厚5mm。所有患者均行平扫及增强扫描,增强扫描利用专用高压注射器以流速3.5ml/s注入对比剂(碘海醇30g/100ml)80ml。腹部采用三期增强扫描,动脉期延迟25-30s,门静脉期55-60s,延迟期190-210s。颈、胸部采用双期增强扫描,动脉期延迟25-30s,静脉期60s。
2 结 果
8例中7例为单发肿块,其中4例位于腹部(后腹膜区3例,肠系膜区1例(图3-6)),2例位于颈部(左、右颈部各1列),1例位于右上纵隔;另1例为多发肿块(图1-2),位于左上纵隔、左侧锁骨上窝及腋窝(同一淋巴链区)。肿块多呈类圆形或椭圆形,界限清晰,大小为1.9-8.3cm不等,较大肿块压迫邻近结构。
8例中所有病灶平扫均表现为与肌肉相等或稍低的软组织密度,CT值范围37-53Hu,密度均匀,无坏死。增强扫描动脉期病灶显著强化,CT值范围103-194Hu,但强化欠均匀(图3),病灶中心区可见条状或裂隙样低强化区;静脉期或延迟期病灶表现为持续强化,强化程度较动脉期轻度减低但更趋向均匀(图4),静脉期CT值范围94-186Hu。
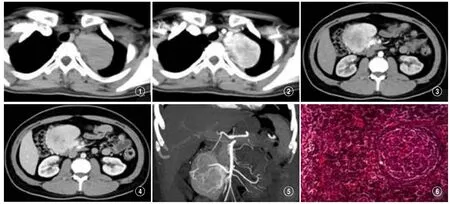
图1、2 同一病例,多发病灶位于左上纵隔、左侧锁骨上窝及腋窝(同一淋巴链),最大病灶位于左上纵隔,呈类椭圆形,界限清晰;平扫密度均匀,CT值53Hu(图1);动脉期显著欠均匀强化,CT值142Hu(图2)。 图2-6 同一病例,病灶位于肠系膜区,界限清晰;动脉期不均匀显著强化,CT值127Hu(图3);门静脉期持续强化并趋向均匀,CT值122Hu(图4);MIP重建显示病灶周边增粗、迂曲的供血血管(图5); 病理切片显示淋巴滤泡增生,滤泡内可见血管插入现象,滤泡间血管增生伴透明变性(图6)。
3 讨 论
Castleman病,于1956年由Castleman等[1]首先报道并以之命名,是一种以淋巴组织增生为特征的淋巴结增生性病变,故又称巨大淋巴结增生、血管滤泡淋巴组织增生、淋巴组织肿瘤样增生等。该病病因和发病机制尚不明确。
Castleman病主要病理改变是淋巴组织和血管肿瘤样增生,根据病理表现分为三型:透明血管型、浆细胞型和兼有二者特征的中间型。临床上按淋巴结的分布分为局限型和弥漫型,参照Frizzera[2]和McAdams等[3]对胸部Castleman病的分型方法,局限型指病变位于同一淋巴链区域的单发或多发病灶,弥漫型指累及两个以上淋巴链区域或伴有其它器官受累的多发病灶。透明血管型Castleman病最为常见,占90%以上,病理表现为淋巴滤泡增生,滤泡内和滤泡间毛细血管增生伴透明变性,病变多为局限型,与本组病例相符。
文献报道[4]Castleman病可发生在所有淋巴结出现的部位,以纵隔最多见(60%~70%),其次颈部(10%~14%)、 腹部(5%~10%)、腋部(2%~4%)等,本组病例以腹部最多(50%),颈部、纵隔(各25%)较少,可能与病例数较少有关。透明血管型Castleman病女性多见,男女比例1:4,多无临床症状,手术切除预后良好。
经过分析本组病例,并结合文献报道[4-10],透明血管型Castleman病的CT表现有以下特点:病灶表现为良性的生长方式,为类圆形或椭圆形肿块,边缘光整,界限清晰,病灶较大时对邻近结构形成压迫。Castleman病因为血供丰富及淋巴结本身特点,极少出现缺血坏死,CT平扫密度均匀,钙化少见,约占5%-20.8%,表现为中心区域分支状或斑点状钙化灶,是增生的血管退变后钙质沉着所致。增强扫描动脉期病灶显著强化,部分病灶强化程度接近大血管,这与病灶内丰富的小血管增生有关,但病灶内的增生血管常伴有纤维化改变,因此动脉期强化欠均匀,出现条状或裂隙样的低强化区;静脉期持续强化且趋向均匀;病灶周边常见增粗、迂曲的供血血管;总的来说,动态增强扫描表现为“快进慢出”的显著强化。
透明血管型Castleman病发生部位广泛,不同个体病灶强化程度差异较大(本组动脉期CT值范围111-194Hu),因此其鉴别诊断也较复杂。笔者查阅文献及分析本组病例后认为,透明血管型Castleman病的鉴别诊断宜紧扣病灶强化程度区别对待:⑴、增强CT值高于160Hu。与颈动脉体瘤鉴别,颈动脉体瘤增强CT值高于200Hu,且有特定的发病部位,颈内外动脉分叉杯口样增宽,容易鉴别。⑵、增强CT值100-160Hu。与下面两种病变鉴别:① 嗜铬细胞瘤,多发生在肾上腺,异位发生的常与大血管相邻,易发生缺血坏死,临床上常有异常 波动的恶生高血压表现,极少数隐匿性嗜铬细胞瘤无临床症状,可行131IMIBG核素显像鉴别,以免术中出现意外。② 非嗜铬性副神经节细胞瘤,难以鉴别,常紧贴主动脉生长,而Castleman病沿淋巴链分布。⑶、增强CT值低于100Hu。本组病例无增强CT值低于100Hu的记录,但有文献报道过此类情况,主要鉴别诊断有肠系膜间质瘤、神经源性肿瘤、淋巴瘤、非侵袭性胸腺瘤、淋巴结结核。上述病变均可出现坏死导致强化不明显;部分肠系膜间质瘤和神经源性肿瘤、非侵袭性胸腺瘤可明显强化,但CT值通常低于100Hu,胸腺瘤可出现重症肌无力表现;淋巴瘤、淋巴结结结核强化程度一般呈轻-中度强化,淋巴结结核可有低热、盗汗等临床症状。
综上所述,如发现纵隔、颈部或腹部的肿块病变,界限清晰,无坏死,动态增强扫描呈“快进慢出”显著强化,应将透明血管型Castleman病作为主要的诊断考虑。
1.Castleman B,Lverson,Menedex V.Localized mediastinal lymphnode hyperplasia resembling thymoma[J].Cancer,1956,9:822-830.
2.Frizzera G.Castleman’s disease and related disorders[J].Semin Diag Pathol,1988,5:346-364.
3.McAdams HP,Rosado-de-Christenson M,Fishback NF,et a1.Castleman disease of the thorax: raidologic features with clinical and histopathologic correlation[J].Radiology,1998,209:221-228.
4.姚迪,石木兰,戴景蕊,等.腹膜后巨大淋巴结增生影像学所见[J].中华放射学杂志,1993,27:546-548.
5.贾明胜,姜玲,李盼盼,等.腹膜后局限型巨大淋巴结增生症的CT诊断[J].中国CT和MRI杂志,2012,10:71-74.
6.Kim TJ,Han JK,Kim YH,et a1.Castleman disease of the abdomen: imaging spectrum and clinic pathologic correlations[J].J Comput Assist Tomogr,2001,25: 207.
7.邹玉坚,郑晓林,陈曌,等.局限型巨大淋巴结增生症的影像学表现[J].中国CT和MRI杂志,2011,9:69-72.
8.宫强,李贲,李文林,等.Rosai-Dorfman病误诊为胸壁胸椎结核1例及文献复习[J].中国医刊,2010,45(3):89-91.
9.康建蕴,朱承峰.后纵隔巨大Castleman病1例报道[J].罕少疾病杂志,2012,19(1):59-60.
10.李子彦,李振龙,庄雄杰,等.颈部Castleman病临床影像学表现[J].中国中西医结合影像学杂志,2012,10(6):514-517.
