接头相关蛋白复合物3δ亚单位与BRD7的相互作用及其功能*
2013-11-21徐晓杰李桂源
徐晓杰,周 鸣,李桂源#
1)南阳医学高等专科学校团委 南阳 473000 2)中南大学湘雅医学院肿瘤研究所分子遗传室 长沙 410078
1997年作者所在的研究室运用cDNA代表性差异分析方法克隆了一个在鼻咽癌活检组织中表达下调的新基因BRD7(GenBank登录号为AF152604,主要分布于胞核)[1]。转基因实验[2]显示,BRD7基因具有抑制鼻咽癌细胞株HNE1生长的作用,并可降低其成瘤性和体内致瘤性。以余鹰博士为首的课题组[3]采用酵母双杂交技术从人胎脑的cDNA文库中筛选到一个与BRD7基因存在交互作用的接头相关蛋白复合物3(adaptor-related protein complex 3,AP3)δ亚单位基因。作者首先构建了2个AP3δ基因的真核表达载体,然后通过细胞免疫共定位和免疫共沉淀法观察AP3δ蛋白与BRD7蛋白的交互作用;并采用半定量逆转录PCR、荧光素酶实验初步研究了AP3δ蛋白与BRD7蛋白在功能学上的关系。
1 材料与方法
1.1主要材料和试剂质粒和细胞系: 真核表达质粒(pCMV-HA、pEGFP-C2)由中南大学湘雅医学院肿瘤研究所分子遗传室购买并保存,pACT2-AP3δ融合质粒由余鹰博士提供,真核表达载体pCMV-Myc-BRD7由中南大学湘雅医学院肿瘤研究所分子遗传室构建保存,E2F3启动子荧光报告质粒由周洁博士构建,CyclinD1启动子荧光报告质粒购自Upstate公司。非洲绿猴肾COS7细胞购自中国医学科学院细胞库,HNE1细胞株由中南大学湘雅医学院肿瘤研究所建立保存,稳定转染pcDNA3.1-BRD7与空白载体pcDNA3.1(-)的HNE1细胞株由余鹰博士建立。主要试剂和抗体:RPMI 1640培养基、RNA抽提试剂Trizol购自GBICOL/BRL公司,脂质体购自Invitrogen公司,逆转录试剂盒、荧光素酶试剂盒购自Promega公司,小量胶回收试剂盒购自上海华舜生物工程有限公司,限制性内切酶购自华美生物工程公司,所用抗体购自Santa Cruz公司和Pierce公司,化学发光检测试剂盒和免疫共沉淀试剂盒购自Pierce公司。核苷酸引物的设计与合成:利用Goldkey软件分析设计好的引物,确认引物内无发夹结构,引物间无二聚体形成。相关引物(表1)由上海博亚生物公司设计合成。
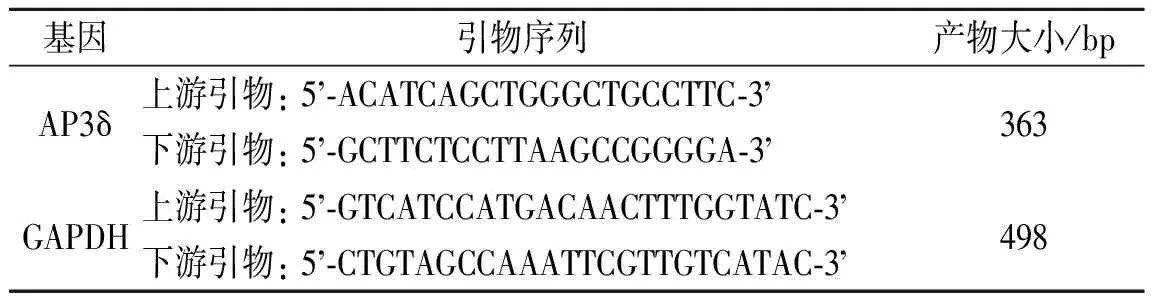
表1 引物序列
1.2AP3δ基因真核表达载体的构建pACT2-AP3δ融合质粒经BgIⅡ单酶切,回收获得目的片段AP3δ基因。pCMV-HA载体和pEGFP-C2载体经BgIⅡ单酶切,并经去磷酸化处理后,分别与目的片段连接,重组体再经BgIⅡ单酶切鉴定插入成功与否。然后根据2个重组体的酶切图谱,pCMV-HA-AP3δ选择EcoR Ⅰ和Hind Ⅲ双酶切鉴定插入片段的方向;pEGFP-C2-AP3δ选择SalⅠ单酶切鉴定插入片段的方向。最后送样品测序。
1.3AP3δ蛋白的亚细胞定位检测6孔板中每孔接种约2×105个COS7细胞,细胞生长至50%~70%融合后,将2 μg pEGFP-C2-AP3δ加入100 μL无血清培养基中,再加入5 μL脂质体,常规转染30 h后,取出玻片固定,DAPI染色,观察结果。
1.4AP3δ与BRD7在COS7细胞中的共定位检测将pEGFP-C2-AP3δ与pCMV-Myc-BRD7经1.3步骤共同转染COS7细胞。转染30 h后取出玻片,清洗、风干、固定后加入封闭血清4 ℃封闭1 h,吸干血清,将一抗anti-Myc均匀覆盖于玻片表面,4 ℃孵育过夜,然后1×PBS清洗玻片4×15 min,将二抗cy3标记的抗鼠 IgG均匀覆盖于玻片表面,37 ℃孵育1 h,1×PBS清洗玻片4×15 min,DAPI染色,观察结果。
1.5AP3δ蛋白与BRD7蛋白相互作用的观察将pCMV-HA-AP3δ和pCMV-Myc-BRD7经1.3步骤共同转染COS7细胞。更换正常培养基24 h后,用预冷的1×PBS洗细胞2~3次,加入适量裂解缓冲液,冰上放置20 min; 用细胞刮子将细胞刮入裂解液,并移入预冷的Tube管中;12 000 r/min 4 ℃离心10 min,吸取上清至另一Tube管中,保存于-70 ℃。 抽提的蛋白样品95~100 ℃煮5 min后行SDS-PAGE 电泳,转膜,丽春红染色、封闭。孵育抗Myc抗体:1×PBS 中加入50 g/L蛋白干粉为抗体稀释液, 滴度为0.5~1.0 mg/L,4 ℃摇床孵育过夜,用1×PBS洗膜4~5次,5 min/次;孵育抗HA抗体:在1×PBS 中加入50 g/L蛋白干粉为抗体稀释液,二抗滴度为12 000,室温2 h;用1×PBS洗膜4~5次,5 min/次。将等量的化学发光液A和B混合,加于膜上后压片显影。
1.6BRD7与AP3δ对COS7细胞中E2F3和CyclinD1活性的影响采用荧光素酶实验。取24孔板,每孔接种0.5×105个COS7细胞,24 h后细胞生长至50%~70%融合状态,按1.3转染方法分2部分转染。A部分分为4组,分别转染E2F3启动子荧光报告质粒,E2F3启动子荧光报告质粒和pCMV-Myc-BRD7,E2F3启动子荧光报告质粒和pCMV-HA-AP3δ,E2F3启动子荧光报告质粒、 pCMV-Myc-BRD7和pCMV-HA-AP3δ。B部分同上分组,其中E2F3启动子荧光报告质粒换为CyclinD1启动子荧光报告质粒,余同。在2个实验中均加入β-Gal为内对照,用来平衡转染效率。倒掉细胞培养基,用1×PBS洗细胞2~3次;加入60 μL裂解缓冲液,室温放置15~20 min后移入Tube管中,离心5~10 s;取20 μL细胞裂解物加入100 μL底物混匀,放入单光子检测仪中进行测定。弃去细胞培养基,用预冷的1×PBS洗涤细胞2~3次;加入50 μL裂解缓冲液,4 ℃摇床摇动15 min,使细胞充分裂解;将细胞裂解液移入96孔板中,加入50 μL检测缓冲液,混合,37 ℃孵育30 min;加入150 μL终止缓冲液终止反应;用酶联免疫标记仪检测酶活性。实验重复3次。
1.7HNE1细胞中BRD7的重表达对AP3δmRNA表达水平的影响复苏稳定转染pcDNA3.1-BRD7或pcDNA3.1(-)的HNE1,培养2~3 d后收集细胞,抽提RNA,逆转录得cDNA,以此为模板进行PCR。PCR反应体系: MgCl23 μL,dNTP 4 μL,Buffer 5 μL,模板cDNA 5 μL,高保真酶 1 μL,AP3δ基因引物 0.1 mmol/L,ddH2O补至50 μL。当AP3δ基因扩增5个循环时,再加入内对照GAPDH引物0.1 mmol/L进行25个循环。PCR反应参数:94 ℃ 5 min;94 ℃ 50 s,57 ℃ 50 s,72 ℃ 50 s,30个循环;72 ℃ 10 min。PCR产物经10 g/L琼脂糖凝胶电泳,DNA胶回收试剂盒纯化,操作方法按产品说明书进行。
2 结果
2.1重组体pCMV-HA-AP3δ和pEGFP-C2-AP3δ的鉴定AP3δ与pCMV-HA连接的重组体单酶切后产生3 800 bp和1 700 bp的2个片段(图1),正向插入的重组体双酶切后产生4 500 bp、854 bp和140 bp的3个片段(图2)。结果示2个克隆为阳性克隆,挑选其中1个克隆送测序鉴定,结果显示,重组体无序列错配和阅读框架改变,表明pCMV-HA-AP3δ 构建成功。AP3δ与pEGFP-C2连接的重组体单酶切后产生4 700 bp和1 700 bp的2个片段(图3),正向插入的重组体被SalⅠ单酶切后产生4 700 bp和1 700 bp的2个片段(图4),结果显示1个克隆为阳性克隆,测序结果显示,重组体无序列错配和阅读框架改变,表明pEGFP-C2-AP3δ 构建成功。
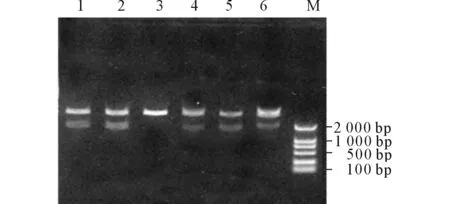
图1 pCMV-HA-AP3δ重组体的单酶切鉴定
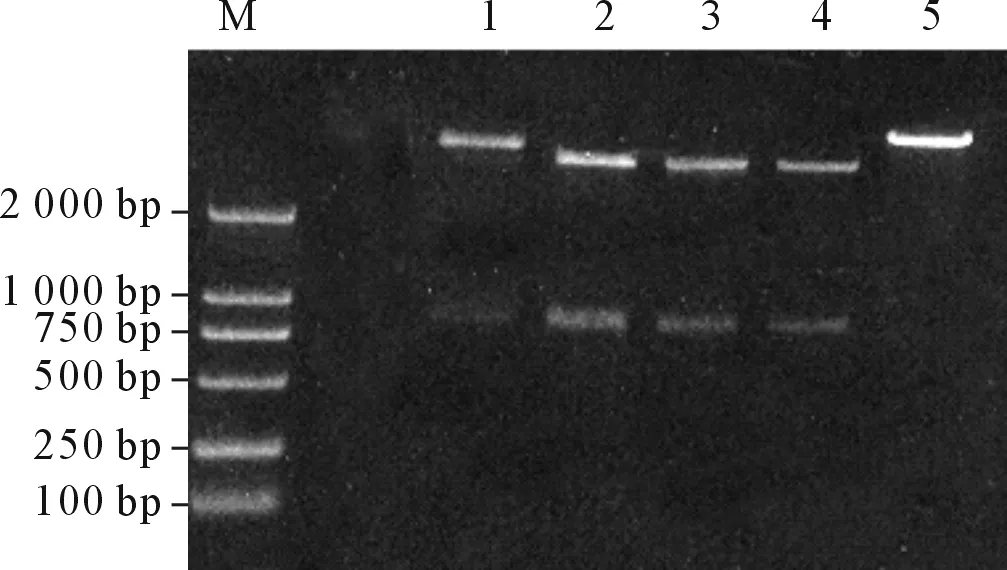
图2 pCMV-HA-AP3δ重组体的双酶切鉴定
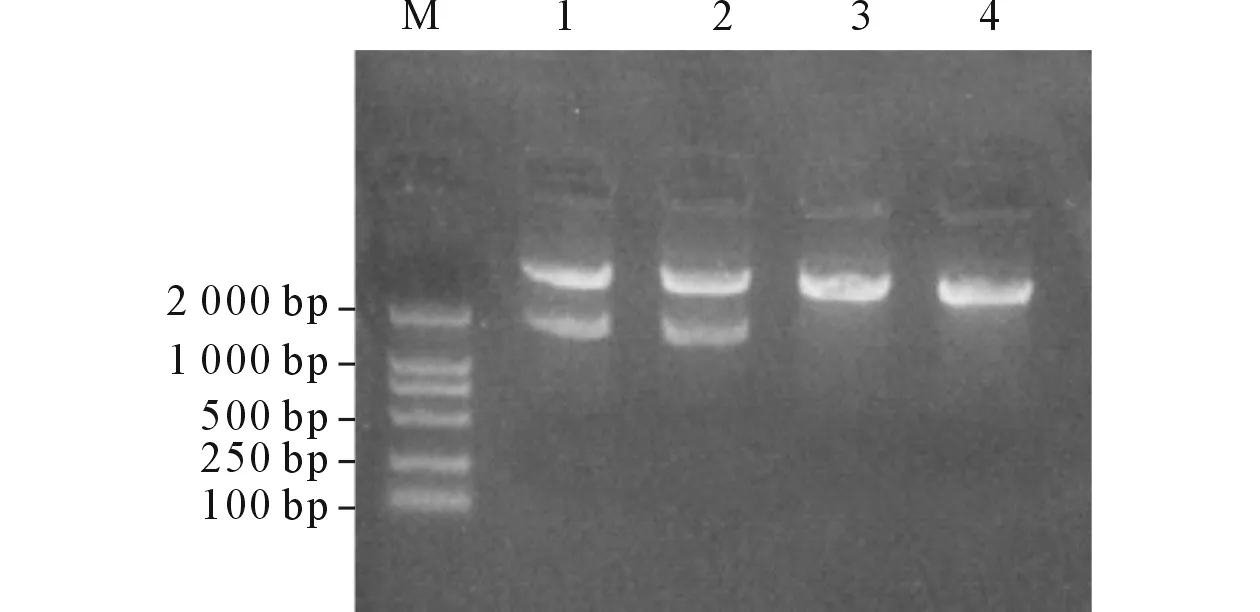
图3 pEGFP-C2-AP3δ重组体的BgI Ⅱ酶切鉴定
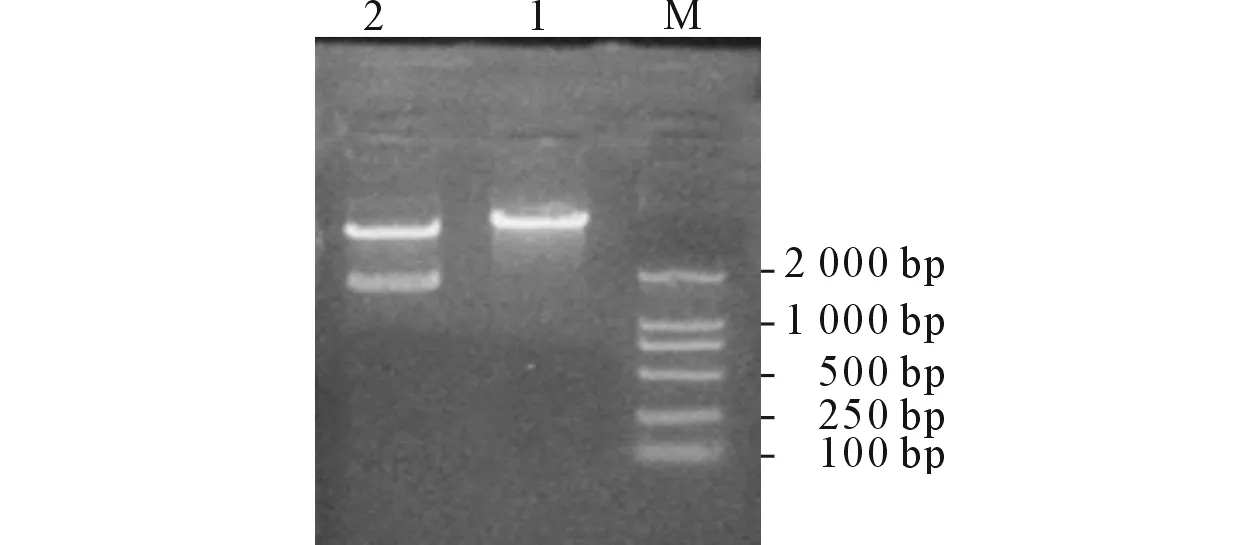
图4 pEGFP-C2-AP3δ重组体的SalⅠ酶切鉴定
2.2AP3δ在COS7细胞中的亚细胞定位AP3δ蛋白在COS7细胞的胞质、胞核中均有分布,但主要呈团块状分布于胞核(图5)。
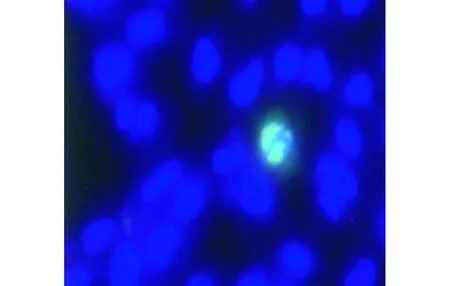
图5 AP3δ蛋白在COS7细胞中的定位
2.3AP3δ与BRD7在COS7细胞中的共定位
AP3δ与BRD7在COS7细胞中共定位于胞核(图6)。
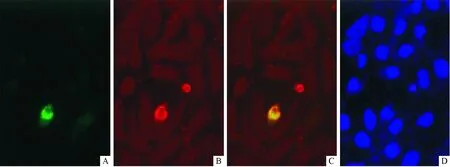
图6 AP3δ与BRD7在COS7细胞中的定位
2.4AP3δ蛋白与BRD7蛋白的相互作用同时转染pCMV-Myc-BRD7和pCMV-HA-AP3δ的COS7细胞中检测到AP3δ蛋白的表达,AP3δ和空白载体共同转染的COS7细胞中未检测到AP3δ蛋白的表达(图7),说明AP3δ蛋白与BRD7蛋白存在相互作用。
2.5BRD7和AP3δ对COS7细胞中E2F3和CyclinD1活性的影响见表2、3。

图7 AP3δ蛋白与BRD7蛋白的相互作用
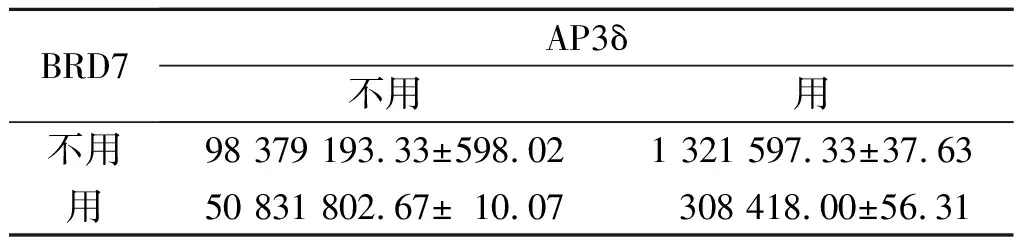
表2 E2F3启动子荧光报告质粒荧光素酶活性相对值测定结果(n=3)

表3 CyclinD1启动子荧光报告质粒荧光素酶活性相对值测定结果(n=3)
2.6HNE1细胞中BRD7的重表达对AP3δmRNA表达水平的影响与转染空白载体的HNE1细胞相比,pcDNA3.1-BRD7稳定转染的HNE1细胞中AP3δ mRNA的表达水平明显上调(图8)。
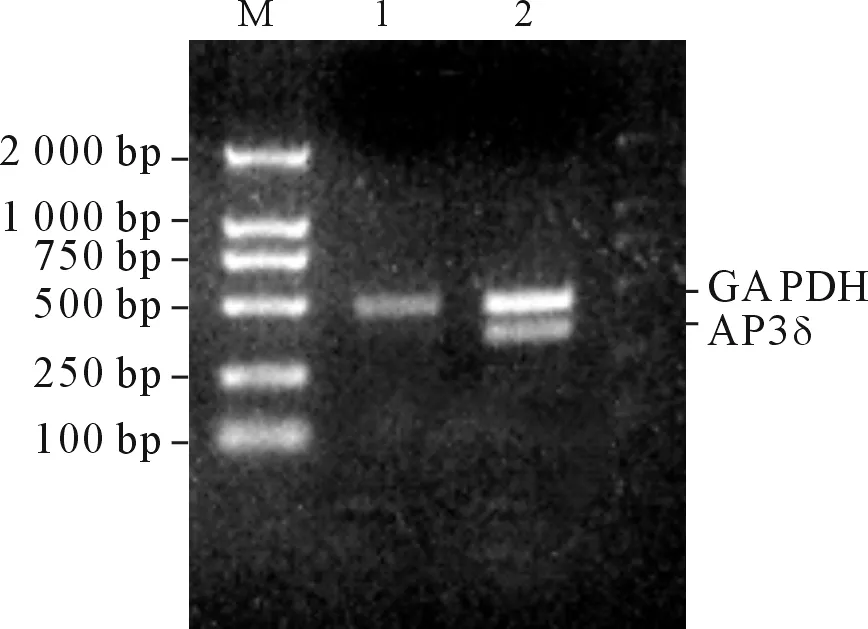
图8 HNE1细胞中BRD7的重表达对AP3δ mRNA表达水平的影响
3 讨论
鼻咽癌是我国南方地区高发的多基因遗传性肿瘤,其发病机制和遗传背景相当复杂。作者所在的研究室前期工作[4]显示BRD7很可能是鼻咽癌的一个遗传易感基因,并通过酵母双杂交系统从人胎脑的cDNA文库中筛选出6种与BRD7蛋白存在交互作用的蛋白,其中AP3是由δ、β3、μ3、σ3四个亚单位构成的异源四聚体,δ和β3为较大的蛋白链,且δ蛋白连接有各种附属因子,可能是AP3中起主要功能的亚单位。利用生物信息学软件对AP3δ的亚细胞定位情况进行预测,发现它具有一个核定位信号区域,分布在胞核的概率高达70%[5]。为了检测单独存在的AP3δ蛋白在细胞中的定位情况,该研究通过GFP介导的细胞荧光实验观察它的亚细胞定位,结果显示,AP3δ蛋白在COS7细胞的胞质、胞核中均有分布,但主要呈团块状分布于胞核,与软件的预测基本一致。明确COS7细胞中AP3δ主要定位于胞核后,作者进一步采用荧光定位法观察到AP3δ蛋白在COS7细胞胞核中与BRD7共同存在的现象;之后又采用免疫共沉淀的方法证实了BRD7与AP3δ蛋白存在相互作用。
作者所在的研究室的前期研究[4]发现,BRD7对鼻咽癌细胞的生长具有抑制作用。 而BRD7主要是通过下调Ras/MEK/ERK和Rb/E2F两条信号转导通路的活性抑制细胞周期G1-S的进程来发挥这一抑制作用[6]。E2F3和CyclinD1是Rb/E2F通路的两个重要分子。该研究发现,与BRD7单独作用相比,在AP3δ基因参与后,BRD7对E2F3和CyclinD1启动子活性的下调作用增强了50%左右,提示在BRD7下调Rb/E2F信号转导通路活性的过程中,AP3δ能够协同BRD7发挥功能。另外,在BRD7稳定转染的HNE1细胞中,AP3δ mRNA的表达较空白载体转染组有明显上调,提示BRD7能够促进HNE1细胞中AP3δ mRNA的表达。诸多文献[7-8]显示,如果两种蛋白存在交互作用,那么它们在功能上也密切关联,共同参与某一信号转导通路或疾病发病过程。因此,该研究结果支持BRD7蛋白和AP3δ蛋白在功能上密切关联、相互调节,可能共同参与了鼻咽癌的发病过程。但它们之间具体的作用机制如何以及它们相互作用的具体区域何在,仍有待进一步的研究。
[1] Wu MH, Li XY,Li GY, et al. Signaling transduction network mediated by tumor suppressor/susceptibility genes in NPC[J]. Curr Genomics, 2009, 10(4):216
[2] Li XL, Wu MH, Li GY, et al. Functional genomics of nasopharyngeal carcinoma susceptibility/suppressor gene[J]. Zhong Nan Da Xue Xue Bao Yi Xue Ban, 2008,33(7):553
[3] Zhou M, Liu H, Xu X, et al. Identification of nuclear localization signal that governs nuclear import of BRD7 and its essential roles in inhibiting cell cycle progression[J]. J Cell Biochem, 2006,98(4):920
[4] 李淑芳,周鸣,刘华英,等.BRD7调控Rb/E2F通路的分子机制研究[J].生物化学与生物物理进展,2007,34(8):881
[5] Bendor J, Lizardi-Ortiz JE, Westphalen RI, et al.AGAP1/AP-3-dependent endocytic recycling of M5 muscarinic receptors promotes dopamine release [J]. EMBO J,2010,29
(16):2813
[6] Hashimoto R, Ohi K, Okada T, et al. Association analysis between schizophrenia and the AP-3 complex genes[J]. Neurosci Res, 2009,65(1):113
[7] Yavuz S, Santarella-Mellwig R, Koch B, et al. NLS-mediated NPC functions of the nucleoporin Pom121[J].FEBS Lett,2010,584(15):3292
[8] 徐晓杰,周鸣,李桂源.bromodomain结构域对BRD7亚细胞定位的影响[J].郑州大学学报:医学版,2011,46(4):542
