半边旗提取物5F对乳癌细胞MDA-MB-231培养物诱导的HUVEC血管生成潜能的影响*
2013-11-21何振辉翁闪凡何太平覃燕梅梁念慈
何振辉,翁闪凡,何太平,覃燕梅,梁念慈
1)佛山科学技术学院医学院医学检验系 佛山 528000 2)广东医学院生物化学与分子生物学研究所 湛江 524023 3)广东省天然药物研究与开发重点实验室 湛江 524023
半边旗(PterissemipinnataL, PsL)又名半边蕨、半边梳,为凤尾蕨科凤尾蕨属植物,广泛分布于南方各省,民间常用于清热解毒、消肿止痛。5F是作者所在的课题组从PsL中提取的二萜类化合物,化学名为11α-羟基-15-氧-16-烯-ent-贝壳杉烷-19酸,分子式为C20H28O4,相对分子质量为332.4。以往的研究[1-2]表明,5F能诱导多种肿瘤细胞凋亡,具有较强的抗肿瘤活性。何太平等[3-4]发现5F影响高转移卵巢癌细胞HO-8910PM多种癌相关基因尤其是P53、Nr1d1的表达。作者以人脐静脉内皮细胞(HUVEC)为受试对象,研究5F对高转移乳癌细胞MDA-MB-231培养物诱导的HUVEC血管生成潜能的影响,并分析其作用机制。
1 材料与方法
1.1材料HUVEC、MDA-MB-231细胞分别购自美国Cascade Biologics公司和美国典型培养物保藏中心。小牛血清购自杭州四季青公司,MTT购自Amresco公司,DMEM培养基购自Gibco公司,PVPF滤膜(孔径8 μm,直径13 mm)购自Osmonics公司,Fibronectin、Matrigel购自BD公司。KDR小鼠IgG单抗、Flt-1小鼠IgG单抗、β-actin山羊IgG多抗购自Santa Cruz公司,使用时以TBST溶液按1(1 000~2 000)稀释;辣根过氧化物酶标记山羊抗小鼠IgG、兔抗山羊IgG购自北京中杉金桥生物技术有限公司,使用时以TBST溶液按1(4 000~10 000)稀释。5F由广东医学院天然药物开发中心提供,实验前以DMSO溶解,培养液稀释。
1.2细胞培养和乳癌细胞培养物的制备MDA-MB-231细胞、HUVEC分别培养于含体积分数10%小牛血清、1×105U/L青霉素和100 mg/L链霉素的DMEM完全培养基中,37 ℃、体积分数5%CO2饱和湿度孵箱中培养。
取生长良好的MDA-MB-231,弃去培养液,加入无血清DMEM培养液继续培养24 h, 收集上清,即为乳癌细胞培养物,过滤除菌,备用。
1.3HUVEC增殖抑制实验采用MTT法。参照文献[5],选取处于对数生长期的HUVEC,确保细胞存活率在97%以上。细胞以(0.5~1.0)×105mL-1接种于96孔培养板,每孔100 μL。在37 ℃、体积分数5%CO2、饱和湿度条件下过夜,换乳癌细胞培养物后,用药组加入1 μL不同浓度5F,使5F终浓度为10、20、40、80、160 μmol/L,每个浓度设3个平行孔,并设空白对照组、溶剂对照组及完全培养基调零孔,置孵箱中6、24 h后,每孔加入10 μL 5 g/L MTT继续培养4 h。倾去培养液,每孔加入200 μL DMSO溶解,于酶标仪上测定波长570 nm处的吸光度。实验重复3次。细胞增殖抑制率=(1-给药组细胞吸光度值/对照组细胞吸光度值)×100%。
1.4乳癌细胞培养物诱导的HUVEC穿膜、趋化性运动能力测定[6]将PVPF滤膜用指甲油贴在Transwell小室上,风干;在膜的外表面涂10 μL纤连蛋白(5 μg),置超净台内风干,膜的内表面涂10 μL Matrigel(5 μg),干燥后形成人工重组基底膜。收集对数生长期的HUVEC,悬浮于1 g/L BSA-DMEM无血清培养基中,调整密度为1×109L-1。将Transwell小室浸于24孔板(每孔预先加入600 μL 乳癌细胞培养物)中,每个小室加入100 μL HUVEC悬液,同时加入20、40、80 μmol/L的5F 1 μL,对照组加入等量的PBS。37 ℃、体积分数5%CO2孵箱内孵育6 h。将Transwell小室取出,滤膜用甲醇固定1 min,苏木素染色3 min,水洗,伊红染色10 s,水洗,用生理盐水浸湿的棉签擦去滤膜内表面的细胞;用封片胶将滤膜封于载玻片上,于高倍镜下计数穿膜细胞。每膜计数5个视野,每组平行设3个滤膜。趋化性运动能力测定与上述实验相比,只是PVPF滤膜上不铺 Matrigel,其余处理相同。抑制率=(1-给药组穿膜或迁移细胞数/对照组穿膜或迁移细胞数)×100%。
1.5HUVEC基质黏附实验96孔培养板每孔预铺Matrigel,置超净台内风干后用20 g/L BSA封闭1 h,PBS冲洗;收集预先经20、40和80 μmol/L 5F处理24 h的以乳癌细胞培养物培养的HUVEC细胞,悬浮于含1 g/L BSA-DMEM培养基中,调整细胞密度为8×105mL-1,每孔加入100 μL,并设空白对照组、溶剂对照组及DMEM培养基调零孔。37 ℃培养1 h;弃培养液,以PBS轻轻冲洗3遍除去未黏附细胞;弃去PBS,每孔加入100 μL DMEM完全培养基和 50 μL 1 g/L MTT继续培养4 h。倾去MTT,每孔加入150 μL DMSO溶解,振摇15 min,于酶标仪上测定波长570 nm处的吸光度。每组平行设3个孔,实验重复3次。黏附抑制率= (1-给药组黏附细胞吸光度/对照组黏附细胞吸光度)×100%。
1.6各组细胞Flt-1和KDRmRNA的检测[7]待HUVEC贴壁生长后,加入乳癌细胞培养物,再分别加入PBS、体积分数0.1%DMSO和终浓度为20、40、80 μmol/L 5F,处理24 h后收集细胞,提取总RNA,逆转录为cDNA。Flt-1上游引物5’-GAC TAGATAGCGTCACCAG-3’,下游引物5’-TAAGACT GCCAAAGATGTT-3’; KDR上游引物5’-AGGGTG GAGGTGACTGAG-3’, 下游引物5’-GAGTCAGT GGAGGTGGGA-3’; GAPDH上游引物5’-TCATT GACCTCAACTACATGGTTT-3’,下游引物5’-GAAGATGGTGATGGGATTTC-3’。PCR反应体系按试剂盒说明配制,在Mx3000P实时定量荧光PCR仪上进行反应。反应条件:94 ℃变性5 min;94 ℃ 10 s,53 ℃ 20 s,72 ℃ 15 s,共循环40次。记录各管Ct值,采用2-ΔΔCt法计算Flt-1、KDR及GAPDH mRNA的表达量,以Flt-1/GAPDH及KDR/GAPDH作为Flt-1及KDR mRNA的相对表达量。
1.7各组细胞Flt-1和KDR蛋白的检测细胞同1.6中分组处理24 h,收集,PBS洗涤后用预冷的细胞裂解液刮下,转移至预冷的1.5 mL离心管中,冰育30 min后,于4 ℃,12 000g离心15 min,收集上清。取少量上清用考马斯亮蓝法进行蛋白定量。Western blot的方法参照《分子克隆实验指南》,以β-actin为内参。溶剂对照组及不同剂量5F组Flt-1和KDR蛋白的相对表达量为各组相应指标与空白对照组的比值×100%。
1.8统计学处理采用SAS V8.1处理数据。采用2×7析因设计的方差分析比较处理不同时间各组细胞的增殖抑制率,余指标采用单因素方差分析,组间两两比较用SNK-q检验。检验水准α=0.05。
2 结果
2.1 5F对乳癌细胞培养物诱导的HUVEC增殖的抑制作用见表1。5F对乳癌细胞培养物诱导HUVEC的增殖具有一定程度的抑制作用,并且抑制率均随浓度和时间的增加而增加。20、40、80 μmol/L的5F在6 h内对血管内皮细胞生长的抑制率均低于10%,且与空白对照组相比,差异无统计学意义,因此在考察5F对HUVEC体外穿膜和趋化性运动能力的影响时,为了排除5F自身对细胞的毒性作用,选择20、40、80 μmol/L作为实验浓度。

表1 5F对乳癌细胞培养物诱导的HUVEC增殖的抑制作用 (n=3)
F组间=64.852,F时间=131.393,F交互=23.266,P<0.001;*:与空白对照组相比,P<0.05;△:与空白对照组相比,P<0.01。
2.2 5F对乳癌细胞培养物诱导的HUVEC穿膜能力、趋化性运动能力及黏附基质能力的影响见图1、2及表2。5F能明显抑制乳癌细胞培养物诱导的HUVEC穿膜能力、趋化性运动能力及黏附基质能力。

图1 穿膜能力实验中黏附在PVPF膜上的HUVEC(×400)

图2 趋化性运动能力实验中黏附在PVPF膜上的HUVEC(×400)

表2 5F对乳癌细胞培养物诱导的HUVEC穿膜能力、趋化性运动能力及黏附基质能力的影响 (n=3) %
*:与空白对照组相比,P<0.01。
2.3 5F对乳癌细胞培养物诱导的HUVECFlt-1、KDRmRNA和蛋白表达的影响见图3,表3、4。不同浓度的5F作用于乳癌细胞培养物诱导的HUVEC 24 h后, 细胞中Flt-1、KDR mRNA和蛋白的表达水平均下调。

表3 各处理组HUVEC KDR、Flt-1 mRNA相对表达量的比较 (n=3) ×10-4
*:与空白对照组相比,P<0.05。
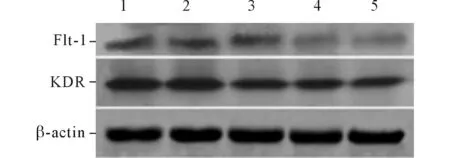
图3 5F对乳癌细胞培养物诱导的HUVEC KDR、Flt-1蛋白表达的影响

表4 各处理组HUVEC KDR、Flt-1 蛋白表达的比较 (n=3) %
*:与空白对照组相比,P<0.05。
3 讨论
对于肿瘤血管生成抑制剂,一般可以用分子模型、细胞模型、组织器官模型来筛选和研究其作用机制。随着内皮细胞培养技术的发展,血管形成的许多过程都可以用血管内皮细胞模型进行研究,如血管内皮细胞的增殖、血管内皮细胞向肿瘤组织的浸润、运动等[8]。该研究结果显示5F具有抑制高转移乳癌细胞培养物诱导的HUVEC体外增殖、穿膜、趋化性运动能力和黏附基质能力。但体外有作用的物质在体内不一定有相同的作用,结合先前的研究[9],下一步应以具体的体内实验如构建裸鼠乳癌模型来观察5F抗肿瘤血管生成的作用。
肿瘤血管生成的首要环节是肿瘤血管生成因子与血管生成抑制因子失衡,血管生成表型形成。在诸多血管生成因子中,血管内皮生长因子(vascular endothelial growth factor, VEGF)居于中心地位[10]。VEGF与其受体结合后发挥生物学作用。目前,VEGF受体(VEGFR)已发现有5种:VEGFR-1(Flt-1), VEGFR-2(KDR/Flk-1), VEGFR-3(Flt-4),NP-1和NP-2。Flt-1、KDR、Flt-4均是受体酪氨酸蛋白激酶;Flt-1、KDR是VEGF的主要受体,主要在血管内皮细胞上表达, Flt-4主要存在于淋巴管内皮细胞[11]。
KDR是VEGF最重要的受体,处于信号转导的上游。Rastelli等[12]发现VEGFR-2在VEGF所诱导的血管生成和血管通透性中起主要作用。单独使用KDR抑制剂就能阻断VEGF和bFGF所诱导的血管生成。VEGF能通过Grb10上调KDR的表达。活化的KDR能够激活PI3K、PLC-γ,引起血管内皮细胞的迁移和血管通透性增加;通过黏附斑激酶和Src的相互作用,促进血管内皮细胞的增殖和运动,抑制其凋亡[13]。该实验结果显示5F可下调乳癌细胞培养物诱导的HUVEC中KDR mRNA和蛋白的表达,这可能是5F抑制MDA-MB-231细胞培养物(含有高分泌水平VEGF)引发的血管内皮细胞的增殖、运动、浸润基底膜等生物学作用的原因。
在VEGFR中,Flt-1的信号转导机制目前还未明了。基因敲除方法显示Flt-1缺乏的小鼠死于血管生成过多。Flt-1 mRNA的剪接可产生可溶性的Flt-1(sFlt-1)。sFlt-1跟VEGF结合后,不能发生信号转导。sFlt-1能抑制肿瘤血管生成。也有报道[14]认为Flt-1能诱导单核巨噬细胞迁移并分泌VEGF,因此Flt-1信号转导通路能促进肿瘤生长和转移。该实验结果显示5F下调MDA-MB-231细胞培养物诱导的HUVEC中Flt-1的表达,这种作用究竟是促进还是抑制HUVEC的血管生成潜能,尚待进一步研究。
总之,该研究结果显示,5F 能抑制MDA-MB-231细胞培养物诱导的HUVEC体外增殖、穿膜、趋化性运动能力和黏附基质能力,其作用机制可能与5F下调HUVEC KDR mRNA和蛋白表达水平有关。结合课题组先前的研究[9,15],提示5F具有开发为肿瘤血管生成抑制剂的潜能。
[1]Chen GG, Leung J, Liang NC, et al. Ent-11α-hydroxy-15-oxo-kaur-16-en-19-oic-acid inhibits hepatocellular carcinoma in vitro and in vivo via stabilizing IkBα [J]. Invest New Drugs, 2012, 30(6):2210
[2]Li MY, Liang NC, Chen GG. Ent-11α-hydroxy-15-oxo-kaur-16-en-19-oic-acid induces apoptosis of human malignant cancer cells[J]. Curr Drug Targets, 2012, 13(14):1730
[3]何太平, 覃燕梅, 莫丽儿, 等. 半边旗二萜类化合物5F对高转移卵巢癌HO-8910PM细胞中癌相关基因表达的影响[J]. 中国药理学通报, 2008,24(1):117
[4]何太平, 吴科锋, 吕应年, 等. 半边旗二萜化合物5F对HO-8910PM细胞中Nr1d1表达的影响[J]. 中国中药杂志, 2009, 34(10): 1268
[5]罗娟,许伟,薛天阳,等. 苦参碱对人神经母细胞瘤SH-SY5Y细胞的作用机制[J]. 实用儿科临床杂志,2012,27(3):190
[6]李金锋, 丰贵文, 王跃, 等. COX-2基因沉默对OS-RC-2细胞生长和侵袭能力的影响[J]. 郑州大学学报:医学版, 2010, 45(6): 986
[7]邓凡,王春霞,许万福,等. PKD3上调前列腺癌细胞中PSA 表达及机制[J]. 南方医科大学学报,2010,30(8):1779
[8]Bocci G, Fioravanti A, Orlandi P, et al. Metronomic ceramide analogs inhibit angiogenesis in pancreatic cancer through up-regulation of caveolin-1 and thrombospondin-1 and down-regulation of cyclin D1[J]. Neoplasia, 2012, 14(9):833
[9]何振辉, 何太平, 莫丽儿, 等. 白藜芦醇与半边旗二萜类化合物5F对活体血管生成的影响[J]. 实用医技杂志, 2006, 13(1): 1
[10]何振辉,梁念慈.以VEGF和bFGF及其受体为靶点的抗肿瘤血管治疗[J].国外医学:生理、病理科学与临床分册, 2004, 24(2):162
[11]Shibuya M. Vascular Endothelial Growth Factor (VEGF) and Its Receptor (VEGFR) Signaling in Angiogenesis: A Crucial Target for Anti- and Pro-Angiogenic Therapies [J]. Genes Cancer, 2011, 2(12): 1097
[12]Rastelli L, Valentino ML, Minderman MC, et al. A KDR-binding peptide (ST100, 059) can block angiogenesis, melanoma tumor growth and metastasis in vitro and in vivo [J]. Int J Oncol, 2011, 39(2): 401
[13]Holmqvist K, Cross MJ, Rolny C, et al. The adaptor protein shb binds to tyrosine 1175 in vascular endothelial growth factor (VEGF) receptor-2 and regulates VEGF-dependent cellular migration[J]. J Biol Chem, 2004, 279(21): 22267
[14]Murakami M, Zheng Y, Hirashima M, et al. VEGFR1 tyrosine kinase signaling promotes lymphangiogenesis as well as angiogenesis indirectly via macrophage recruitment [J]. Arterioscler Thromb Vasc Biol, 2008, 28(4):658
[15]李立,吕应年,刘义,等. 半边旗提取物5F诱导HepG2细胞凋亡与p53活化及血管内皮生长因子抑制有关[J]. 中草药, 2010, 41(2): 241
