高脂血症对大鼠脑组织MMP-2表达及新生血管的影响*
2013-11-20张振强贾亚泉宋军营李澎涛潘彦舒王丛笑吕欢欢
张振强,贾亚泉,宋军营,李澎涛,潘彦舒,王丛笑,吕欢欢
1)河南中医学院科技处 郑州 450008 2)北京中医药大学东直门医院中医内科重点实验室 北京 100029
高脂血症能够通过损伤内皮细胞,分泌炎症因子和生长因子,诱导单核细胞集聚、黏附于内皮细胞,并迁入内皮下间隙,引起T淋巴细胞的浸润,参与炎症与免疫过程。单核细胞集聚经多种受体介导,不断地摄取已经进入内膜发生氧化的脂质,形成单核细胞源性泡沫细胞;内皮细胞更新、增生并分泌生长因子,可激活动脉中膜平滑肌细胞,经内弹力膜的窗孔迁入内膜,并发生增生、转化、分泌细胞因子及合成细胞外基质,经其表面受体介导吞噬脂质,形成平滑肌源性泡沫细胞。在动脉粥样硬化病变过程中,小动脉内径狭窄甚至闭锁,脑组织可出现慢性缺血缺氧,机体能否通过血管新生的方式来代偿脑内的病理变化过程,从而实现脑保护作用,该实验将进行验证分析。
1 材料与方法
1.1实验动物与分组健康雄性SPF级12周龄Wistar大鼠20只,体质量280~300 g,购于北京维通利华实验动物技术有限公司[SCXK(京)2007-0001],质量合格证号:0243109。实验动物采用随机数字表法分为正常对照组、高脂血症组,每组10只。
1.2主要仪器与试剂主要仪器:全自动生化分析仪(奥林巴斯,型号AU2700);酶标仪(Thermo,型号MK3);洗板机(Thermo,型号WELLWASH4MK2);自动平衡离心机(长沙湘智离心机仪器有限公司,型号TDZ5-WS);DT300A型电子天平(上海医用激光仪器厂常熟分厂)。主要试剂:体积分数10%水合氯醛(武汉市和昌化工有限公司);PBS缓冲液(上海富众生物科技发展有限公司);基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)、细胞间黏附分子-1(intercellular adhesion molecule-1, ICAM-1)、人白细胞分化抗原34(CD34)、血管内皮生长因子(vascular endothelial growth factor, VEGF)一抗、二抗及链霉菌素-过氧化物酶溶液(武汉博士德生物工程有限公司);VEGF ELISA检测试剂盒(北京中杉金桥生物技术有限公司)。
1.3高脂血症动物模型制备方法高脂血症组大鼠每天以高脂饲料[组成成分(质量分数):3.5%胆固醇、10.0%猪油、0.2%丙硫氧嘧啶、0.5%胆酸钠、5.0%白糖、80.8%基础饲料]喂养[1],正常对照组以正常饲料喂养,4周后正常对照组与高脂血症组分别断尾取血0.5~1.0 mL检测血脂,高脂血症组血脂指标与正常对照组相比差异有统计学意义,则说明模型制备成功[2],否则继续饲养。
1.4血脂检测模型制备成功后,每组各取动物5只,以体积分数10%水合氯醛(3 mL/kg)腹腔注射麻醉,背位固定于鼠板上,腹主动脉取血5 mL,静置30 min,以3 000 r/min离心15 min,取上清液,-20 ℃冰箱冷冻备用。血清中总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)和低密度脂蛋白(LDL-C)用全自动生化分析仪进行检测。
1.5血清VEGF含量检测采用ELISA法检测血清中VEGF的含量,依照试剂盒说明书步骤进行操作。
1.6脑组织MMP-2、ICAM-1、CD34、VEGF免疫组化染色及HE染色每组各取动物5只,以体积分数10%水合氯醛(3 mL/kg)腹腔注射麻醉,背位固定于鼠板上,剪开胸腔,暴露出心脏,先用手术剪剪开右心耳,再用100 mL注射器进入左心室插进主动脉,先灌注生理盐水150 mL左右,再灌注多聚甲醛400 mL左右,断头取出全脑,脑组织置于40 g/L多聚甲醛固定,脱水、透明、浸蜡、包埋、冠状切片,片厚4 μm,制作常规病理切片,进行HE染色和免疫组化染色,在高倍镜(×400)下选取5个视野计数阳性细胞(棕黄色染色),结果取平均值(个/mm2)。
1.7统计学处理应用SPSS 13.0进行统计学处理,2组血脂、血清VEGF含量及脑组织VEGF、MMP-2、 ICAM-1和CD34表达情况的比较均采用t检验,检验水准α=0.05。
2 结果
2.1 2组TC、TG、HDL-C、LDL-C检测结果见表1。
2.2 2组脑组织病理学观察结果见图1。与正常对照组相比,HE染色显示高脂血症组大鼠毛细血管增多;神经细胞较多,少量神经元固缩;星型胶质细胞增生较明显;细胞形态结构基本正常。免疫组化结果显示:高脂血症组大鼠脑组织内MMP-2主要表达在皮层及海马区;CD34阳性细胞增多,主要分布于新生毛细血管;VEGF和ICAM-1表达均增多。
2.3 2组血清VEGF含量及脑组织MMP-2、ICAM-1、CD34和VEGF表达结果见表2。

表1 2组血脂检测结果 mmol/L
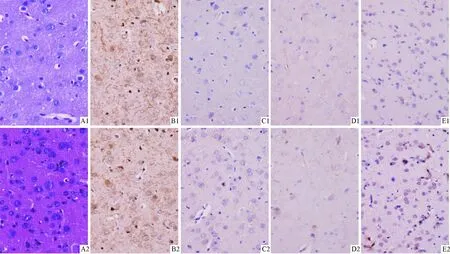
图1 2组脑组织HE染色和免疫组化结果(×400)

表2 2组大鼠血清VEGF含量和脑组织MMP-2、ICAM-1、CD34、VEGF的表达
3 讨论
MMP-2主要由血管内皮细胞、星形胶质细胞、白细胞等合成和分泌,主要功能为降解细胞外基质,促使组织细胞的再生及迁移;正常情况下含量极少,但当有炎症反应时,在IL-1、IL-6、TNF-α、VEGF、PDGF等作用下,能够活化上述细胞。胞内线粒体和溶酶体增多,一方面起到吞噬细胞碎片和坏死组织作用,另一方面释放包括MMP-2在内的各种酶类,破坏基底膜的毛细血管内皮细胞的紧密连接,引起组织细胞的炎症性水肿[3-4],所以MMP-2在脑组织的表达有双向性,既可损伤组织,又有清除与修复组织的作用[5-6]。该研究显示,高脂血症组大鼠脑组织内MMP-2表达比对照组增多,主要表达于皮层及海马区,但是没有发现脑细胞水肿及脑功能明显损害,推测MMP-2可能起到组织修复作用。由于高脂血症是一个慢性病变过程,MMP-2高表达可能是激活内源性保护的机制之一。
内皮功能障碍时,ICAM-1能够使血流中的单核细胞与血管内皮细胞黏附,进入内皮下基质集聚。有研究[7-10]证实,慢性缺氧时其黏附功能增强,可促使内皮细胞分化和迁移,参与血管生成。该研究结果显示高脂血症组大鼠脑组织ICAM-1表达增多,而CD34表达的增多提示了新生血管较多,ICAM-1可能参与了血管的生成。因为CD34是一种跨膜糖蛋白,有黏附、促血管前内皮细胞聚集并形成血管、调控造血细胞增殖和分化的功能[11-12]。
VEGF对血管形成有关键而且特异性作用,脑血管发生的主要方式是通过VEGF与血管内皮细胞上的2个酪氨酸激酶受体(VEGFR-1和VEGFR-2)结合启动血管新生的最初始过程——出芽,形成未成熟的血管[11]。VEGF主要生物学功能有:①促进微血管内皮细胞增殖、迁移。②增加微血管通透性,有助于再通血管,促进周围侧支循环建立。③通过改变内皮细胞的基因表达,产生蛋白水解酶,降解细胞外基质,促进生长的毛细血管向基质迁移。在炎症、缺氧等因素作用下,通过内皮细胞、炎症细胞、结缔组织等产生促使血管内皮细胞生长活性物质,在毛细血管和细静脉的基础上诱导新生血管的形成[7,13]。该研究结果显示,无论是大鼠血清中还是脑组织中VEGF的表达都是增加的,推测高脂血症对脑内血管生成具有一定影响,这可能是体内的一种内源性保护机制之一。
脑组织细胞在炎症因子、各种趋化因子等因素作用下,会发生一系列的病理反应,包括胶质细胞、内皮细胞、基质成分等结构和功能的改变,对神经元、神经纤维及神经突触造成影响。作者发现高脂血症组和正常对照组相比较,光镜下大脑皮质毛细血管增多,神经细胞少量固缩;胶质细胞数量增多,主要集中在小血管周围,形态结构基本正常。高脂血症可以损伤血管内皮细胞,引起动脉粥样硬化等病理变化,从而使脑组织出现相对的、慢性的缺血缺氧,机体对抗这种变化,启动内源性保护机制。该研究结果表明模型大鼠脑组织MMP-2表达及新生血管的变化,可能是高脂血症诱发机体脑组织内源性保护机制之一,其详细的作用机制尚需进一步深入研究。
[1]张东,武海军,陈士萍,等.大鼠实验性高脂血症五种造模方法的比较[J].中国药理学通报,2007, 23(9):1254
[2]林武,吴丽萍.高脂饲料致高脂血症大鼠模型的研究[J].现代实用医学,2013,25(2):171
[3]Spinale FG. Matrix metalloproteinases: regulation and dysregulation in the failing heart[J]. Circ Res, 2002, 90(5):520
[4]Galis ZS, Khatri JJ. Matrix metalloproteinases in vascular remodeling and atherogenesis: the good, the bad, and the ugly[J]. Circ Res, 2002, 90(3):251
[5]Martin L, Dorothe B, Nathalie W, et al. ACE inhibition reduces activity of the plasminogen/plasmin and MMP systems in the brain of spontaneous hypertensive stroke-prone rats[J]. Neurosci Lett, 2005, 376(3):205
[6]Planas AM, Sole S, Justicia C. Expression and activation of matrix metalloproteinase-22 and -29 in rat brain after transient focal cerebral ischemia[J]. Neurobiol Dis, 2001, 8(5):834
[7]Zwaka TP, Hombach V, Torzewski J. C-reactive protein-mediated low density lipoprotein uptake by macrophages: implications for atherosclerosis[J]. Circulation, 2001, 103(9):1194
[8]宋旭东,陈爱华,何非,等. C反应蛋白诱导内皮细胞炎症相关因子iNOS及ICAM-1表达的研究[J].解放军医学杂志,2011,36(8):821
[9]陆永光,符春晖,严华,等.阿托伐他汀对内皮细胞微粒诱导的人脐静脉内皮细胞ERK、p38MAPK、NF-κB p65蛋白及ICAM-1 mRNA表达的影响[J].郑州大学学报:医学版,2012,47(6):765
[10]朱涛,许军秀,徐明.充血性心力衰竭患者血清sICAM-1及白细胞膜黏附分子水平检测[J].郑州大学学报:医学版,2013,48(2):260
[11]Carmeliet P,Collen D. Molecular analysis of blood vessel formation and disease [J]. Am J Physiol,1997,273(5 Pt 2):H2091
[12]张俊,谢珊珊,韩晓霞,等.血管内皮生长因子对骨髓源间充质干细胞增殖的影响及其信号机制[J].南方医科大学学报,2011,31(10):1697
[13]冼乐武,李涛平,韦伊尔,等.间歇性缺氧时结肠癌细胞的晚期氧化蛋白产物与血管内皮生长因子、转化生长因子β1的关系[J].南方医科大学学报,2011,31(4):619
