后天感染河南樱桃谷鸭乙型肝炎病毒模型的建立*
2013-11-20臧利敏吴学炜赵雪杰方先珍杨晓瑞王庆端常俊标郑立运
臧利敏,吴学炜,赵雪杰,方先珍,杨晓瑞,王庆端,常俊标,郑立运#
1)郑州大学医药科学研究院药化室 郑州 450052 2)郑州安图绿科生物工程有限公司 郑州 450016 3)河南省动物疫病预防控制中心测报科 郑州 450008
乙型肝炎病毒(hepatitis B virus,HBV)感染是当今人们面临的主要健康问题,全球约有4亿人为慢性乙型肝炎感染者[1]。HBV宿主范围狭窄,建立理想的HBV动物模型是有效筛选抗病毒药物、研究HBV感染机制和发病过程的基础[2]。鸭乙型肝炎病毒(duck hepatitis B virus, DHBV)是一种禽类嗜肝DNA病毒,其形态结构、基因组特征、生命周期、生物学特性等与HBV非常相似[3]。目前, DHBV模型已成为国内外认可的抗HBV药物体内活性筛选和评价的动物模型。国内已见报道的DHBV模型鸭主要有北京鸭、重庆麻鸭、广州樱桃谷鸭、湖北麻鸭等。通过雏鸭后天感染DHBV是建立模型的一个主要途径,但是鸭体内病毒血症持续的时间及水平受鸭种、毒种、产地、感染途径、感染剂量等多种因素影响,研究结果间存在一定差异。前期作者从河南本地樱桃谷鸭血清中分离并克隆了一株DHBV标准毒株。该研究中,作者采用DHBV阳性血清人工感染3日龄河南樱桃谷鸭,建立标准的人工感染河南樱桃谷鸭乙型肝炎动物疾病模型,探讨DHBV DNA在动物外周血和肝脏中的增殖规律,并观察抗病毒药物拉米夫定(3TC)鸭体内的抗病毒效用,验证该模型的科学性与实用性。
1 材料与方法
1.1动物与试剂1日龄河南省樱桃谷鸭120只,雌雄不拘,体质量(50±5) g,购买于河南省郑州市新郑宏达鸭业孵化公司;DHBV-WS病毒株(GenBank No:HM590411.1)由河南省医药科学研究院药化室分离和保存;DHBV标准质粒由河南省医药科学研究院药化室构建和保存;3TC为葛兰素史克苏州有限公司产品;SYBR Green Ⅰ染料购自宝生物工程(大连)有限公司;Viral DNA提取试剂盒和Tissue DNA提取试剂盒购自Omega Bio-Tek(美国)公司。
1.2引物的设计根据GenBank收录的DHBV S区核苷酸的保守序列设计引物,由北京博尚生物公司合成。上游序列:5’-CGGACAACGGGTCTACTAT-3’,下游序列:5’-GGTGGCAGAGGAGGAAGT-3’。
1.3DHBV阴性鸭的筛选1日龄河南樱桃谷鸭120只,经颈静脉无菌采血400 μL, 3 000 r/min离心5 min分离血清,酚/氯仿法提取DNA。PCR反应体系:10×Buffer 5 μL,10 μmol/L dNTP 4 μL,上、下游引物各0.5 μL,Taq酶0.5 μL、模板0.5 μL;反应条件:94 ℃ 5 min;94 ℃ 1 min,60 ℃ 1 min,72 ℃ 3 min,35个循环;72 ℃10 min。取PCR扩增产物在10 g/L 琼脂糖凝胶上进行电泳,155 bp处无条带判定为DHBV阴性鸭。
1.4DHBV模型鸭的建立1日龄DHBV阴性鸭48只,在3日龄时经胫静脉注射采用文献[3]方法得到的拷贝数为1.6×106mL-1的DHBV阳性血清0.20 mL,于第0、2、4、6、8、10、12、14、21、28、35、42天随机抽取,每次剖杀4只,分别按照Viral DNA提取试剂盒、Tissue DNA提取试剂盒说明书提取血清及肝脏DNA。
1.5荧光定量PCR检测采用郑州大学医药科学研究院药化室已建立的DHBV荧光定量PCR方法[4]检测血清和肝脏中DHBV DNA水平。 反应体系为20 μL: SYBR Premix Ex TaqTM10 μL,上、下游引物各0.4 μL,H2O 7.2 μL;反应条件:95 ℃预变性1 min;95 ℃变性5 s,56 ℃退火5 s,72 ℃延伸25 s,共40 个循环;40 ℃冷却10 s。每个待测样本同时检测3管,取平均值。
1.6实验分组与处理另取1日龄DHBV阴性鸭48只,设正常组、模型组与3TC组各16只。模型组与3TC组鸭在3日龄时经胫静脉注射拷贝数为1.6×106mL-1的DHBV阳性血清0.20 mL。7 d后,正常组与模型组灌服生理盐水2 mL/(kg·d),3TC组灌服3TC 20 mg/(kg·d),共给药10 d。分别在给药5、10 d后及停药3 d后随机抽取,每次每组剖杀4只,按照试剂盒说明书提取血清及肝脏DNA,采用荧光定量PCR方法检测血清和肝脏中DHBV DNA水平。根据公式计算DHBV DNA抑制率,抑制率(%)=(模型组拷贝数-3TC组拷贝数)/模型组拷贝数×100%。
1.7肝脏病理学检查用药前、用药10 d后处死正常组、模型组和3TC组实验动物,后取肝左叶中部1.0 cm×1.0 cm大小肝组织固定于甲醛溶液,石蜡包埋、切片后HE染色,切片厚度为5 μm,光学显微镜下(×400)观察肝组织病变。
1.8统计学处理采用SPSS 13.0处理,不同组别不同时间点鸭血清和肝脏中DHBV DNA拷贝数的比较采用2×3析因设计的方差分析,检验水准α=0.05。
2 结果
2.1DHBVDNA在模型鸭血清和肝脏中的增殖情况3日龄樱桃谷鸭经胫静脉接种DHBV阳性血清后,血清和肝脏中DHBV DNA水平的变化见图1。感染2 d后,48只雏鸭血清均可检测出DHBV DNA;在第2至14天,病毒量随着时间呈上升趋势,并于感染后第14天达到高峰,拷贝数达到7.7×109mL-1;第14至42天,血清DHBV DNA水平呈缓慢下降趋势;第6至42天,血清DHBV DNA拷贝数均维持在较高水平。肝组织中DHBV DNA含量的动态变化趋势与血清中基本一致。
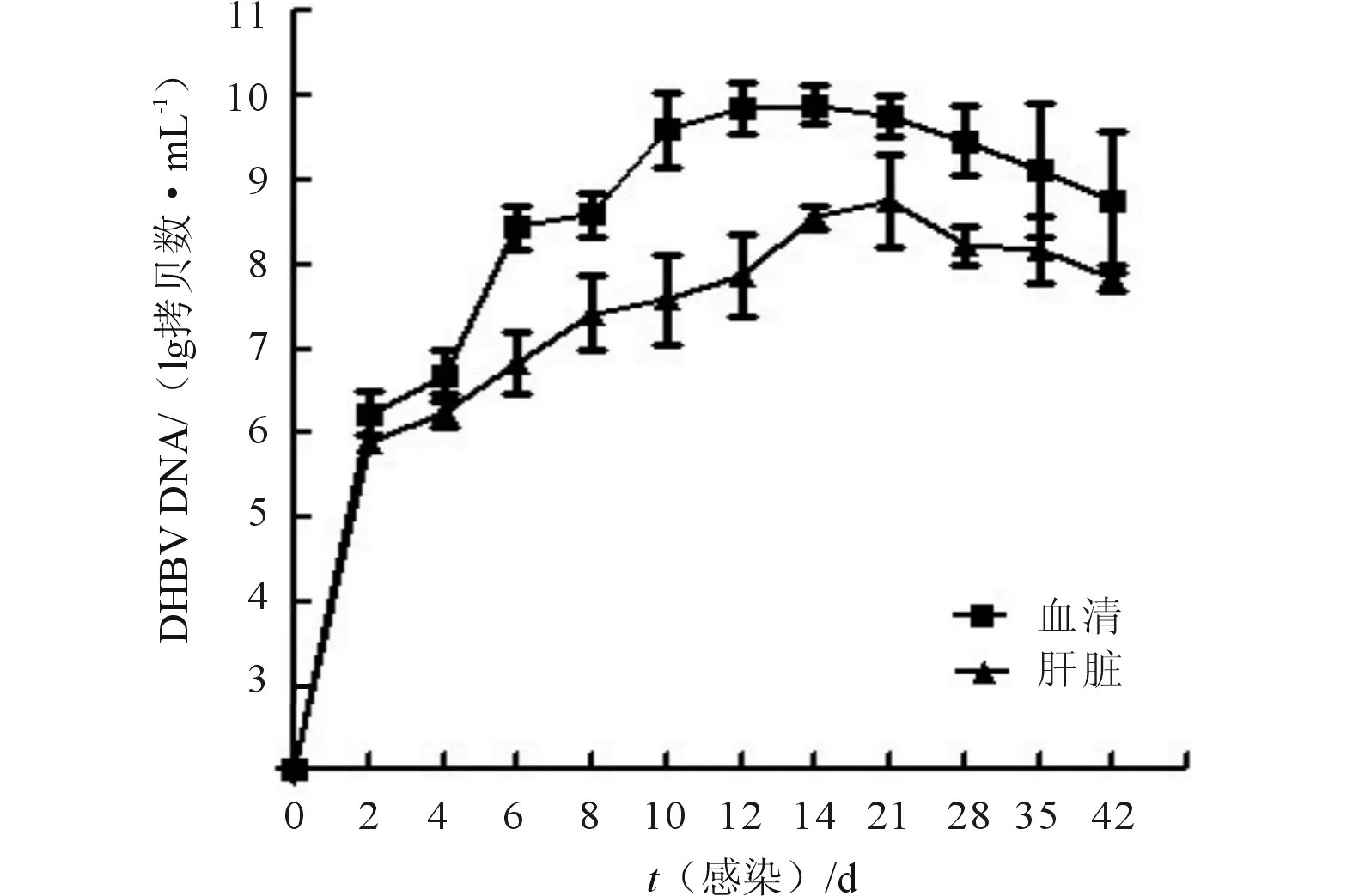
图1 模型鸭血清和肝脏中DHBV DNA水平动态变化图
2.2模型组和3TC组鸭血清和肝脏DHBVDNA的水平模型组和3TC组鸭用药后血清和肝脏中DHBV DNA拷贝数比较结果见表1、2。3TC组在用药第10天,血清和肝脏DHBV DNA抑制率分别达到86.5%和84.9%;停药3 d后,DHBV DNA抑制率分别为79.7%和73.4%,即出现轻度的“反弹”现象。

表1 不同组别不同时间点鸭血清中DHBV DNA拷贝数(n=4)(×108 mL-1)
F组间=17.625,F时间=68.141,F交互=134.517,P<0.001。

表2 不同组别、不同时间点鸭肝脏中DHBV DNA拷贝数(n=4)(×108 mL-1)
F组间=69.430,F时间=35.330,F交互=75.770,P<0.001。
2.3各组鸭肝组织病理学观察结果见图2。正常组鸭肝细胞呈梭状,结构完整,轮廓清晰。用药前,模型组与3TC组肝组织部分细胞肿胀和出现空泡,汇管区可见炎细胞浸润及灶性坏死。模型组鸭肝脏在用药10 d后出现胞质疏松化、大量空泡、重度脂肪变性、水样变性和灶状坏死。与模型组相比,3TC组在用药10 d后病变细胞明显减少,炎症有很大程度减轻。
3 讨论
HBV具有明显的种属特异性,宿主范围狭窄。已报道[5]的HBV模型动物主要有黑猩猩、树鼩、土拨鼠、转基因小鼠、地松鼠、旱獭、鸭等。相比之下,鸭具有来源广、价格低、易于饲养、繁殖率高、重复性好等优点。目前国内用于筛选评价抗HBV药物的动物模型主要以DHBV模型为主。
DHBV模型建立的方法分为先天感染和后天感染两种。国内先天感染模型通常采用大批量筛选DHBV阳性鸭的方法[6-7],所需样本量较大,一般选用自然感染率较高的品种。前期调查研究[3]发现,河南省樱桃谷鸭DHBV阳性率为8.1%,自然感染率较低,适宜建立后天感染模型。后天感染主要通过给1~3日龄雏鸭注射病毒阳性血清造成慢性携带状态。研究[8]表明,雏鸭体内免疫系统尚未成熟,容易形成免疫耐受,攻毒后病毒血症持续时间长且稳定。病毒血症的水平与所感染的 DHBV 毒株毒力强弱有很大的关系。该模型中病毒株的来源为河南樱桃谷鸭DHBV的一株分离株,其基因序列明确,易感性较高,经胫静脉注射后3日龄雏鸭感染率为100%。采用DHBV 1.6×106mL-1拷贝数阳性血清0.20 mL感染3日龄雏鸭,连续观察42 d,发现可维持较高的病毒血症而无明显的自然转阴现象, 具有良好的稳定性。其血清和肝脏中DHBV DNA分别在14、21 d达到高峰,在42 d内保持较高的水平。与邓学龙等[9]报道的广州樱桃谷鸭模型相比,病毒血症持续时间更长。胡权等[10]建立的湖北麻鸭乙肝模型,采用DHBV DNA重组质粒转染细胞上清感染雏鸭,第7天出现病毒血症,第11天达到峰值,第33天开始逐渐下降,与该研究结果也有一定差异。抗HBV药物筛选动物实验中,用药时间一般为10~15 d,该模型血清和肝脏中DHBV DNA 连续观察42 d均维持较高水平,能够满足实验需求。

图2 鸭肝组织病理切片(HE,×400)
该研究采用抗HBV药物3TC对模型进行验证,进一步证明了模型的可靠性。3TC是第一个用于治疗乙肝的经典核苷类药物,1999年在中国上市。该药物具有明确的药理作用,能够有效地抑制HBV DNA的复制[11],改善肝组织病理状态。由实验结果可知,与模型组相比,3TC组鸭用药后血清和肝脏中不同时间的DHBV DNA拷贝数均有明显下降,在用药10 d后,血清和肝脏DHBV DNA抑制率分别达到86.5%和84.9%。而且可观察到用药10 d后3TC组鸭肝病理状态得到明显改善。因此,该模型可作为理想的DHBV后天感染疾病模型,为后期HBV的研究和抗HBV药物的筛选和评价奠定基础。
[1]Van Damme P, Zanetti AR, Shouval D, et al. Strategies for global prevention of hepatitis B virus infection[J]. Adv Exp Med Biol, 2010, 659: 175
[2]孔祥平,刘光泽,易学瑞,等.复制型HBV转基因小鼠的建立与应用[J]. 解放军医学杂志,2011,36(9):954
[3]Jilbert AR, Botten JA, Miller DS, et al. Characterization of age- and dose-related outcomes of duck hepatitis B virus infection[J]. Virology, 1998, 244(2): 273
[4]刘扬科, 郑立运, 常俊标,等.鸭乙型肝炎病毒荧光定量PCR检测方法的建立及应用[J]. 扬州大学学报:农业与生命科学版, 2010, 31(3): 7
[5]张传涛, 廖志航, 陈东辉, 等. 乙型肝炎病毒感染细胞与动物模型研究现状[J]. 军医进修学院学报, 2010, 31(10): 1036
[6]张喜武,李永吉,方建,等.丁香苦苷固体脂质纳米粒抗鸭乙肝病毒的实验研究[J].中医药信息,2011,28(2):107
[7]梁荣感, 苏何玲, 宋芸娟, 等. 桂林麻鸭先天性鸭乙肝病毒模型的研究[J]. 中国现代医学杂志, 2006, 16(11): 1654
[8]唐霓, 黄爱龙, 郭树华, 等. 鸭乙型肝炎病毒体液免疫血清学指标的系统建立与应用[J].中华肝脏病杂志, 2001, 9(1): 13
[9]邓学龙, 刘妮, 郭兴伯, 等. 亚乙型肝炎病毒实验感染樱桃谷鸭后在肝脏和外周血中的动态[J]. 广州中医药大学学报, 1997, 14(1): 37
[10]胡权, 方瑗, 张正茂, 等. 湖北麻鸭乙型肝炎病毒体内感染模型的建立[J]. 中华实验和临床病毒学杂志, 2008, 22(2): 113
[11]付喜花,梁蔚芳,吴小东,等.鸭乙型肝炎病毒YMDD突变株体外耐药模型建立[J]. 南方医科大学学报,2011,31(4):633
