瘦素和多囊卵巢综合征(PCOS)伴非酒精性脂肪肝(NAFLD)相关性的临床观察
2013-11-19王兴娟
陈 熤 王兴娟 靳 岭
(复旦大学附属华山医院中西医结合科 上海 200040)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种常见的妇科内分泌疾病,其发病率达5%~11%[1]。既往研究证实雄激素、黄体生成激素的异常升高为PCOS主要病理环节,随着研究不断深入,人们逐渐认识到糖脂代谢紊乱对PCOS的影响。近年来,由于人们的饮食结构和生活方式的改变,PCOS 伴非酒精性脂肪肝(non-acoholic fatty liver disease,NAFLD)的发病率正呈逐年上升趋势,研究提示PCOS患者是NAFLD高风险人群[2]。Cerda等[3]报道41%PCOS患者存在NAFLD,还有学者发现非肥胖PCOS患者其NAFLD患病率也明显升高[4],由此认为PCOS与NAFLD两种疾病在临床上有着内在联系。目前研究发现胰岛素抵抗(insulin resistance,IR)可能是两者的共同病理基础[5],也有报道显示瘦素也参于了 PCOS与NAFLD发病机制[6],为此,本研究将通过对PCOS伴或不伴NAFLD的临床资料进行分析,进一步探讨瘦素与PCOS-NAFLD之间的关系。
资料和方法
一般资料 收集2008年7月至2011年6月于复旦大学附属华山医院中西医结合科门诊就诊的35名PCOS伴NAFLD患者[脂肪肝组,平均年龄(26.0±4.9)岁],同期选择35名PCOS不伴NAFLD患者[非脂肪肝组,平均年龄(25.4±2.8)岁],健康女性志愿者20例[对照组,平均年龄(23.7±2.4)岁]。所有患者在3个月内未服用激素以及相关药物。本临床观察通过伦理委员会批准[复旦大学附属华山医院伦理委员会(2008 临审第(67号],所有受试者均签署知情同意书。
诊断标准 PCOS选用2004年鹿特丹PCOS诊断改良标准[7]:(1)稀发排卵或无排卵;(2)临床或者生化的高雄激素表现;(3)超声显示单侧或双侧卵巢内卵泡≥12个(直径在2~9mm)和/或卵巢体积(长×宽×厚/2)>10。以上3项具备2项并排除其他原因所致高雄激素血症的疾病,如Cushing综合征、肾上腺皮质增生症、分泌雄激素肿瘤等,即可诊断。NAFLD根据中华医学会肝脏病学分会脂肪肝和酒精性肝病学组2006年制定的《非酒精性脂肪性肝病诊疗指南》确立诊断[8]:(1)无饮酒史或饮酒折合乙醇量:女性<70g/周;(2)除外病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性等可导致脂肪肝的特定疾病;(3)除原发疾病临床表现外,可有乏力、消化不良、肝区隐痛、肝脾肿大等非特异性症状及体征;(4)可有体重超重和(或)内脏性肥胖、空腹血糖增高、血脂紊乱、高血压等代谢综合征相关组分;(5)血清转氨酶可升高,并以 ALT为主;(6)超声影像学诊断为脂肪肝;(7)肝脏组织学有典型脂肪肝表现。具备以上第1~5项和第6项或第7项者[9]。
研究方法
一般检查 同一观察者询问并记录病史,测量身高(height,H)、体重(weight,W)、腰围(waist circumference,WC)及臀围(hip circumference,HC),计算体重指数(body mass index,BMI)=W/H2。腰臀比(wasit hip ratio,WHR)=WC/HC。
血样本采集和处理 选择早卵泡期(月经第3~5天)或闭经者在基础体温于低相、B超示无优势卵泡的情况下,并嘱抽血前一晚避免高脂、高糖饮食,晚8点以后禁食,按时睡眠,取血前半小时避免剧烈运动和情绪激动。于清晨7:30~8:00,空腹抽取肘静脉血(另留取8mL送至实验室)送至华山医院生化检验室常规检测:黄体生成素(luteinizing hormone,LH)、促卵泡成熟激素(follicle-stimulating hormone,FSH)、雌二醇(estradiol,E2)、睾酮(testosterone,T)、催乳素(prolactin,PRL)、空腹血糖(fasting blood glucose,FBG)、空腹胰岛素(fasting insulin,FINS)、餐后2h血糖(2hpostprandial blood glucose,2hPBG)、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、高密度脂蛋白(high-density lipoproteins cholesterol,HDL-C)、低密度脂蛋白(low-density lipoprotein cholesterolLDL-C丙氨酸转氨酶(alanine transaminase,ALT)。另留取血样本于2 500r/min离心25min,低温-40℃下保存血清,用于检测瘦素。
检测方法和试剂、仪器 采用化学发光法测定血清LH、FSH、E2、T、PRL水平(美国罗氏公司试剂盒);酶法测定血清FBG、FINS、PBG、TG、TC(上海景源公司试剂盒)及HDL-C水平(日本积水公司试剂盒);清除法测定LDL-C水平(日本积水公司试剂盒);37℃速率法测定ALT(美国CENTRONIC公司试剂盒),以上均由华山医院检验科专职人员进行测定。ELISA法测定血清瘦素水平(德国DRG公司试剂盒)。IR指数用HOMA稳态评估法(HOMA-IR=FBG×FINS/22.5)评定。超声检测:由华山医院超声医学科固定资深医师操作(超声仪器为西门子公司SEQUARE512)。分别探测子宫及卵巢的长径、宽径及前后径,计算卵泡数。肝B超显像。
结 果
各组间年龄与相关生理指标比较 各组间的年龄差异无统计学意义。脂肪肝组肥胖程度最严重,W、BMI、WC、HC、WHR水平均明显高于非脂肪肝组及对照组(P<0.05);非脂肪肝组的 W、BMI、WHR明显高于对照组(P<0.05,表1)。
各组间性激素水平比较 脂肪肝组与非脂肪肝组的T、LH、LH/FSH水平均显著高于对照组(P<0.05);而脂肪肝组与非脂肪肝组组间比无统计学意义;FSH水平低于对照组(P<0.05);3组组间的PRL、E2无统计学意义(表2)。
各组间血清瘦素、FBG、2hPBG、FINS、HOMAIR、TC、TG、HDL-C、LDL-C、ALT比较 脂肪肝组瘦素、2hPBG、FINS、HOMA-IR、TC、TG、HDL-C、LDL-C、ALT 均显著高于对照组(P<0.05);非脂肪组瘦素、FINS、2hPBG、HOMA-IR、LDL-C 均显著高于对照组(P<0.05),FBG、TC、TG、HDL-C及ALT与对照组无统计学意义;脂肪肝组与非脂肪组比较,脂肪肝组瘦素、FINS、2hPBG、HOMA-IR、TGLDL-CALT 显著升高(P<0.05HDL-C显著降低(P<0.05),FBG、TC差异无统计学意义(表3)。
表1 各组间年龄、W、BMI、WC、HC、WHR比较Tab 1 Comparison of age,W,BMI,WC,HC,WHR in three groups (±s)

表1 各组间年龄、W、BMI、WC、HC、WHR比较Tab 1 Comparison of age,W,BMI,WC,HC,WHR in three groups (±s)
vs.Control group,(1)P<0.05;vs.PCOS without NAFLD,(2)P<0.05.
Index PCOSControl(n=20)23.70±2.4051.22±4.5419.95±1.7172.02±5.6592.02±5.0004 0.78±0.
表2 各组间性激素指标比较Tab 2 Comparison of T,PRL,FSH,LH,LH/FSH,E2in three groups (±s)
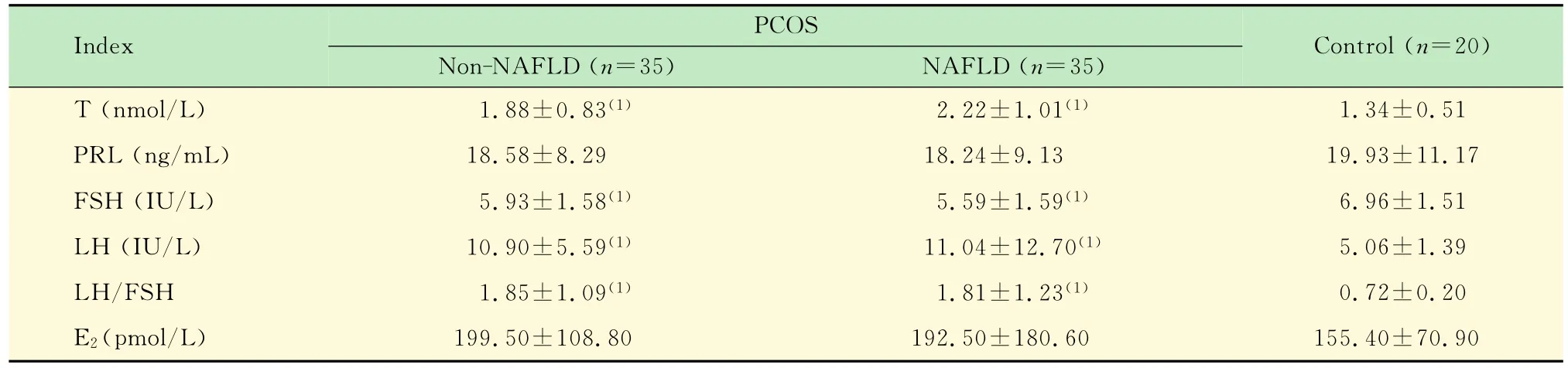
表2 各组间性激素指标比较Tab 2 Comparison of T,PRL,FSH,LH,LH/FSH,E2in three groups (±s)
vs.Control group,(1)P<0.05.
Index PCOSControl(n=20)1.34±0.5119.93±11.176.96±1.515.06±1.39 0.72±0.2090155.40±70.
表3 各组间瘦素血糖、胰岛素、HOMA-IR、血脂及ALT比较Tab 3 Comparison of leptin,FBG,FINS,2hPBG,HOMA-IR,TC,TG,HDL-C,LDL-C,ALT in three groups (±s)

表3 各组间瘦素血糖、胰岛素、HOMA-IR、血脂及ALT比较Tab 3 Comparison of leptin,FBG,FINS,2hPBG,HOMA-IR,TC,TG,HDL-C,LDL-C,ALT in three groups (±s)
vs.Control group,(1)P<0.05;vs.PCOS without NAFLD,(2)P<0.05.
Index PCOSControl(n=20)5.15±3.204.65±0.275.47±1.824.97±0.81 1.13±0.394.34±0.740.78±0.401.66±0.382.11±0.533420.11±12.
PCOS伴NAFLD的瘦素与生理指标、性激素、糖脂代谢相关内分泌激素的相关性分析 瘦素与年龄、W、BMI、WC、HC、WHR、FINS、HOMA-IR 及TG呈均显著正相关性,与HDL-C呈显著负相关性(P均<0.01);而与 T、PRL、FSH、LH、E2、FBG、TC无显著相关性(表4)。
由于体重增加可能参与NAFLD的形成,故采用Patial偏相关分析控制与体脂有关的如W、BMI、WC、HC、WHR后,瘦素水平与 HOMA-IR、TG仍有显著正相关性(r为0.489、0.310,P<0.01)。

表4 瘦素与生理指标、性激素、糖脂代谢相关内分泌指标的相关性比较Tab 4 Correlation between leptin and physiological index,sex hormones,glucolipid endocrine metabolism related index in PCOS with NAFLD group
讨 论
瘦素是由脂肪细胞分泌的一种具有肥胖基因编码的激素样蛋白质,瘦素与其受体结合发挥广泛的生理作用:控制食欲和增加机体能量消耗;影响一系列机体代谢过程,如胰岛素的释放,葡萄糖的产生、转运、代谢,脂肪的分解合成及部分性激素的分泌等[10]。目前有报道瘦素可影响PCOS患者的体重、神经内分泌、卵巢功能和生育功能[11],并与NAFLD的发病也密切相关。Atamer等[12]观察到在PCOS、NAFLD人群中瘦素水平异常增高,会加重病情的发展。而本研究发现PCOS伴NAFLD的瘦素、W、BMI、W/H、TG、LDL-C水平均明显高于PCOS不伴NAFLD及对照组,并且在控制与体脂有关的如W、BMI、WC、HC、WHR后,瘦素与 TG仍然成正相关性,这其中的原因可能是PCOS伴NAFLD引起肥胖,导致脂肪细胞异常增值,促使瘦素水平过度升高,形成高瘦素血症,影响瘦素受体后信号转导,产生瘦素抵抗[13-14],而瘦素抵抗又会进一步加重高瘦素血症状态,形成恶性循环,干扰瘦素发挥正常的生理学效应,从而对PCOS伴NAFLD发病起了重要作用。
有报道瘦素与IR有着十分密切的联系,而IR被认为是PCOS与NAFLD可能的共同发病基础。本研究证实PCOS伴NAFLD的FINS、HOMA-IR水平显著高于PCOS不伴NAFLD及对照组,这与国内外研究相一致[15-16]。进一步分析显示PCOS伴NAFLD患者的瘦素与FINS、HOMA-IR水平呈显著正相关性趋势(P<0.05),采用Patial偏相关分析控制与体脂有关的因素,瘦素与HOMA-IR仍有显著正相关性,提示PCOS伴NAFLD存在明显的IR,瘦素水平与IR严重程度密切相关。Fehmann等[17]研究发现瘦素与IR的这种关系可能与人体内存在脂肪-胰岛内分泌轴有关,瘦素可以结合胰岛β细胞瘦素受体,导致胰岛β细胞超级化状态,抑制胰岛素分泌,减少脂肪合成及储存。也有学者认为[18],瘦素与胰岛素之间存在双向调节,胰岛素可通过活化酪氨酸磷酸酶(SHP-1)抑制JAK2的磷酸化,干扰瘦素的受体后信号传导。另一方面,瘦素通过减弱胰岛素底物1(IRS-1)磷酸化,并阻止生长因子受体结合蛋白2与胰岛素受体底物-1的结合,影响胰岛素信号转导,造成IR[19-20]。IR引起的高胰岛素血症可以刺激LH的过度分泌,出现高LH血症,导致卵泡中颗粒细胞增殖终止,不能发育到排卵前阶段,表现为无排卵或稀发排卵状态。同时,高胰岛素血症还可直接作用于卵泡膜细胞,加强雄激素合成酶P450c17α的活性,从而增加卵巢雄激素的合成[21],产生PCOS典型的高雄激素血症。另外,Pehlivanov等[22]研究表明在PCOS患者中,高瘦素血症可影响脂肪-胰岛内分泌轴反馈机制,使瘦素抑制胰岛素分泌的能力下降,加重IR及高胰岛素血症,引起肝脏摄取脂肪增加,肝细胞色素P4502E1(CYP2E1)表达升高,导致肝细胞损伤或诱导中性粒细胞和其他炎性细胞的聚集和浸润,产生NAFLD。而高瘦素血症还可影响“下丘脑-垂体-卵巢性腺轴”各个层面,导致性激素分泌失调。研究表明在下丘脑-垂体-卵巢等相应的细胞组织中均存在着瘦素受体[23-25]。瘦素可通过减少弓状核(ARC)中神经肽Y(NPY)的表达,降低NPY对GNRH释放的抑制作用[26],引起GNRH分泌增加;瘦素作用于垂体,刺激LH释放[24];瘦素可抑制胰岛素样生长因子-1对卵巢颗粒细胞和卵泡膜细胞的作用,影响颗粒细胞分化与卵细胞成熟[25],导致内分泌紊乱和排卵障碍。由此可见,瘦素可通过干扰胰岛素正常代谢,介导脂肪-胰岛内分泌轴的紊乱状态,造成IR,直接或间接引起高胰岛素血症、脂代谢异常以及排卵障碍,影响卵泡发育及优势卵泡的成熟,加重生殖内分泌功能紊乱及NAFLD的病理状态。
综上所述,瘦素水平异常与PCOS伴NAFLD的形成密切相关,因此及早重视瘦素干预,对于防治PCOS伴NAFLD有重要意义。
[1] Setji TL,Holland ND,Sanders LL,et al.Nonalcoholic steatohepatitis and nonalcoholic fatty liver disease in young women with polycystic ovary syndrome[J].J Clin Endocrinol Metab,2006,91(5):1741-1747.
[2] 陈晖,张真稳,朱妍,等.伴或不伴非酒精性脂肪肝对多囊卵巢综合征患者代谢指标的影响[J].南京医科大学学报,2010,30(11):1629-1640.
[3] Cerda C,Pérez-Ayuso RM, Riquelme A,et al.Nonalcoholic fatty liver disease in women with polycystic ovary syndrome[J].J Hepatol,2007,47(3):412-417.
[4] Gambarin-Gelwan M,Kinkhabwala SV,Schiano TD,et al.Prevalence of nonalcoholic fatty liver disease in women with polycystic ovary syndrome[J].Clin Gastroenterol Hepatol,2007,5(4):496-501.
[5] Yildizhan R,Ilhan GA,Yildizhan B,et al.Serum retinolbinding protein 4,leptin,and plasma asymmetric dimethylarginine levels in obese and nonobese young women with polycystic ovary syndrome[J].Fertil Steril,2011,96(1):246-250.
[6] Golbahar J,Das NM,Al-Ayadhi MA,et al.Leptin-toadiponectin,adiponectin-to-leptin ratios,and insulin are specific and sensitive markers associated with polycystic ovary syndrome:A case-control study from bahrain[J].Metab Syndr Relat Disord,2012,10(2):98-102.
[7] Rotterdam ESHRE/ASRM-sponsored PCOS consensus workshop group.Revised 2003 consensus on diagnostic criteria and longterm health risks related to polycystic ovary syndrome(PCOS)[J].Fertil Steril,2004,81(1):19-25.
[8] Zeng MD,Fan JG,Lu LG,et al.Guidelines for the diagnosis and treatment of nonalcoholic fatty liver diseases[J].J Dig Dis,2008,9(2):108-112.
[9] 中华人民共和国卫生部制定.中药新药临床研究指导原则[M].北京:人民卫生出版社,1993:176-241.
[10] Zhang Y,Proenca R,Maffei M,et al.Positional cloning of the mouse obese gene and its human homologue[J].Nature,1994,372(6505):425-432.
[11] Remsberg KE,Talbott EO,Zborowski JV,et al.Evidence for competing effects of body mass,hyperinsulinemia,insulin resistance,and androgens on leptin levels among lean,overweight,and obese women with polycystic ovary syndrome[J].Fertil Steril,2002,78(3):479-486.
[12] Atamer A,Demir B,Bayhan,et al.Serum levels of leptin and homocysteine in women with polycystic ovary syndrome and its relationship to endocrine,clinical and metabolic parameters[J].J Int Med Res,2008,36(1):96-105.
[13] Kloek C,Haq AK,Dunn SL,et al.Regulation of Jak kinases by intracellular leptin receptor sequences[J].J Biol Chem,2002,277(44):41547-41555.
[14] Frühbeck G.Intracellular signalling pathways activated by leptin[J].Biochem J,2006,393(Pt 1):7-20.
[15] Kalra A,Nair S,Rai L.Association of obesity and insulin resistance with dyslipidemia in Indian women with polycystic ovarian syndrome[J].Indian J Med Sci,2006,60(11):447-453.
[16] Cerda C,Pérez-Ayuso RM, Riquelme A,et al.Nonalcoholic fatty liver disease in women with polycystic ovary syndrome[J].J Hepatol,2007,47(3):412-417.
[17] Fehmann HC,Berghöfer P,Brandhorst D,et al.Leptin inhibition of insulin secretion from isolated human islets[J].Acta Diabetol,1997,34(4):249-252.
[18] Kellerer M,Lammers R,Fritsche A,et al.Insulin inhibits leptin receptor signalling in HEK293 cells at the level of janus kinase-2: apotential mechanism for hyperinsulinaemia-associated leptin resistance [J].Diabetologia,2001,44(9):1125-1132.
[19] Hennige AM,Stefan N,Kapp K,et al.Leptin downregulates insulin action through phosphorylation of serine-318 in insulin receptor substrate 1[J].FASEB J,2006,20(8):1206-1208.
[20] Cohen B,Novick D,Rubinstein M.Modulation of insulin activities by leptin[J].Science,1996,274(5290):1185-1188.
[21] Holte J.Polycystic ovary syndrome and insulin resistance thrifty genes struggling with over-feeding and sedentary life style[J].J Endo Invest,1998,21(9):589-601.
[22] Pehlivanov B,Mitkov M.Serum leptin levels correlate with clinical and biochemical indices of insulin resistance in women with polycystic ovary syndrome[J].Eur J Contracept Reprod Health Care,2009,14(2):153-159.
[23] Leshan RL,Bjornholm M,Munzberg H,et al.Leptin receptor signaling and action in the central nervous system[J].Obesity,2006;14(5):208-212.
[24] Martos-Moreno GA,Chowen JA,Argente J.Metabolic signals in human puberty:effects of over and undernutrition[J].Mol Cell Endocrinol,2010,324(1-2):70-81.
[25] Sir-Petermann T,Maliqueo M,Codner E,et al.Early metabolic derangements in daughters of women with polycystic ovary syndrome[J].J Clin Endocrinol Metab,2007,92(12):4637-4642.
[26] Plant TM,Shahab M.Neuroendocrine mechanisms that delay and initiate puberty in higher primates[J].Physiol Behav,2002,77(4-5):717-722.
