新型含吡唑基1,2,4-三唑并[3,4-b]-1,3,4-噻二唑衍生物的合成
2013-11-19郑玉国魏全鲜宋泽斌张国义
郑玉国, 魏全鲜, 陆 寅, 吴 美, 宋泽斌, 张国义
(兴义民族师范学院 绿色化学合成技术研究所
吡唑类化合物具有广泛的生物活性[1~10]。以吡唑环为母体进行结构修饰在药物研发中具有广泛的应用。目前已经商品化的吡唑类药物有杀菌剂呋吡菌胺和吡噻菌胺,杀虫剂敌蝇威、锐劲特和吡虫酰胺等。
研究发现,1,2,4-三唑[3,4-b]-1′,3′,4′-噻二唑衍生物具有广泛的生物活性,如抑菌、抗肿瘤、抗病毒等[11~14]。本文在前期[14]工作的基础上,根据活性基团拼接原理,将吡唑基团和1,2,4-三唑[3,4-b]-1,3,4-噻二唑同时引入同一分子中,设计并合成了7个新型的含吡唑基1,2,4-三唑[3,4-b]-1,3,4-噻二唑衍生物(4a~4g, Scheme 1),其结构经1H NMR, IR及元素分析表征。
Scheme1
1 实验部分
1.1 仪器与试剂
X-5型熔点仪(温度计未校正);JEOL-ECX 400 NMR型核磁共振仪(DMSO-d6为溶剂,TMS为内标);IR Prestige-21型红外光谱仪(KBr压片);Elementar Vario-Ⅲ型元素分析仪。
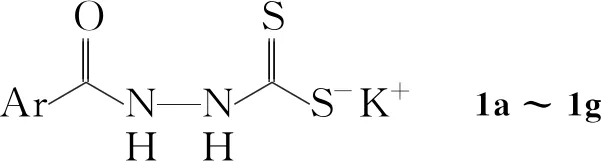
1a~1g[15]和1-苯基-3-甲基-5-氯-4-吡唑甲酸(3)[16]按文献方法合成;其余所用试剂均为分析纯,直接使用。
1.2 合成
(1) 4-氨基-5-取代苯基-1,2,4-三唑-3-硫酮(2a~2g)的合成
在反应瓶中加入1a~1g10 mmol,乙醇20 mL和80%水合肼0.6 g(12 mmol),搅拌下回流反应7 h。冷却至室温,过滤,滤液用水(100 mL)稀释,浓盐酸中和至中性,析出固体。过滤,滤饼用水洗涤,干燥后用无水乙醇重结晶得2a~2g。
2a: 白色晶体,收率76%, m.p.185 ℃~188 ℃;1H NMRδ: 13.92(s, 1H, NH), 8.01~8.03(m, 2H, PhH), 7.51~7.54(m, 3H, PhH), 5.79(s, 2H, NH2)。
2b: 白色粉末,收率68%, m.p.161 ℃~163 ℃;1H NMRδ: 13.95(s, 1H, NH), 748~7.66(m, 4H, ArH), 5.52(s, 2H, NH2)。
2c: 白色晶体,收率86%, m.p.191 ℃~192 ℃;1H NMRδ: 14.00(s, 1H, NH), 8.05~8.07(m, 2H, ArH), 7.62~7.59(m, 2H, ArH), 5.80(s, 2H, NH2)。
2d: 白色片状晶体,收率78%, m.p.140 ℃~143 ℃;1H NMRδ: 13.94(s, 1H, NH), 7.89~7.51(m, 4H, ArH), 5.59(s, 2H, NH2)。
2e: 白色粉末,收率79%, m.p.196 ℃~198 ℃;1H NMRδ: 14.03(s, 1H, NH), 7.86(s, 1H, ArH), 7.61~7.68(m, 2H, ArH), 5.53(s, 2H, NH2)。
2f: 白色晶体,收率76%, m.p.197 ℃~199 ℃;1H NMRδ: 13.97(s, 1H, NH), 7.56~7.05(m, 4H, ArH), 5.43(s, 2H, NH2), 3.81(s, 3H, OCH3)。
2g: 白色晶体,收率81%, m.p.165 ℃~167 ℃;1H NMRδ: 13.88(s, 1H, NH), 7.32~7.50(m, 4H, ArH), 5.56(s, 2H, NH2), 2.27(s, 3H, CH3)。
(2) 4a~4g的合成
在反应瓶中依次加入2a~2g1 mmol, 3 0.24 g(1 mmol)和POCl320 mL,搅拌下于105 ℃反应8 h(TLC检测)。静置冷却至室温,慢慢倒入碎冰中,加入适量的碳酸钾调至中性,静置,析出固体,抽滤,滤饼用无水乙醇重结晶(4a,4c,4d,4e和4g)或经硅胶柱层析[4b和4f,洗脱剂:V(石油醚) ∶V(乙酸乙酯)=2 ∶1]纯化得4a~4g。
2 结果与讨论
在4的合成中,搅拌状态下将反应物慢慢倒入装有碎冰的烧杯中,避免了反应滞后性聚集产生的热量暴沸喷出来,再加碱调至中性,而不是直接旋蒸除去三氯氧磷,避免了三氯氧磷对泵的腐蚀。冰浴下用弱碱调节pH,避免了吡唑环的氯基团被羟基取代变成酚羟基。
4a~4g的实验结果见表1,表征数据见表2。从表2可见(以合成4f为例),2f转变为4f后,其1H NMR谱中NH质子和NH2质子峰消失,出现CH3质子峰(2.50),说明发生了反应。苯环上质子峰化学位移值在7.14~7.68出现。谱图上3.85的单峰归属OCH3质子峰。
IR分析表明,苯环C-H伸缩振动分别出现在3 059 cm-1和3 005 cm-1, C=C骨架伸缩振动吸收在1 607 cm-1, 1 584 cm-1和1 459 cm-1;2 967 cm-1为甲基不对称吸收,1 409 cm-1附近吸收峰为CH3的对称变形振动,1 720 cm-1有C=N伸缩振动强吸收峰,在693 cm-1有C-S-C伸缩振动强吸收峰。

表 1 4a~4g的实验结果和元素分析数据Table 1 Experimental results and elemental analysis data of 4a~4g

表 2 4a~4g的1H NMR和IR数据Table 2 1H NMR and IR data of 4a~4g
[1] 杨金凤,陶晶,李炳奇,等. 芳基吡唑腙及其双杂环化合物的合成与抗菌活性[J].合成化学,2009,17(2):151-154.
[2] 刘新华,白林山,王世范,等. 5-(2-羟基苯基)-3-甲基吡唑酰胺衍生物的合成与杀菌活性[J].合成化学,2006,14(2):147-149.
[3] 闫启东,徐俊,徐峰,等. 1-[6-(3,5-二甲基-1H-吡唑-1-基)-1,2,4,5-四嗪-3-基]酰肼及其衍生物的合成与表征[J].合成化学,2011,19(6):709-713.
[4] 廖国辉,张阳,魏宁宁,等. 1-甲基-3-二氟甲基-4-吡唑酰胺类衍生物的合成及其抑菌活性[J].合成化学,2011,19(1):19-23.
[5] Fustero S, Roman R, Fu J,etal. Villanova,regioselective pyrazole formation[J].J Org Chem,2008,73(21):8545-8552.
[6] Hall A, Billinton A, Bristow A K,etal. Discovery of brain penetrant,soluble,pyrazole amide EP1 receptor antagonists[J].Bioorg Med Chem Lett,2008,18(14):4027-4032.
[7] Ohno R, Watanabe A, Nagaoka M,etal. Synthesis and herbicidal activity of new pyrazole-4-carboxamide derivatives[J].J Pestic Sci,2004,29(1):96-104.
[8] Rapposelli S, Lapucci A, Minutolo F,etal. Synthesis and COX-2 inhibitory properties ofN-phenyl- andN-benzyl-substituted amides of 2-(4-methylsulfonylphenyl)cyclopent-1-ene-1-carboxylic acid and of their pyrazole,thiophene and isoxazole analogs[J].II FARMACO,2004,59(1):25-31.
[9] Santos F, Raquel R, Antonio S F,etal. Synthesis of new fluorinated tebufenpyrad analogs with acaricidal activity through regioselective pyrazole formation[J].J Org Chem,2008,73(21):8545-8552.
[10] Varnes J G, Wacker D A, Jacobson I C,etal. Design,structure-activity relationship,and pharmacokinetic profile of pyrazole-based indoline factor Xa inhibitors[J].Bioorg Med Chem Lett,2007,17(23):6481-6488.
[11] Karegoudar P, Prasad D J, Ashok M,etal. Synthesis,antimicrobial and anti-inflammatory activities of some 1,2,4-triazolo[3,4-b][1,3,4]thiadiazoles and 1,2,4-triazolo[3,4-b][1,3,4]thiadiazines bearing trichlorophenyl moiety[J].Eur J Med Chem,2008,43(4):808-815.
[12] Swamy S N, Priya B S, Prabhuswamy B,etal. Synthesis of pharmaceutically important condensed heterocyclic 4,6-disubstituted-1,2,4-triazolo-1,3,4-thiadiazole derivatives as antimicrobials[J].Eur J Med Chem,2006,41(4):531-538.
[13] Zhang L X, Zhang A J, Chen X X,etal. Synthesis and biological activity of 3-(2-furanyl)-6-aryl-1,2,4-triazolo[3,4-b]-1,3,4-thiadiazoles[J].Molecules,2002,7(8):681-689.
[14] 魏学,郑玉国,薛伟,等. 新型1,2,4-三唑并[3,4-b]-1,3,4-噻二唑类衍生物合成及抗病毒活性[J].合成化学,2010,18(5):595-598.
[15] 李黔柱,宋宝安,蔡学健,等.N-(1,2,4-三唑)含氟肉桂醛亚胺的合成及生物活性[J].有机化学,2010,30(4):569-575.
[16] 杨丽敏,华水波,刘钊杰. 含氯羧酸吡唑醛肟酯化合物的合成及生物活性[J].应用化学,2005,22(8):829-834.
