多种蚊媒病毒x-TAG悬浮芯片复合检测方法的建立*
2013-11-19孙肖红张晓龙赵婷婷曹晓梅
王 旺 王 静 孙肖红 杨 宇 张晓龙 赵婷婷 曹晓梅
(中国检验检疫科学研究院卫生检疫研究所, 北京 100123)
蚊媒病毒是一类重要的传染病病原体,包括多种病毒,其中很多造成过世界范围内的传染病大流行(詹希美, 2001)。近年来,随着全球气候逐渐上升、城市化进程的加快、旅游和贸易的快速发展、生态环境的不断变化,全球蚊媒传染病发病呈上升趋势,原有疾病的流行区域不断扩展、疾病的流行频度不断增加,有日益蔓延的趋势(Slenning, 2010)。因此开发针对蚊媒病毒特异、敏感且快速的检测方法对相应疾病的的预防、治疗以及流行的有效控制均具有重要意义。悬浮芯片(Suspension array)也称液相芯片(Liquid array, Liquid chip),是一种非常灵活的多功能技术平台,可以进行蛋白、核酸等生物大分子检测、受体和配体识别分析等研究。悬浮芯片主要通过可偶联探针的荧光编码微球与两束激光检测,对被测物的定性和定量分析,一个反应孔内可以完成100种不同的生物学反应,从而实现对核酸的多重检测(Dunbar, 2006)。本研究利用悬浮芯片系统为平台,针对十二种重要的蚊媒病毒,建立了一种能检测蚊子所携带的一种或多种病毒的迅速、准确而可靠的检测方法。
1 材料与方法
1.1 材料
1.1.1菌株及样品: 分别包含东方马脑炎病毒(Eastern equine encephalitis virus,EEEV)、西方马脑炎病毒(Western equine encephalitis virus,WEEV)、委内瑞拉马脑炎病毒(Venezuelan equine encephalitis virus,VEEV)、基孔肯亚病毒(Chikungunya virus,CHIK)、登革病毒(Dengue virus,DEN)、日本脑炎病毒(Japanese encephalitis virus,JEV)、黄热病毒(Yellow fever virus,YF)、西尼罗病毒(West Nile virus,WN)、圣路易斯脑炎病毒(St. louis encephalitis virus,SLEV)、版纳病毒(Banna virus,BAV)、布尼亚病毒(Bunyavirus,BUN)、裂谷热病毒(Rift Valley fever virus,RVF)12种病毒检测靶标基因的菌株,由北京华大基因公司合成基因片段后,转化至JM109菌株。现场样品来自2009年在中国云南边境地区的人房和畜圈采集的蚊虫标本。阴性蚊虫标本由辽宁出入境检验检疫局医学媒介中心提供。
1.1.2主要试剂及仪器:酶及缓冲液(TaKaRa,大连);DNA-marker(Takara,大连);胶回收试剂盒、RNA提取试剂盒(QIAGEN,Germany);逆转录试剂盒(PROMEGA,USA);MicroPlex-TAG Beads(Luminex,USA);藻红蛋白标记的链霉亲和素 (Streptavidin-R-phycoerythrin, SA-PE) Invitrogen公司SA-PE(Invitrogen,USA);96孔酶标板(Nunc,USA);Bioplex 100液相芯片检测系统(Bio-rad,USA)。
1.1.3引物设计与合成:通过DNAstar软件分别对每个属的基因进行序列比对和保守序列分析。用PrimerPlex软件设计特异性引物。每条上游引物5′端添加特异的 anti-TAG 序列(与Luminex公司提供x-TAG 磁性微球上的 TAG 序列反向互补),引物与TAG之间连接C9作为加臂,下游引物5′端用生物素修饰。PCR引物均由生工生物工程(上海) 有限公司合成(表1)。

表1 所用的12种蚊媒病毒的扩增引物Tab.1 Designed primers of the 12 species mosquito-borne virus for multi-PCR
注:EEEV: 东方马脑炎病毒 Eastern equine encephalitis virus; WEEV: 西方马脑炎病毒Western equine encephalitis virus; VEEV: 委内瑞拉马脑炎病毒 Venezuelan equine encephalitis virus; CHIK: 基孔肯亚病毒 Chikungunya virus; DEN: 登革病毒Dengue virus; JEV: 日本脑炎病毒 Japanese encephalitis virus; YF: 黄热病毒Yellow fever virus; WN: 西尼罗病毒 West nile virus; SLEV: 圣路易斯脑炎病毒 St. louis encephalitis virus; BAV: 版纳病毒 Banna virus; BUN: 布尼亚病毒 Bunyavirus; RVF: 裂谷热病毒 Rift valley fever virus。下同。The same below.
*斜体为anti-TAG 序列(与x-TAG磁性微球上的TAG序列反向互补)。Italics represents anti-TAG sequences(reverse complementary sequence of the TAG on the x-TAG magnetic microspheres).
1.2 方法
1.2.1菌株质粒提取: 将带有阳性克隆的工程菌用质粒微量提取试剂盒提取质粒DNA,操作方法按说明书进行,1%琼脂糖凝胶电泳,紫外灯下检测提取质粒。通过超微量紫外分光光度计测得各质粒浓度,并将其稀释到10 ng/μL备用。
1.2.2引物特异性验证: 将合成好的引物按说明溶解后,分别按如下配置PCR反应体系,12对引物对应的12种不同反应体系中对应加入已提取并稀释的DNA模板。PCR体系:10 × PCR buffer 3 μL;Taq HS 0.3 μL;dNTPs 4 μL;上下游引物(10 μmol/L)各0.5 μL;DNA 2 μL;双蒸水补足30 μL。反应条件是:94℃预变性10 min;94℃ 30 s,58℃ 30 s,72℃ 40 s,35个循环;最后72℃延伸7 min。
PCR阴性对照:除不加模板而以双蒸水代替外,其余体系相同。反应结束后以1%的琼脂糖凝胶电泳检查扩增情况。
1.2.3多重PCR体系及条件优化: 将12种待检病毒按种属分为3组,第1组为东方马脑炎病毒、西方马脑炎病毒、委内瑞拉马脑炎病毒、基孔肯亚病毒;第2组为黄热病毒、西尼罗脑炎病毒、登革病毒、乙型脑炎病毒、圣路易斯脑炎病毒;第3组为版纳病毒、布尼亚病毒、裂谷热病毒。并结合后续实验结果,对多重PCR的退火温度以及体系中加入引物量进行优化。
1.2.4杂交及杂交条件的优化: 取每种带有anti-TAG标签的微球各3 500个加入到杂交液中,使其总量为35 μL;向各管中加10 μL蚊媒病毒的PCR产物吹打混匀;向各孔加4 ng/μL SA-PE的1×TMAC液(全称),使之总体积变为80 μL,37℃下杂交一定时间;转移至磁力板上洗掉未结合的PCR产物再向各孔加入80 μL 1× TE溶液,振荡使微球重悬;用Bio-Plex 100 system进行检测,对结合的PCR产物进行分析。杂交条件的优化:分别对杂交温度、杂交时间和PCR产物加入量进行优化。杂交温度分别选择35℃、37℃、40℃、42℃、45℃ 5个温度进行,其他步骤照上述进行,保持不变,以MFI进行结果判断。确定杂交温度后,杂交时间分别取15、20、25、30 min,进行杂交时间的优化。
1.2.5检测体系特异性实验: 体系内特异性:将十二种病毒中每一种模板分别用其他11种检测引物扩增并杂交,上机检测MFI(mean fluorescence intensity)值,考核系统内对样品检测的特异性。
体系外特异性:选取了墨累谷脑炎、疟原虫、森林脑炎病毒、流行性出血热病毒作为对照,验证本检测方法的特异性。
1.2.6检测体系灵敏度实验: 待检目标核酸系列稀释,设10个稀释度,最优条件下进行检测,根据检测结果,用Bio-Plex Version 4.0分析系统得到检测体系的方程拟合标准曲线,同时得出检测体系的检测下限。
1.2.7实际样品检测试验:从液氮中取出冻存蚊虫标本,研磨后取上清140 μL用试剂盒提取RNA,然后用反转录试剂盒进行反转录,得到的cDNA用本方法进行检测。
2 结果
2.1 退火温度优化
按基本PCR体系,退火温度选择52℃、54℃、56℃、58℃、60℃,分别对3组待检病毒进行扩增,并同时设置PCR阴性对照,扩增结果用1%的琼脂糖凝胶电泳检查,结果证明56℃时3组中大部分病毒检测的MFI值均高于其他温度,因此选用56℃为退火温度。
2.2 引物对浓度优化
根据基本PCR体系对体系内各靶标的扩增情况,对3组PCR反应体系中12种引物的浓度进行调整,确保各组PCR产物在多重PCR体系中均能有效扩增扩增量接近,经调整后各组引物加入量(10 μmmol/L)见表2。
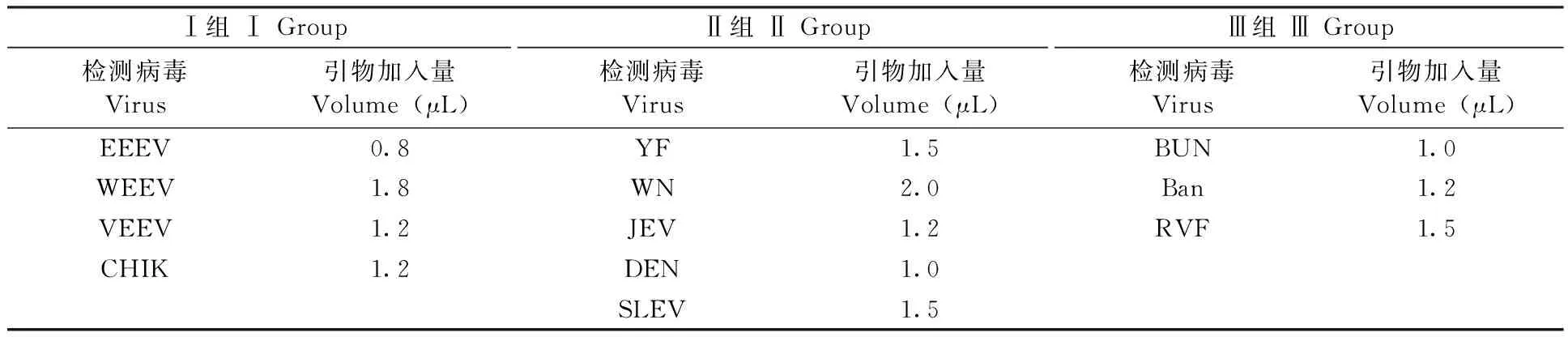
表2 多重PCR体系中优化的引物对加入量Tab.2 Optimized quantity of the primers in multi-PCR
2.3 杂交以及杂交条件的优化
PCR反应体系及反应过程条件优化完毕后,对杂交条件进行了优化,确保PCR产物经过杂交过程能够更好的与微球结合,从而得到更高的检测值。
2.3.1杂交温度的优化:杂交温度分别选择35℃、37℃、40℃、42℃、45℃ 5个温度进行,以信号荧光值MFI的高低作为条件优化的依据,结果如图1所示,在42℃时大部分病毒检测时得到的MFI值最高,因此选用杂交温度为42℃。
2.3.2杂交时间的优化:确定杂交温度后,杂交时间分别取15、20、25、30 min,同上一部分进行杂交时间的优化。结果如图2所示,在杂交进行到25和30 min时所得到的MFI相近,并且12种病毒的检测值普遍高于15和20 min,考虑到实验快捷性,选用杂交时间为25 min。
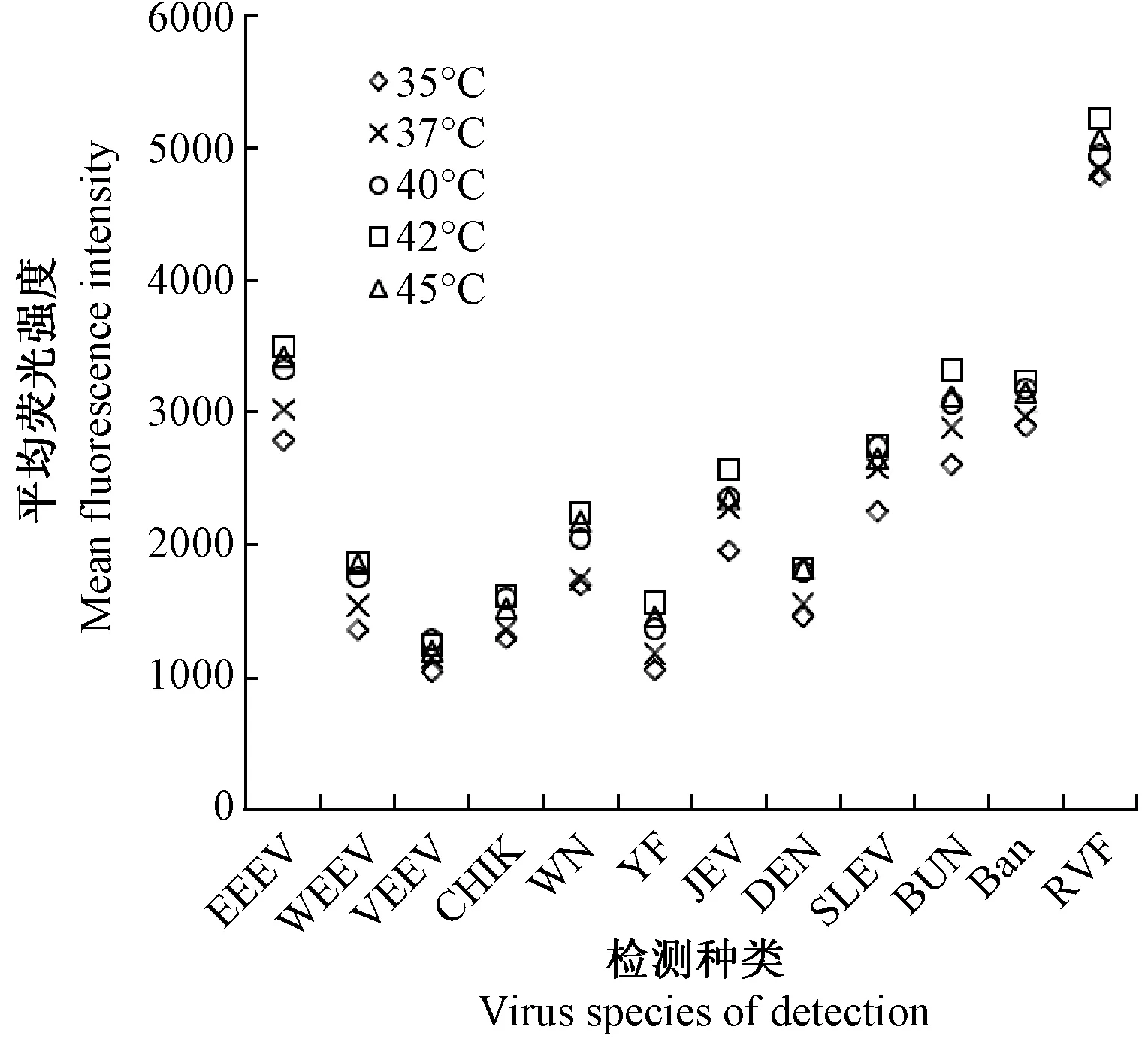
图1 杂交温度优化结果Fig.1 Optimized hybridization tempreture

图2 杂交时间优化结果Fig.2 Optimized hybridization duration
2.4 灵敏度实验
测定含待测病毒靶标的12种质粒浓度,分别进行系列稀释,PCR扩增后进行检测,Bio-Plex Version 4.0分析,得出剂量-反应曲线(图3)并根据方程算出检测下限。经计算,12种病毒检测下限如表4所示。
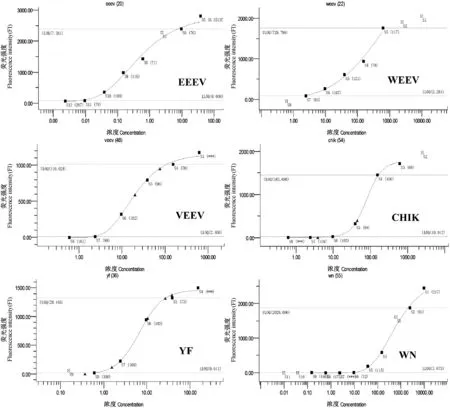
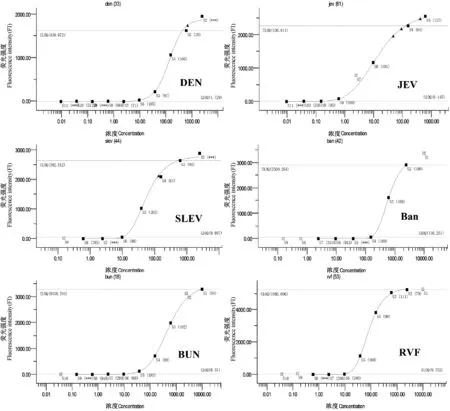
图3 杂交检测标准曲线Fig.3 Standard curve of hybridization detection
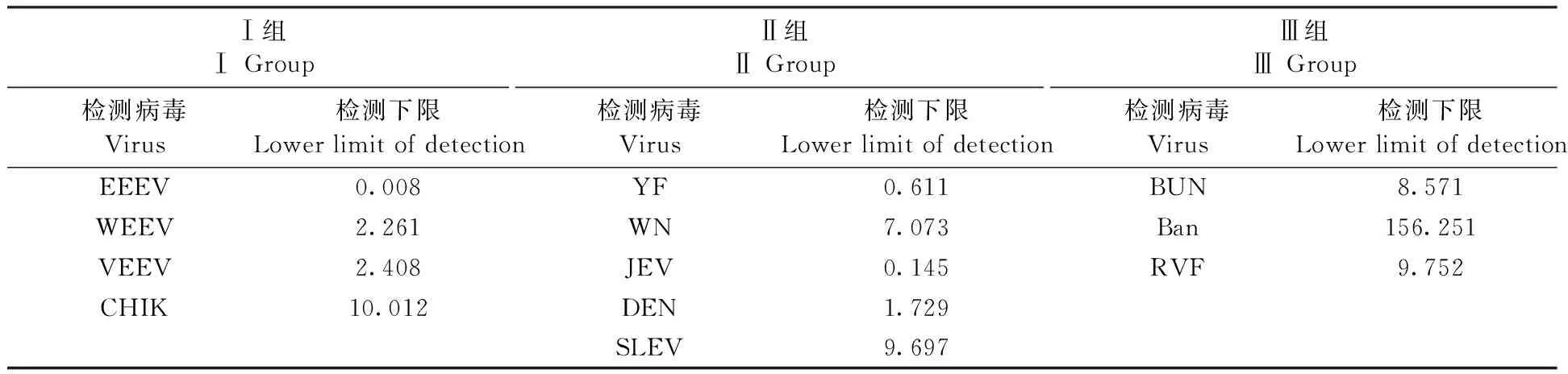
Ⅰ组Ⅰ GroupⅡ组Ⅱ GroupⅢ组Ⅲ Group检测病毒Virus检测下限Lower limit of detection检测病毒Virus检测下限Lower limit of detection检测病毒Virus检测下限Lower limit of detectionEEEV0.008YF0.611 BUN8.571 WEEV2.261 WN7.073 Ban156.251 VEEV2.408 JEV0.145RVF9.752 CHIK10.012 DEN1.729SLEV9.697
2.5 特异性检测
体系内交叉检测所得荧光值接近空白值,说明均与组内其他病毒间不发生交叉反应,特异性好,结果如图4所示。
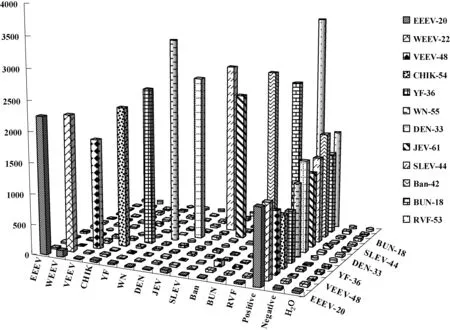
图4 检测特异性验证结果Fig.4 Evaluated result of the specific test
对墨累谷脑炎、疟原虫、森林脑炎病毒、流行性出血热病毒的基因组进行检测,荧光值均和空白值相当,表明仅与目标病毒进行反应,与其他虫媒病原体无交叉。
2.6 实际蚊虫样本检测
共研磨91份蚊虫样本,白纹伊蚊58只,淡色库蚊14只,三带喙库蚊6只,中华按蚊13只。其中2只淡色库蚊和7只白纹伊蚊检出乙脑病毒,其他未检出,与实验室用荧光定量PCR结果一致(郭金金等,2012),初步证明本研究建立的方法可靠,可以很好的用于实际样品的检测。
3 讨论
蚊媒病毒主要通过蚊虫叮咬在人群中传播,传播速度快、危害大,并且随着气候及环境的变化,有日益蔓延的趋势(Slenning, 2010)。我国南方地区气候潮湿、炎热,适合多种蚊媒病毒的繁殖,且传播媒介种类繁多,其中,许多蚊媒病毒的致病性、临床症状和流行季节均十分相似并存在严重的血清学交叉反应(Sahetal., 2009),因此建立特异敏感的检测手段对该类疾病的预防治疗与控制具有重要意义,建立复合检测方法对于蚊媒病毒的监测具有积极意义。
病毒的诊断方法主要有病毒分离培养、电子显微镜技术、血清学技术等。病毒分离法和血清学检测方法费时繁琐,达不到早期快速诊断的目的,免疫学方法进一步提高了灵敏度和特异性,但检测结果也与其他的病毒存在着一定程度的交叉反应。随着分子生物学技术的不断发展与完善,一些新型检测方法应运而生。悬浮芯片是近年来兴起的一种检测技术,与常规的病原分离鉴定、琼脂扩散试验、血凝和血凝抑制试验、免疫荧光法和ELISA等实验方法相比,它具有高通量、操作简便、重复性好、灵敏度高以及线性范围宽等优点,特别适合于多病原体的高通量检测及鉴定,并已广泛应用于各种病原体的检测中(Iannoneetal., 2001; Liuetal., 2011; Pabbarajuetal., 2011)。
目前悬浮芯片方法中杂交所采用的主要为直接杂交法,即在检测片段上选取一段序列作为探针,检测前需要预先用氨基化探针对微球进行包被(罗渊, 2008),步骤繁琐不易操作,并且多重检测中,由于多重探针的存在,杂交温度的选择也是一个技术开发时的瓶颈(Tayloretal., 2001)。x-TAG技术解决了这一问题,TAG 与anti-TAG 是基于结核分枝杆菌M.tuberculosis的序列设计而成,不含有碱基G,TAG与anti-TAG 精确互补、杂交温度恒为37℃,但这种方法杂交前需要用带有TAG序列的探针对第一步的扩增产物进行TSPE(target-specific primer extension),以得到带有TAG序列的单链片段,解决杂交温度统一性的同时也带来了耗时长,步骤繁琐的问题(Janseetal., 2012)。本研究结合前两种方法的优点,将TAG直接合成至引物上,从而在PCR扩增中直接将TAG序列引入扩增产物,减少了实验操作,同时大大缩短了检测时间,并且节省了实验所需试剂及耗材。
本实验建立的悬浮芯片检测方法经与实时定量PCR比对,对蚊虫样品的检测结果完全一致,并且有很好的特异性。并且由于杂交条件的同一性,所以在临床使用时,完全可以根据样本的不同特点,从中选择特殊组合的微球,临时搭配所需要的检测体系。该悬浮芯片检测方法的建立,不仅有利于积极开展新发传染病的监测、检测、风险评估和控制的研究,还可以有效预防和控制传染病的发生和传播,为传染病的流行趋势提供预测预警信息,具有广阔的应用前景。
