LAMP的影响因素及其检测寄生虫的研究进展*
2013-11-19薛俊宇
薛俊宇 李 华
(1. 南方医科大学公共卫生与热带医学学院病原生物学系暨广东普通高校新发传染病防治重点实验室, 广州 510515; 2. 南方医科大学第一临床医学院,广州 510515)
核酸检测在寄生虫检测中已发挥了重要作用,主要方法有核酸杂交、PCR、实时PCR等,但这些方法要求较高的实验条件,并且费用高。自从Notomi等(2000)建立环介导等温扩增法(Loop-mediated isothermal amplification,LAMP)以来,在疾病诊断中越来越受到青睐。LAMP具有操作简便、所需时间短、灵敏度高、特异性强等特点,目前已经用于各种病原体的检测及肿瘤、胚胎性别的鉴别等领域(Fuetal., 2011)。LAMP在检测过程中受到多种因素的影响,在寄生虫病诊断方面尚处于起步阶段。本文根据近年的研究进展,对寄生虫LAMP检测的影响因素及应用进行综述,为寄生虫病诊断研究提供参考。
1 LAMP检测寄生虫感染的影响因素
作为一种改良的核酸扩增技术,LAMP相对于传统PCR具有诸多优势。该技术利用目的基因的6个靶位设计4~6个引物,在60~65℃等温条件下,通过链置换反应形成茎环结构,能将原有的基因拷贝数扩增至109倍。但是在检验过程中,LAMP的检测效能受多种因素影响。
1.1 靶标基因的筛选
LAMP作为一种快捷有效的核酸检测方法,其检验能力与靶标基因的选择密切相关。基于6个靶标位点,LAMP能检测到几个拷贝数以上的DNA片段。在检测寄生虫感染时,可选取核糖体小亚基DNA(SSU rDNA)、特异性抗原基因及分子遗传标记等。
1.1.1核糖体小亚基DNA:核糖体小亚基DNA是目前公认具有广泛的物种多态性的基因,大量研究表明,核糖体小亚基DNA在细胞内拷贝数较多,且存在大量种属特异性的基因位点,已广泛应用于各类寄生虫的核酸检测中。van Eys等(1992)发现利什曼原虫SSU rDNA中央区片段动基体基因易发生突变,是检测动基体目原生动物的良好靶点。Fontanilla等(2008)发现管圆线虫属SSU rDNA 5′端480 bp内存在管圆线虫3期幼虫特异性基因位点。Chen等(2011)根据18S rDNA基因设计引物,对福寿螺肺组织内广州管圆线虫做LAMP检测,其特异性和敏感性均达到100%,检验极限达1 fg/μL。Han等(2007)根据四种疟原虫18S rDNA成功实现了LAMP的血清中疟原虫检测。鉴于上述成功的案例,SSU rDNA可作为寄生虫LAMP检测的候选靶标基因。
1.1.2特异性抗原基因: 随着ELISA等免疫学检测方法的应用,大量的特异性抗原被发现并应用于病原体的临床诊断中,而这些特异性抗原基因也逐渐应用于核酸检测中。Lau等(2011)根据诺氏疟原虫顶端膜抗原-1(apical Membrane antigen-1,AMA-1)设计引物,对74例血液样本做AMA-1 LAMP检测,与 SSU rDNA特异性巢式PCR对比,其敏感性及特异性均为100%。 Wang 等(2012)根据布氏锥虫属MAPK5(TbMAPK5)设计引物,对涎传锥虫亚属TbMAPK5 LAMP 的检验极限达到 1 000 虫体/mL。Iseki等(2007)利用牛巴贝虫的棒状体相关蛋白-1(rhoptry associated protein-1,RAP-1),通过在同一反应体系设计两套不同基因的引物,对牛血清中牛巴贝虫B.bovis和双芽巴贝虫B.bigemina进行多重LAMP检测,检验极限是传统PCR的105倍和巢式PCR的103倍。因此,特异性抗原基因可作为寄生虫潜在靶标基因。
1.1.3分子遗传标志: 在寄生虫病流行地区通常多种寄生虫并存。免疫诊断时常出现交叉阳性反应难以鉴别,因此,种属特异性核酸检测显得尤为重要。内转录间隔区(internal transcribed spacer,ITS)的长度和序列变化较大,可用于生物的种属鉴定。ITS-1区域受外界环境因素的影响较小,进化速度较快,是系统发育分析的重要分子标记(Chuetal., 2001),同时也是检测寄生虫基因多态性的一个重要基因(崔立云与张霄霄等, 2012)。Liu等(2013)利用ITS-LAMP成功区分瑟氏泰勒虫Theileriasergenti和中华泰勒虫Theileriasinensis。Liu等(2012)根据广州管圆线虫ITS-2基因对褐云玛瑙螺内广州管圆线虫做LAMP检测,结果显示其检验极限可达0.1 fg/μL。另外,线粒体DNA(mtDNA)与核DNA 的复制相对独立且无内含子, 其基因组的某些区域的序列进化速率相对较快,如细胞色素C 氧化酶3个亚基的编码基因(COⅠ、COⅡ和COⅢ)也是理想的分子遗传标志,在寄生虫地理株检测方面具有高度特异性(崔立云与张霄霄等, 2012)。
选择靶基因时,LAMP对靶基因片段的长度亦有限制。由于链置换反应对于LAMP的限制,其靶标基因的长度应选择在300 bp左右,若超过500 bp,则会导致扩增量的减小,不适合作为LAMP靶标基因(Lauetal., 2011)。
1.2 引物设计
引物在核酸检测中起关键性作用,引物设计的基本原则在此不作赘述。LAMP需根据靶标基因的6个靶点(F1-3,B1-3)设计2对引物。目前多采用PrimerExplorer (Eiken, Japan http://primerexplorer.jp/e/)或者LAMP Designer(PREMIER Biosoft, USA)软件进行引物设计(Notomietal., 2000; Tomlinson, 2013)。环状引物(loop Primer)根据LAMP产生的茎环结构设计,可以与茎环结构杂交而激活新一轮的扩增,一般为左右两条。若没有足够的环状引物的位点,可设计单条引物或者不添加环状引物。使用环状引物可明显缩短LAMP的反应时间,提高LAMP的检验极限(Nagamineetal., 2002)。Njiru(2008) 等利用LAMP检测布氏锥虫小鼠血清抗体相关基因(SRA gene)时,发现加入环状引物后LAMP最佳反应时间由原来的50 min缩短至20~25 min,且检验极限由原来的 1 000 虫体/mL降至1虫体/mL。
1.3 样本采集与处理
1.3.1样本的采集:目前LAMP检测可选的样本有脑脊液、血清、热处理的全血、组织、排泄物等。检测时,需根据寄生虫特点和寄生部位进行采样。对于不同虫株,由于诊断意义不同,取样部位也不同。如检测布氏锥虫宜采用血液样本,而检验二期人类非洲锥虫病(Human African Trypanosomiasis,HAT)则选用脑脊液标本(Njiruetal., 2011; Wangetal., 2012)。LAMP检测的样本来源详情见表1。Flinders Technology Associated研制的FTA ®试纸能够在室温下长期保存,简化操作步骤,减少DNA提取过程中交叉感染的可能性,适用于现场样本的采集(Yamamuraetal., 2009)。
1.3.2样本的预处理:由于Bst DNA多聚酶对于血浆中的多聚酶敏感度较低,因此,理论上LAMP检测的样本可不经处理,但利用表面活性剂预处理疟原虫标本可以提高LAMP的诊断效能(Grabetal., 2011)。常用的表面活性剂有Triton X-100和Tween-20等非离子型表面活性剂。某些原虫(如隐孢子虫等)由于其卵囊与人类细胞膜融合,表面出现脂筏结构,对氯和非离子表面活化剂耐受性增加(Sekikawaetal., 2011),因此,主要采用冻融法。在样本处理时若使用SDS,所获得的DNA还需纯化。Sekikawa(2011)发现隐孢子虫LAMP检测中用十二烷基肌氨酸钠(n-lauroylsarcosine sodium salt,LSS)代替SDS可以省略DNA纯化的步骤,但要注意使用浓度。0.01% LSS对Bst DNA无抑制作用,但大于0.1%的LSS对Bst DNA有抑制作用。作者在隐孢子虫样本中先用0.1%LSS处理,有效的从卵囊中提取DNA之后再加入5% Triton X-100 或Tween-20处理,使LSS浓度降至0.01%,从而减少LSS对Bst DNA的抑制作用。

表1 各类寄生虫LAMP检验情况Tab.1 Summary of LAMP detection of parasite in previous study
续表1Tab.1continued

分类Category种属Species检测基因/GeneBank序列号Gene/GeneBank Accessary No.样本来源 Specimen环Loop反应温度Reacting temperature检验极限Detecting limit参考文献ReferenceT.annulataAnkara hypothetical protein(TA04795)Blood+6310 pg/μLSalih et al., 2008T. evansiVSG gene (AJ870486)Blood+630.1 parasites/mLNjiru et al., 2010T. sergentip33(D87198)Blood-630.000002% para-sitemiaWang et al., 2010T. sergenti NingxianITS(EF547930)Blood-6110 fg/μLLiu et al., 2013T. sinensis WeiyuanITS(EF547932)Blood-6310 fg/μLTheileria parvap150 L47230Blood+63100 fgThekisoe et al., 2010PIM L41833Blood+60100 fg吸虫O.viverriniITS-1 (EU038151)Feces+651 pg/μLArimatsu et al., 2012TrematodeP.westermaniITS-2(AF159604)Multi-2+600.01 fg/μLChen et al., 2011S.japonicum28S ribosomal DNA (Z46504)Tissue-65100 fg/μLKumagai et al., 2010SjR2 (AF412221)Blood-650.08 fg/μLXu et al., 2010S.haematobiumDraI(DQ157698.1)Tissue-630.1 fg/μLAbbasi et al., 2010S.mansoniSm1-7(M61098.1)Tissue-630.1 fg/μL线虫A.cantonensis18S rRNA (AY295804.1)Tissue-651 fg/μLChen et al., 2011NematodeITS1(GU587760.1)Tissue-650.1fg/μLLiu et al., 2011W.bancroftiscaffold/matrix attachment region(AY297458)Blood-620.1 pg/μLTakagi et al., 2011B.malayiHha I(M12691)Blood+630.01 ngPoole et al., 2012绦虫T.saginataTsag-cox1 (AB441816)Feces-635 EPGNkouawa et al., 2010TeaniaT.asiaticaTasi-cox1 (AB441817)Feces-635 EPGT.soliumTsol-cox1 (AB441815)Feces-631 copies/tubeEchinococcus granulosus12S rRNA(AF297617)Eggs-631 egg/200 μL徐祥珍等, 2011巴贝斯虫B.gibsoni18S rDNA (AF205636)Blood-630.0005% para-sitemia1Ikadai et al., 2004BabesiaB.bovisRAP-1 (AF027149)Blood-640.0001% para-sitemia1Iseki et al., 2007B.bigeminaRAP-1 (M60878)Blood-640.00001% para-sitemia1B.canisputative rhoptry protein gene (M91168)Blood-6425 pg/μLMuller et al., 2010隐孢子虫C.hominisSAM geneFeces+63-Bakheit et al., 2008Cryptosporidi-umC.meleagridisC.parvumgp60(AB237136)Feces+63-C.andersoniHSP-70(DQ989577)Feces+63-C.bovis18SrRNA(3873244)Feces-65-阿米巴E.histolyticaSSU rDNA (X64142)Feces-631 parasites/tubeLiang et al., 2009AmoetaAcanthamoeba spp.18S rRNAParasite-6510 pg/μLLek-Uthai et al., 2009
1 1% 寄生虫血=5×107受感染红细胞/200 μL。1% parasitemia=5×107infected RBC/200 μL.
2 此反应中样本包括血液样本和痰液样本。The samples contains Blood and sputum samples.
1.3.3DNA提取:常用的DNA提取方法有加热法、滤纸法等,也有商业化DNA提取试剂盒。由于血液样本中含有大量球蛋白,抑制Taq DNA多聚酶活性,因此,PCR在提取DNA后必须进行纯化。而Bst DNA多聚酶对血浆中的多聚酶抑制物质敏感度较低,因此,理论上LAMP不需要DNA纯化。Lucchi(2010)等在对比煮沸法与商业试剂盒提取DNA的效果时发现,使用煮沸法时LAMP检验极限为4个虫体/mL,而试剂盒则能达到0.4个虫体/mL。这可能与试剂提取DNA的操作流程标准化以及DNA的纯度较高有关。因此,建立LAMP方法时应根据诊断效能选用合适的DNA提取方法,并建立标准化的操作流程。
1.4 LAMP反应
1.4.1反应体系:目前LAMP法反应体系为25 μL,体系包含FIP和BIP,F3和B3,dNTPs, Tris-HCl(pH 8.8),KCI,MgSO4,(NH4)S04,Tween-20,Betaine和Bst DNA聚合酶(8 U/μL)。当建立一个新的反应体系时需要优化MgSO4和Betaine的浓度(Tomlinson, 2013)。
1.4.2DNA多聚酶: 目前大多数LAMP使用的是Bst多聚酶。近年市场上出现了一些新型的多聚酶,如New England公司的Bst多聚酶的大片段Bst2.0和OptiGene 的Isothermal Master Mix,能缩短LAMP的反应时间(Pooleetal., 2012)。提高DNA多聚酶的效能将成为今后LAMP技术提升的重要因素(Morietal., 2013)。
1.4.3反应温度:LAMP扩增主要是依靠BstDNA多聚酶进行DNA的复制,温度可影响BstDNA的活性。大多数LAMP反应的最适宜温度为60~65℃,部分反应在62~66℃。(Tomlinson, 2013) 在反应结束时应当以80~90℃加热2~5 min以终止扩增反应。当建立一种新的LAMP检测体系时,可设立一定的温度梯度,通过比较其反应时间及检验极限得出其最佳温度。各种寄生虫LAMP检测的最适宜温度见表1。
1.4.4反应时间: 大多数LAMP的反应时间为60 min,也有超过90 min的报道。但超过90 min后不仅无法提高LAMP的敏感性,同时可能导致非特异性扩增,干扰实验结果。当建立一种新的LAMP检测体系时,可在25 μL体系最适温度下设立一定的时间梯度,经琼脂糖凝胶电泳检测,根据DNA条带亮度选择最亮条带对应的反应时间作为最佳反应时间。
1.5 LAMP产物的检测
LAMP在扩增的同时产生副产物焦磷酸镁,使反应体系变浑浊,通过浊度的对比,可直观的了解LAMP的扩增情况。目前常用的LAMP产物检测方法包括凝胶电泳、荧光检测法、实时浊度法等。
1.5.1凝胶电泳法: 凝胶电泳是最常用的产物检测方法之一。亦可先用限制性内切酶将扩增产物剪切,电泳可检测到特异性核酸条带。该法稳定可靠,但费时。
1.5.2UV法: 在反应前加入能使dsDNA染色的荧光剂。可选用SYRB GREEN I、SYTO-9和FD等对BstDNA多聚酶抑制程度较轻的荧光显色剂。自然光下呈绿色,紫外光下发出绿色荧光。该方法简便快捷,可直观的反映LAMP扩增情况。但UV法只能定性判断LAMP是否扩增,适用于现场检测。值得注意的是往反应管中添加染料时容易造成污染而引起假阳性。
1.5.3实时浊度法(real-time turbidimeter method):实时浊度法可以实时检测反应过程中所产生的白色沉淀,从而实现对LAMP反应全程的实时监控。同时,实时浊度法简化了实验步骤,减少了反应体系污染,降低了假阳性的几率,但价格较为昂贵。
2 LAMP在寄生虫病检测中的应用价值
LAMP作为新一代的核酸检测技术,具有高度特异性与敏感性,在呼吸道病毒、HIV、大肠杆菌、结核杆菌等检测中取得了较好的效果(Sankaretal., 2011)。对痰检阳性标本具有较高的敏感性,达到97.7% (173/177)(Neonakisetal., 2011)。
在寄生虫检测方面,LAMP已应用于部分寄生虫的实验室检测及流行病学调查,如疟原虫、利什曼原虫、锥虫、巴贝斯虫、泰勒虫、弓形虫、绦虫、隐孢子虫等。目前,疟原虫、利什曼原虫、人类非洲锥虫等已经进入临床检验研究阶段(2012)。Eiken公司已经推出疟疾的LoopAmpTM试剂盒并利用其进行了场地检测。Heidi Hopkins等(2013)利用LAMP试剂盒检测乌干达272名门诊病人血清样本,结果显示在P.falciparumqPCR 效价≥2 虫体/μL的样本中,LAMP的敏感性为97.8% (95%CI 93.7%~99.5%)。在利什曼原虫检测方面,Verma等(2013)利用杜氏利什曼原虫动基体DNA(Kinetoplast Minicircle DNA)对新德里采集的55份恶性利什曼原虫(VL)静脉血样本、15份恶性利什曼原虫(VL)骨髓样本和62份黑热病皮肤利什曼病(PKDL)的组织学样本做LAMP检测,其敏感性均大于96%,特异性为98.5%。LAMP用于寄生虫检测的详情见表2。
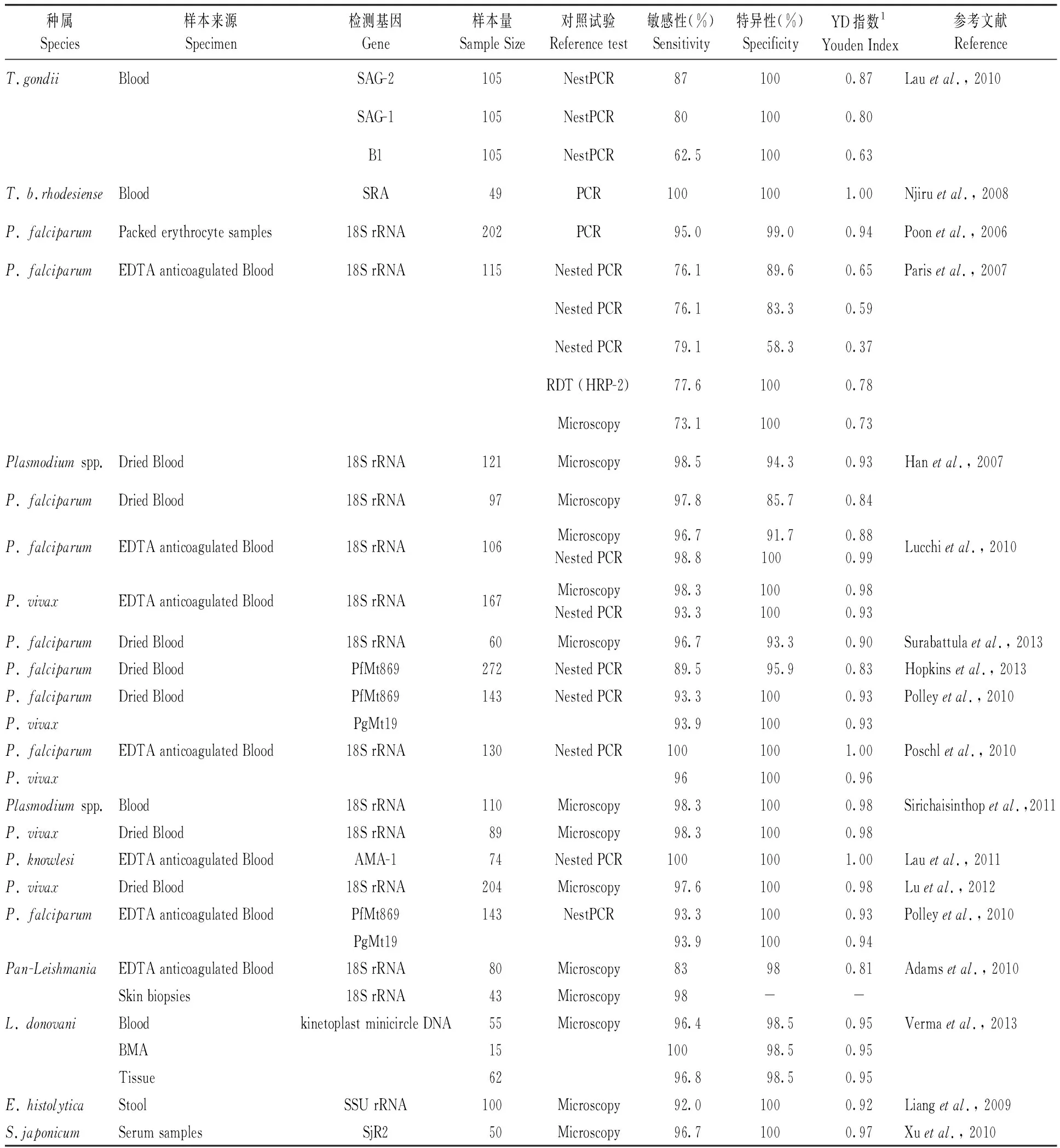
表2 LAMP在寄生虫检测中的应用情况Tab.2 Summary of LAMP sensitivity and specificity in the detection of parasite in some previous studies
1.YD指数=(敏感性+特异性)-1 YD Index=(sensitivity+Specificity)-1。
3 问题与展望
LAMP方便快捷,操作简易,具有高度的敏感性和特异性,在临床诊断和现场检测有一定优势。由于敏感性过高,LAMP在现场检测过程中,很有可能出现假阳性。因此,建立LAMP检测体系时,应充分考虑各方面的影响因素(表3),优化反应条件,以减低非特异性扩增,提高检测的特异性。

表3 LAMP反应因素Tab.3 Summary of the influence factor in LAMP reaction
LAMP从Kuboki等(2003)首次检测人类非洲锥虫病病原体以来,在病原检测方面得到了迅速发展。简化反应流程,减少反应体系,样本传送及μTAS技术的应用已成为未来LAMP的发展趋势,通过减少假阳性的发生率,降低成本,进一步为LAMP成为临床快速检测创造条件(Morietal., 2013)。LAMP与微流体芯片技术的结合使得病原体重点照护检验(Point-of-care test,POCT)成为可能(Morietal., 2009),并已经尝试对大肠杆菌(Safaviehetal., 2012),沙门氏菌(Hsiehetal., 2012)等细菌(Fangetal., 2012)及HIV等病毒(Sunetal., 2013)进行快速检测。
尽管LAMP在多数寄生虫的检测中尚处于研究阶段,随着研究的不断深入和现场试用的范围扩大,LAMP作为新一代核酸检测技术将在寄生虫病的诊断和现场检测中发挥重要作用。
