离子型聚合物Poly(MMA-co-maleic Li)的合成及其对基于PEO凝胶聚合物电解质性能影响研究
2013-11-19邢玉金汤继俊李斌彤李为立
邢玉金, 汤继俊, 李斌彤, 李为立
(江苏科技大学 材料科学与工程学院,江苏 镇江 212003)
聚合物锂离子电池具有较高的比能量,能够满足现代便携式电子产品的需求[1].从实际应用的角度来看,聚合物电解质在锂离子电池中的性能应该满足以下要求[2-4]:①室温下具有较高的离子电导率;②较高的离子迁移数;③化学、热学以及电化学稳定性;④机械强度.PEO是目前研究最广泛的一种聚合物基体,其链段既不是很紧密,也不是很疏松地堆积在一起,其内旋角使得PEO的螺旋链变得相当扭曲,在这种扭曲应力的存在下,链段表现出较强的取向能力使链段能够起到拟溶剂化作用,促进低晶格能的碱金属盐的离解和迁移[5].但这种传统的聚合物电解质一般只能在高于65℃情况下才能达到实际使用的离子导电率.其原因在于,聚合物电解质的离子导电作用主要在无定形区中进行,而未经改性的PEO在室温下具有很高结晶度,这抑制了锂离子在体系中的传导[6-8].为了克服传统PEO基聚合物电解质室温下离子导电率差的问题,文中首先设计合成了一种新型离子型共聚物(Poly(MMA-co-maleic acid lithium)),然后将其与PEO共混,通过溶液浇铸法制备共混凝胶聚合物电解质.通过研究共混后聚合物电解质膜的结构、表面形貌、电化学等性能,进而探讨其在聚合物锂离子电池中应用的可行性.
1 实验
1.1 实验原料与测试仪器
实验主要采用的化学原料为:甲基丙烯酸甲酯(C.P.,上海信然实业)、马来酸酐(C.P.,上海凌峰化学试剂公司)、偶氮二异丁腈(A.R.,上海四赫维化工有限公司)、氢氧化锂(C.P., 上海恒信化学试剂公司)、四氢呋喃(A.R.,江苏强盛化工有限公司)、无水甲醇(A.R.,杭州化学试剂有限公司)、液体电解质LB301 (EC/DMC 1:1(W/W) LiPF61 mol/l, 张家港国泰华荣有限公司).
测试仪器主要如下:红外光谱仪器(FT-5200),扫描电镜(JSM-6480),热失重分析仪(Pyris Diamond),X-射线衍射仪(Rigaku D/max-2550),场发射扫描电镜(SIRion FESEM),电化学综合分析测试系统(EG-GPARC M283).
1.2 甲基丙烯酸甲酯-共聚-马来酸锂共聚物的合成
甲基丙烯酸甲酯与马来酸酐按20∶1(摩尔比)在反应瓶中混合,加入质量分数为0.5%的引发剂偶氮二异丁腈(AIBN),在80℃氮气氛围下反应12 h.合成结束以后,聚合物先在丙酮溶液中溶解,然后在甲醇中沉淀,步骤重复两次.将沉淀的共聚物在70℃下真空干燥8 h后,再溶解于四氢呋喃/甲醇(90/10, V/V)的混合溶液中,加入计算量的氢氧化锂的甲醇溶液,升温至60℃反应4 h,直至反应完全.中和的聚合物溶液置于通风橱中挥发溶剂,然后再在70℃下的抽真空干燥24 h,得到离子型聚合物甲基丙烯酸甲酯共聚马来酸锂(Poly(MMA-co-maleic acid lithium)).
1.3 共混凝胶聚合物电解质的制备
在氮气保护下,将Poly(MMA-co-maleic acid lithium)与PEO按照一定比例溶解在THF中,50℃下搅拌8 h,然后加入相对共混聚合物质量为200%的液体电解质LB301到上述溶液中进一步搅拌3 h.在四氟板上浇铸胶态聚合物溶液,待溶剂缓慢蒸发后可得共混凝胶聚合物电解质,将所制样品在80℃下真空干燥24 h,储存在手套箱中.
2 结果与分析
2.1 红外光谱
共聚物Poly(MMA-co-maleic acid lithium)的红外图谱如图1a).2 951 cm-1为C-H吸收振动峰,1 850 cm-1,1 782 cm-1分别对应五元环的酸酐键的对称与不对称伸缩振动峰,1 730 cm-1对应甲基丙烯酸甲酯上羰基的伸缩振动峰,1 240 cm-1,1 149 cm-1对应C-O-C的伸缩振动峰.在1 660~1 580 cm-1处消失的C=C伸缩振动峰表明共聚物中未有单体残留.图1b)为未中和的共聚物与离子型聚合物在1 900 cm-1~1 600 cm-1范围内放大的红外特征图谱.图1b)曲线中1 850 cm-1和 1 782 cm-1处吸收峰对应于未中和的聚合物的酸酐环的羰基的伸缩振动峰.离子型聚合物中,1 850 cm-1,1 782 cm-1分别对应五元环的酸酐键的对称与不对称伸缩振动峰的消失,表明氢氧化锂与马来酸酐发生酸碱中和反应,得到Poly(MMA-co-maleic acid lithium)的共聚物,聚合物链段上带有可离解的锂离子.
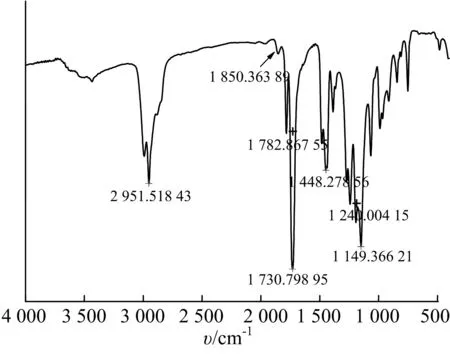
a) 离子型聚合物
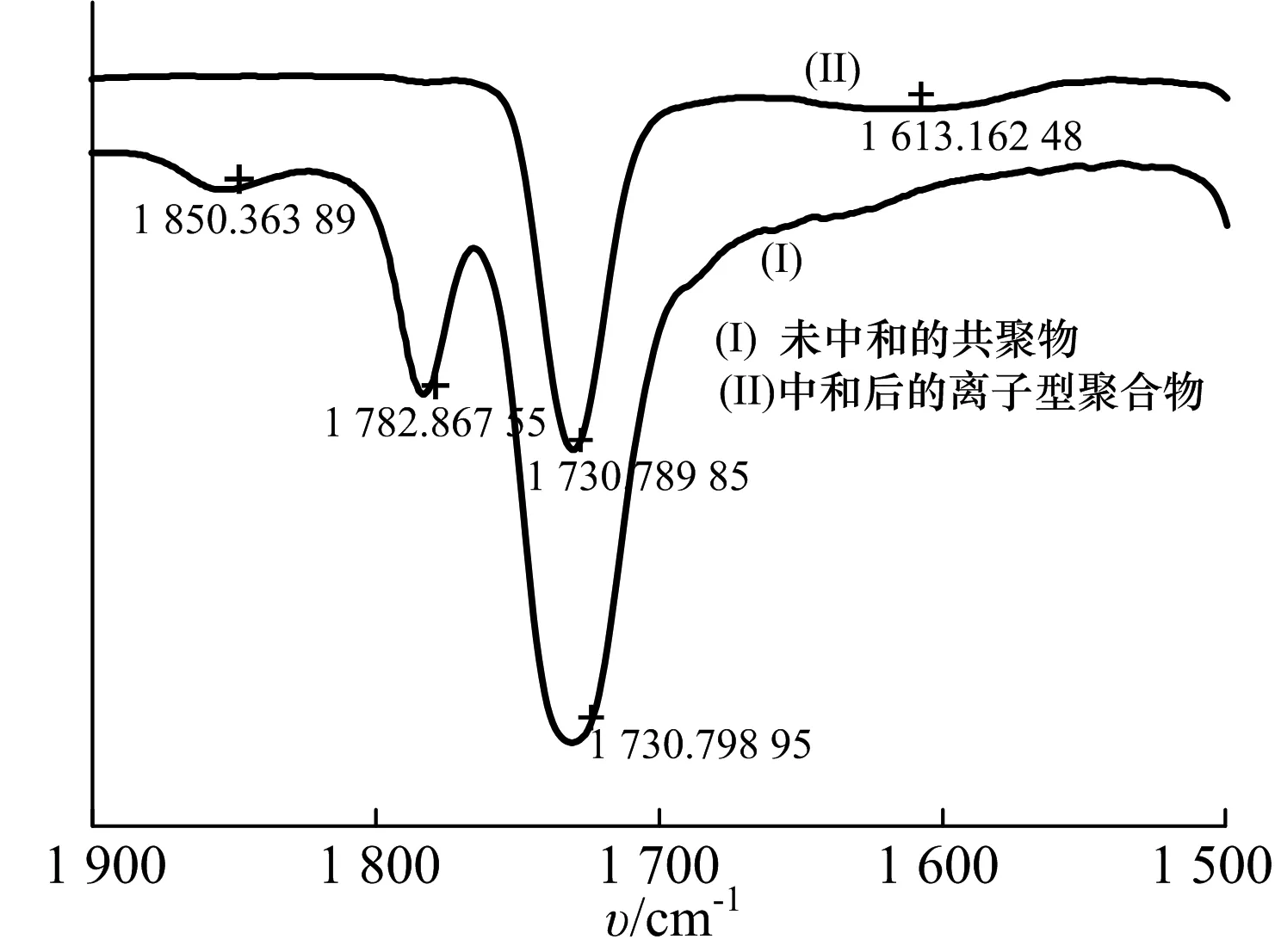
b) 未中和共聚物对比中和后离子型聚合物放大图
图1红外光谱分析图
Fig.1FTIRspectrum
2.2 DSC测试
为了研究离子型共聚物以及液体电解质中的增塑剂EC,DMC对PEO链段结晶度的影响.按照质量比4∶1,将离子型共聚物与PEO共混,分别制备了混合聚合物薄膜以及凝胶共混聚合物电解质,用差示扫描量热法进行测试,其热力学性能如表1.
表1共混聚合物及其所制备的凝胶聚合物电解质的性能
Table1Thermodynamicspropertiesfortheblendingpolymerandthepreparedgelpolymerelectrolyte

试样Tg/℃Tm/℃ΔHmPEO/(J·g-1)χc/% Polymer blends(Poly(MMA-co-maleic acid lithium)∶PEO=4∶1)87.88963.4372.4841.32 Gel polymer electrolyte (Poly (MMA-co-Limaleic acid)∶PEO∶LB301=4∶1∶10)94.096
熔融峰强度的变化情况对应于共混聚合物中PEO的链段的规整排列.首先观察离子型聚合物共混与液体增塑剂对PEO链段结晶度的影响:两聚合物共混后,PEO的熔融温度为63.437 ℃,其PEO的熔融温度未有影响,但PEO链的规整排列遭到破坏,其熔融焓从188 J/g[9]大幅减小到2.484 J/g.当掺入液体电解质后,熔融峰消失,这是由于EC,DMC等液体增塑剂对链段的相互作用,PEO链段的规整排列完全受到了抑制,凝胶聚合物电解质完全呈现无定形态.由于聚合物电解质中的离子迁移率与聚合物链段的迁移率密切相关,电导率和离子迁移受到聚合物电解质中无定形相的限制,因此,体系的无定形相的增加可以提高锂离子的传导.
玻璃化温度与离子型聚合物的链段运动有关系,观察液体电解质加入后,离子聚合物玻璃化温度的影响,离子交联聚合物无定形区域的Tg由87.889℃上升到94.096℃.这可能是由于链段上以及液体电解质中的锂离子与聚合物链段以及液体电解质中的EC/DMC中富电子基团(-O-,-NH,>C=O,-O-,-CN,etc)相互作用,形成瞬态的锂盐-聚合物交联结构,使得链段的玻璃化温度提高[10-11].
2.3 XRD测试
图2分别为Poly(MMA-co-maleic acid lithium):PEO=4:1共混聚合物膜和以及基于此比例的凝胶聚合物电解质的X射线衍射谱图.其结果可以考虑用Hodge[12]等标准来解释,其建立了峰的高度与结晶性之间的相关性.图2a)中,虽然Poly(MMA-co-maleic acid lithium)的共混使得PEO的规整排列受到了限制,但未完全破坏其聚合物链段的结晶,X射线衍射谱图中依然看到有结晶峰存在.从图2b)中可以看到,加入液体电解质起增塑效果后,链段规整排列被完全打乱,已经观察不到对应PEO的结晶衍射峰.这个结果与DSC测试结果一致.另外,在图2b)中,未发现对应于纯锂盐的结晶衍射峰,这表明锂盐与PEO链段络合,分散溶解于聚合物基体当中.XRD与DSC测试结果能够表明,离子型聚合物的共混以及液体电解质的增塑作用PEO的链段排列被完全打乱,有效抑制了聚合物的结晶度,从而有利于整个体系中离子的迁移,提高离子电导率.
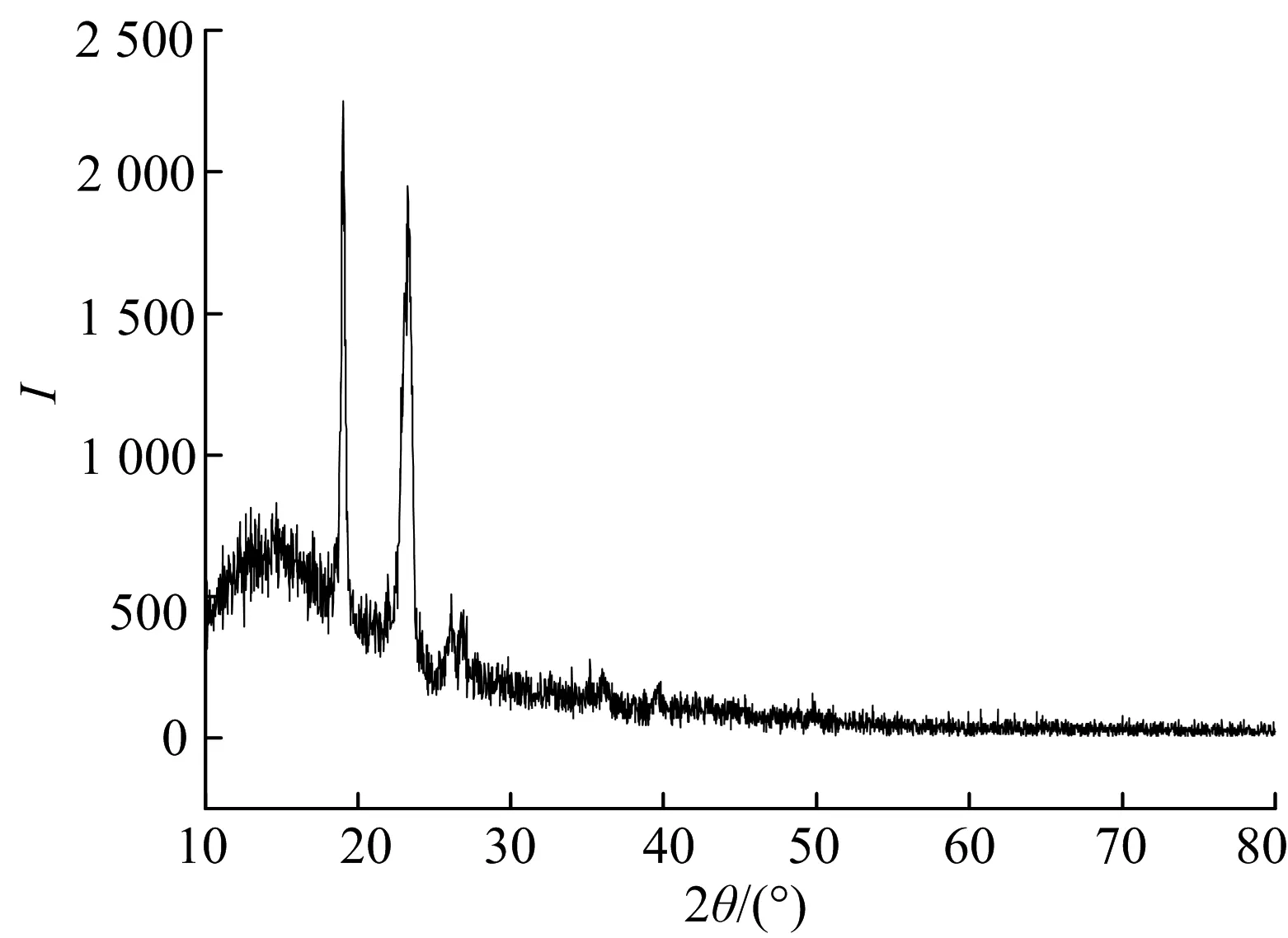
a) poly(MMA-co-maleic acid lithium)-PEO(4∶1)
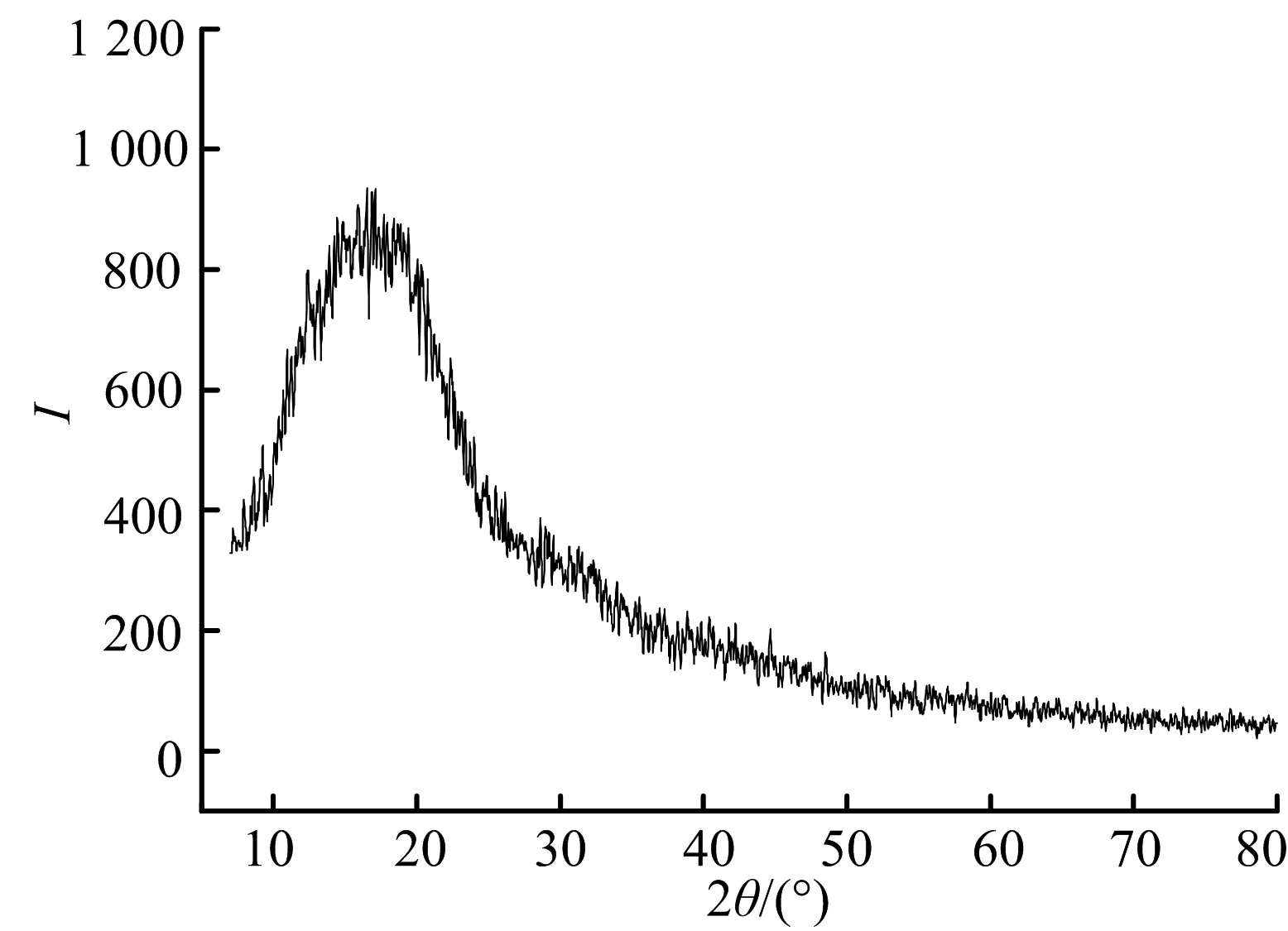
b) Gel polymer electrolyte poly(MMA-co-maleic acid lithium)∶PEO∶LB301=4∶1∶10
2.4 扫描电镜测试
为观察Poly(MMA-co-maleic acid lithium) 共混PEO的效果,以两者之间比例为4∶1的共混聚合物膜为例,通过场发射扫描电镜观察其表面形貌.从表面形貌可以观察到,薄膜呈现均匀平+整状态,未有明显的由于相间相容性问题而导致的相分离或褶皱.这有利于整个体系的性能均一稳定.

图3 共混聚合物膜扫描电镜图Fig.3 SEM of polymer blending (Poly(MMA-co-maleic acid lithium):PEO=4∶1)
2.5 离子电导率测试
以共混凝胶聚合物电解质(Poly(maleic acid lithium)∶PEO∶LB301=4∶1∶10)为例,图4为交流阻抗谱随温度的变化情况.其高频区无半圆的阻抗图谱的结果表明,由于液体电解质被共混聚合物膜充分吸附,只需要考虑聚合物电解质本征电阻分量,两电极之间凝胶相态中构建一个有效的离子传导途径.

图4 复合聚合物电解质膜的交流阻抗谱Fig. 4 AC impedance spectra of composite electrolyte membrane(Poly(MMA-co-maleic acid lithium)∶PEO∶LB301=4∶1∶10)
图5为不同质量比例共混聚合物电解质在不同温度下的离子导电率,其离子电导率与温度基本呈线性关系,这也证实了两者之间遵循阿累尼乌斯方程σ=Aexp(-E/kBT),即随着温度的升高,电解质本体电阻降低,离子导电率升高.众所周知,温度升高会导致材料体积膨胀,产生更多的自由空间,促进聚合物链段和锂离子的迁移;聚合物链段在运动与转移中发生解络活化效应解离出部分电荷载体,从而提高离子电导率;通常这种现象可以在液体电解质和凝胶聚合物电解质中观察到[13-14]. 此外,随着离子聚合物在体系中比例的增加,体系的离子导电率增加,这是由于离子聚合物中含有一定量的可离解的锂离子,整个体系可以参与离子导电,有利于促进离子导电率的增加.当离子共聚物与PEO质量比为4∶1时,体系室温离子导电率达到 5.85×10-3S·cm-1,根据阿累尼乌斯方程计算得到,活化能值为2.365 kJ·mol-1.
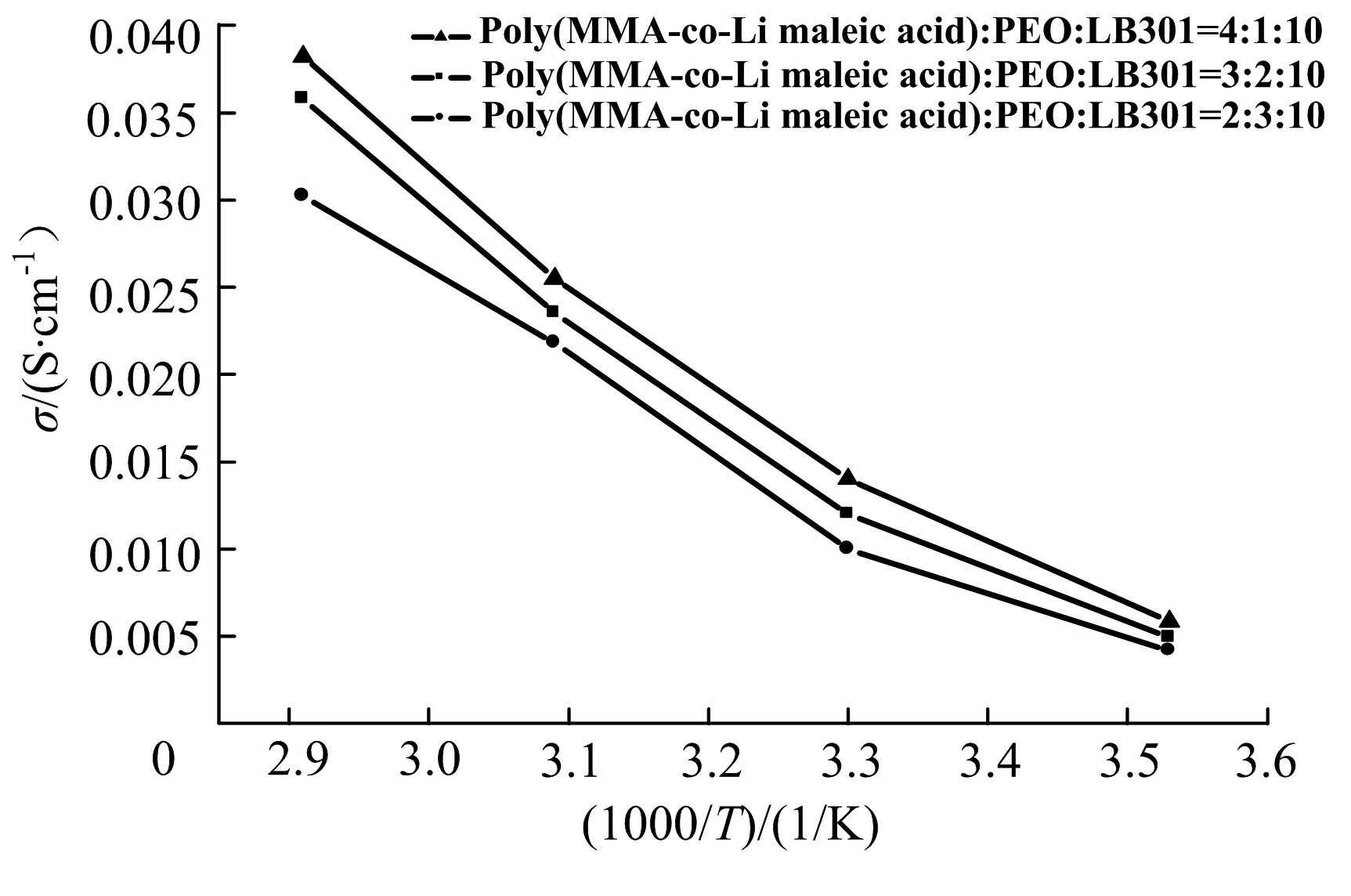
图5 不同比例共混聚合物电解质的离子导电率对应于测试温度的变化曲线Fig.5 Dependence of conductivity on the reciprocal of temperature for different proportion of blend polymer
2.6 电化学稳定窗口测试
以不锈钢片为正极、金属锂片为负极,将共混凝胶聚合物电解质(Poly(MMA-co-maleic acid lithium)∶PEO∶LB301=4∶1∶10)夹于中间,组装成SS/GPE/Li 体系,通过线性扫描伏安法测试电解质的电化学稳定性.电池的电极电压以0.05 V/s的速率从3.0 V扫到7.0 V(Vs Li).从图6中可以观察,在3.0~4.5 V之间未有电化学反应发生.在4.5 V突然出现电流变大的现象,这与电解质的分解有关.该共混凝胶聚合物电解质的电化学稳定窗口为4.5 V.从这一结果中,此类凝胶聚合物电解质被认为可适用于采用高电压正极材料,如LiCoO2、LiNiO2以及LiMn2O4等.此外,在分解电压前,未发现有突起峰,说明整个体系较为纯净且混合均匀.若含有不纯物,比如残留水或者其他有机溶剂,则会在线性扫描伏安曲线上有所体现.
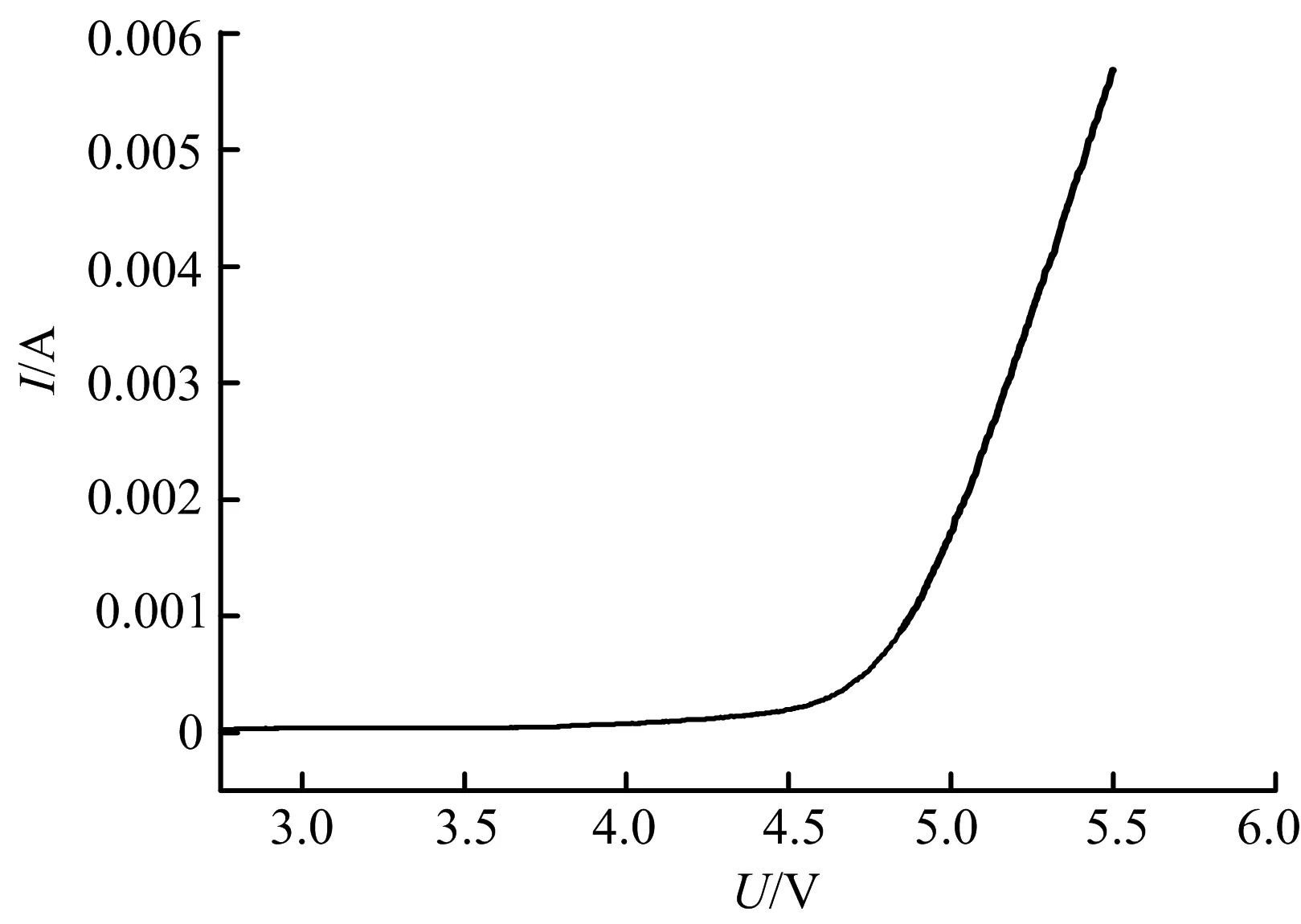
图6 微孔凝胶聚合物电解质的线性扫描伏安曲线Fig.6 Electrochemical stability window of microporous gel polymer electrolyte
3 结论
文中通过控制不同量的Poly(MMA-co-maleic acid lithium)、PEO和液体电解质的混合,制备的共混凝胶聚合物电解质.从XRD和DSC的分析可知,由于离子型聚合物链段与PEO链段的共混以及液体电解质的增塑作用,可有效地抑制PEO的结晶,促进锂离子在凝胶聚合物体系中运动.离子电导率与温度的关系可用阿累尼乌斯方程式解释,凝胶聚合物电解质(Poly(MMA-co-maleic acid lithium)∶PEO∶LB301=4∶1∶10)在303 K时的离子电导率可达5.85×10-3S·cm-1,其电化学稳定窗口达到4.5 V.本实验所制的共混凝胶聚合物电解质其电化学性能表明其在实际应用中具有一定的应用前景.
参考文献(Reference)
[1] Khan S A,Baker G L,Colson S. Second international meeting on solid electrolytes[J].ChemistyofMaterials,1994, 6(3):2359-2360.
[2] Gray F M.Solid polymer electrolytes-fundamentals and technological applications[M]. New York:Intersicience,1999, 3:88-89.
[3] Alamigir M,Abraham K M,Pistoia G.Lithium batteries′ developments and perspectives[J].NewMaterials,1994, 87(2):93-94.
[4] Koksbang R,Olsen I I,Shackle D. The study of Sony Li-ion polymer battery[J].SolidStateIonics,1994, 69(4):320-323.
[5] Acosta J L, Morales E. Recent developments and likely advances in lithium rechargeable batteries[J].JournalofAppliedPolymerSciences,1996, 60(5):1185-1187.
[6] Armand M B.Polymer electrolyte reviews[J].ElsevierScience,1989,3(5):1-2.
[7] Berthier C, Gorecki W, Minier M, el at. Studies on comb-like polymer electrolyte with a nitrile group[J].SolidStateIonics,1983,11(2):91-93.
[8] Fauteus D, Purd’homme J, Harver P E. Review of gel-type polymer electrolytes for lithium-ion batteries[J].SolidStateIonics,1988, 23(5):92-926.
[9] Bertier C,Gorecki W,Minier M,et al. Mixed organic electrolytes for high energy density batteries[J].SolidStateIonics,1983, 11:91-95.
[10] Hou Wuhuan,Chen Chunyuang. The world-wide battery market and its main applications[J].ElectrochimicaActa,2004, 49:2105-2107.
[11] Digar Mohanlal,Hung Shiue-liang,Wen Ten-chin. A lithium ion polymer battery[J].JournalofAppliedPolymerScience,2001, 80:1319.
[12] Hodge R M, Edward G H, Simon G P. The feasibility study of composite electrolytes comprising thermoplastic polyurethane and poly(ethylene oxide)[J].Polymer,1996, 37:1371.
[13] Matsumoto M,Ichino T,Rutt J S,el at. Effects of inert fillers on the mechanical and electrochemical properties of lithium salt-poly(ethylene oxide) polymer electrolytes[J].ElectroduristyofSociety, 1990, 141(31):989-991.
[14] Hou Wuhuan,Chen Chuhyung . Poly(ethylene oxide)-based nanocomposite electrolytes as improved separators for rechargeable lithium polymer batteries[J].ElectrochimicaActa,2004, 49: 2103-2105.
