昆虫激素体外调节家蚕滞育激素受体基因的表达
2013-11-19王力刚唐顺明沈兴家
王力刚, 朱 娟, 王 猛, 唐顺明, 2, 沈兴家, 2
(1.江苏科技大学, 江苏 镇江 212018)(2.中国农业科学院蚕业研究所 农业部蚕桑遗传改良重点实验室,江苏 镇江 212018)
家蚕是一种重要的经济昆虫和模式生物,家蚕滞育机理研究一直受到学界的关注并取得了重要进展[1-3].根据自然条件下1年内发生的世代数可将家蚕分为一化性(univoltinism)、二化性(bivoltinism)和多化性品种(polyvoltinism).不同化性的家蚕发生滞育的情况也不同,家蚕二化性品种的滞育性由遗传性决定并受上代环境影响[4-6].滞育激素(DH)在决定家蚕胚胎滞育中有着重要作用[4- 5, 7],胚胎期25 ℃光照处理,至蛹期咽下神经节(SG)合成和分泌滞育激素DH,成虫交配后产滞育卵;相反,胚胎期15 ℃暗催青处理,SG合成和分泌的DH少,成虫交配后产非滞育卵[8].研究表明:家蚕滞育激素受体基因Bmdhr主要在蛹中期卵巢中表达[7],DH必须与滞育激素受体(BmDHR)结合,通过调控下游基因的表达变化才能启动滞育[6, 9].但是,目前人们对Bmdhr表达的调控机制尚不清楚.
为了深入研究家蚕滞育的分子机理,本实验根据家蚕基因组数据库公布的Bmdhr上游序列(Bm-scaf 84 | BABH01033472.1)设计PCR引物,以家蚕二化性品种“秋丰”基因组DNA为模板,克隆了1 395 bp(-1 364 ~+31 nt)和972 bp(-941 ~+31 nt)2个不同长度的Bmdhr启动子序列,构建Bmdhr启动子驱动的荧光素酶基因报告载体,利用家蚕细胞瞬时表达分析系统分析其转录活性和外源昆虫保幼激素类似物(JHA)、蜕皮激素(20-OH-ecdysone)和滞育激素(DH)对其活性的影响.
1 实验
1.1 实验试剂
家蚕二化性品种“秋丰”、宿主菌E.coliTop10、质粒载体pMD18T和pGL3.0 basic 载体(含有荧光素酶基因luc)、BmN细胞株由农业部蚕桑遗传改良重点实验室保存.蜕皮激素20-OH-ecdysone由中国农业科学院蚕业研究所附属蚕药厂生产并提供;保幼激素类似物(JHA)ZR-515购自Sigma公司;滞育激素(MW:2731.01)由上海强耀生物科技有限公司合成.各种限制性内切酶、Taq酶、T4 DNA连接酶、Proteinase K等主要试剂购自TaKaRa(大连)有限公司.TC-100昆虫细胞培养基、胎牛血清(FBS)、lipofectin试剂购自Invitrogen公司.荧光素酶检测试剂盒(E4030)购自Promega公司.核苷酸引物的合成、测序委托上海生工生物有限工程公司完成.
1.2 家蚕基因组DNA的提取
取家蚕品种秋丰5龄第3日幼虫后部丝腺,参照文献[10]的方法提取家蚕基因组DNA,经浓度和纯度检测后,-20℃保存备用.
1.3 启动子序列扩增
根据家蚕基因组数据库公布的Bmdhr序列(Bm-scaf 84 | BABH01033472.1),使用Oligo 6软件分别在-1 400 bp和-1 000 bp左右设计上游引物,在+10 bp处设计下游引物,并分别导入KpnⅠ和BglⅡ酶切位点(下划线部分):F1 5′-GGTACCCGTCGGACTTGTCGGATCT-3′,F2 5′-GGTACCGTGTTGAAGTG CATGGACGA-3′,R 5′-AGATCTGACCAGCCCTCTCGACTACATT-3′.
以家蚕基因组DNA为模板,进行PCR扩增,扩增条件为94℃预变性5 min,94℃、45 s,60℃、1 min,72℃、2 min,25个循环后72℃延伸10 min.PCR产物经凝胶电泳鉴定和分离,用DNA回收试剂盒纯化后克隆到pMD18-T载体中,进行测序验证.
1.4 载体构建
将测序正确的质粒使用KpnⅠ-BglⅡ内切酶双酶切后电泳,分离纯化获得不同长度的Bmdhr基因启动子片段,在T4 DNA连接酶作用下克隆到经同样酶消化的pGL3.0 Basic载体中,转化E.coliTop10,筛选出重组质粒pGL-Bmdhr1364-luc、pGL-Bmdhr941-luc,并进行酶切鉴定.
1.5 细胞培养、转染与瞬时表达
家蚕细胞系BmN参照文献[11]的方法进行细胞培养传代.细胞用24孔板培养24 h,转染前去除培养基并用无血清培养基洗涤2次,将100 μL含有5 μL脂质体和1 μg报告质粒的转染液与1 mL无血清TC-100培养基混匀,温育细胞4~5 h,除去旧培养基,加入300 μL含有10% FBS的TC-100培养基,激素处理组更换培养基时加入不同浓度ZR515、β-蜕皮激素和DH,对照组加等体积ddH2O,以pGL3.0 basic转染的细胞为空白对照,每组实验重复3次.
1.6 荧光素酶分析
细胞转染72 h后,4℃ 5 000 r/min离心5 min收集细胞,去上清液,按照E4030试剂盒(promega)的说明裂解细胞.加100 μL荧光素酶底物于测定管中,然后加入20 μL的细胞裂解液并混匀,在LuminoMeter 20/20荧光光度计上测定荧光素酶(LUC)活性(2 s延迟,10 s读数),以相对荧光强度单位(relative luminescence unit,RLU)表示[12].平行测定细胞总蛋白浓度,以校正报告质粒的荧光素酶活性值[13].使用SPSS软件进行差异性分析.
2 结果与分析
2.1 不同长度Bmdhr启动子活性比较
经M13引物双向测序后,分别得到长度为1 395 bp和972 bp的片段.2个启动子片段分别包含1 364 bp和941 bp的5’上游序列,以及31 bp的第1外显子部分序列.比对结果表明:克隆的片段与公布的Bm-scaf 84 | BABH01033472.1序列一致,说明已成功克隆到Bmdhr启动子片段.
将构建好的报告质粒pGL-Bmdhr1364-luc、pGL-Bmdhr941-luc和pGL3.0 basic质粒分别转染BmN细胞,转染4~5 h后使用完全培养基替换旧培养基.72 h后收集细胞,检测LUC活性,并经空载体和总蛋白量矫正,结果见表1.从表中可看出,Bmdhr-941启动子活性明显高于Bmdhr-1364启动子,前者是后者的2.1倍,这表明Bmdhr基因转录起始位点上游-941~-1 364 nt区域可能存在负调控元件.

表1 不同长度的Bmdhr启动子活性Table 1 Activities of different length Bmdhr promoter
2.2 JHA对Bmdhr启动子活性的影响
将构建好的报告质粒pGL-Bmdhr-1364和pGL3.0 basic质粒分别转染BmN细胞,转染4~5 h后使用保幼激素类似物(ZR515)浓度为0,1,2,4,6和8 μg/mL的完全培养基替换旧培养基.72 h后检测LUC活性,并经空载体和总蛋白量矫正,结果见图1.当保幼激素类似物浓度为2,4,6 μg/mL时,启动子的活性极显著增强(F=2.382,P=0.003<0.01),分别是浓度为0时的2.0,2.1和1.5倍;而当保幼激素类似物浓度为1 μg/mL时,启动子活性显著减弱(F=0.867,P=0.021<0.05),浓度为8 μg/mL时,启动子的活性则极显著减弱(F=0.019,P=0.001<0.01).
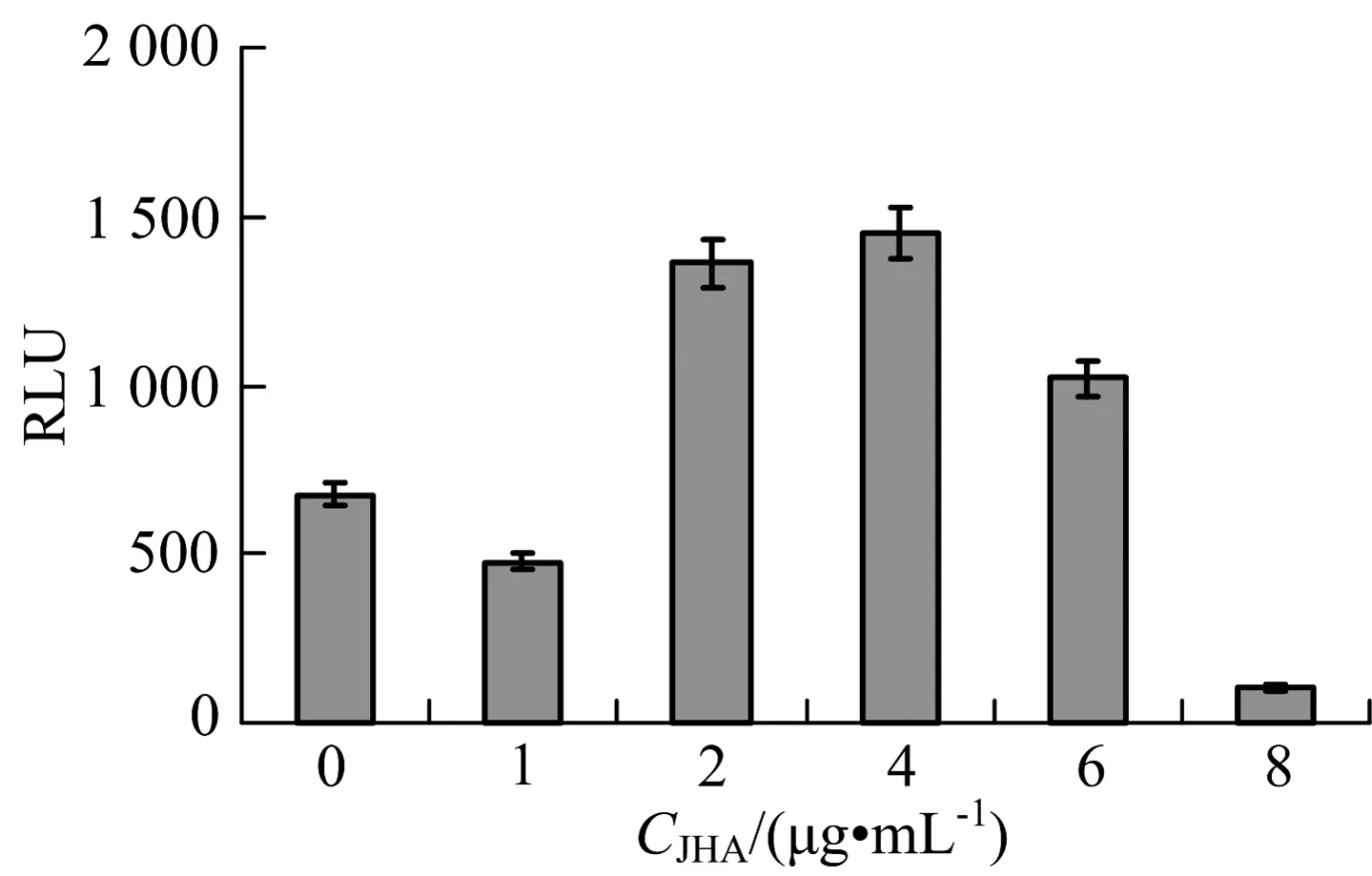
图1 保幼激素类似物对Bmdhr启动子的活性影响Fig.1 Effects of JHA on Bmdhr promoter activities
2.3 20-OH-ecdysone对Bmdhr启动子活性的影响
将构建好的报告质粒pGL-Bmdhr-1364和pGL3.0 basic质粒分别转染BmN细胞,转染4~5 h后使用β-蜕皮激素浓度为0,1,2,4,6,8和10 μg/mL的完全培养基替换旧培养基.72 h后检测LUC活性,并经空载体和总蛋白量矫正,结果见图2.当β-蜕皮激素浓度为0时,Bmdhr基因启动子的活性为677±24.33;当β-蜕皮激素浓度为1,2,6,8,10 μg/mL时,启动子的活性增加极显著(F=85.831,P=0.001<0.01),分别是浓度为0时的1.8,2.8,1.2,2.2,2.4倍;而浓度为4 μg/mL的条件下,启动子活性明显减弱(F=28.012,P=0.013<0.05),仅是浓度为0 μg/mL时的80%.
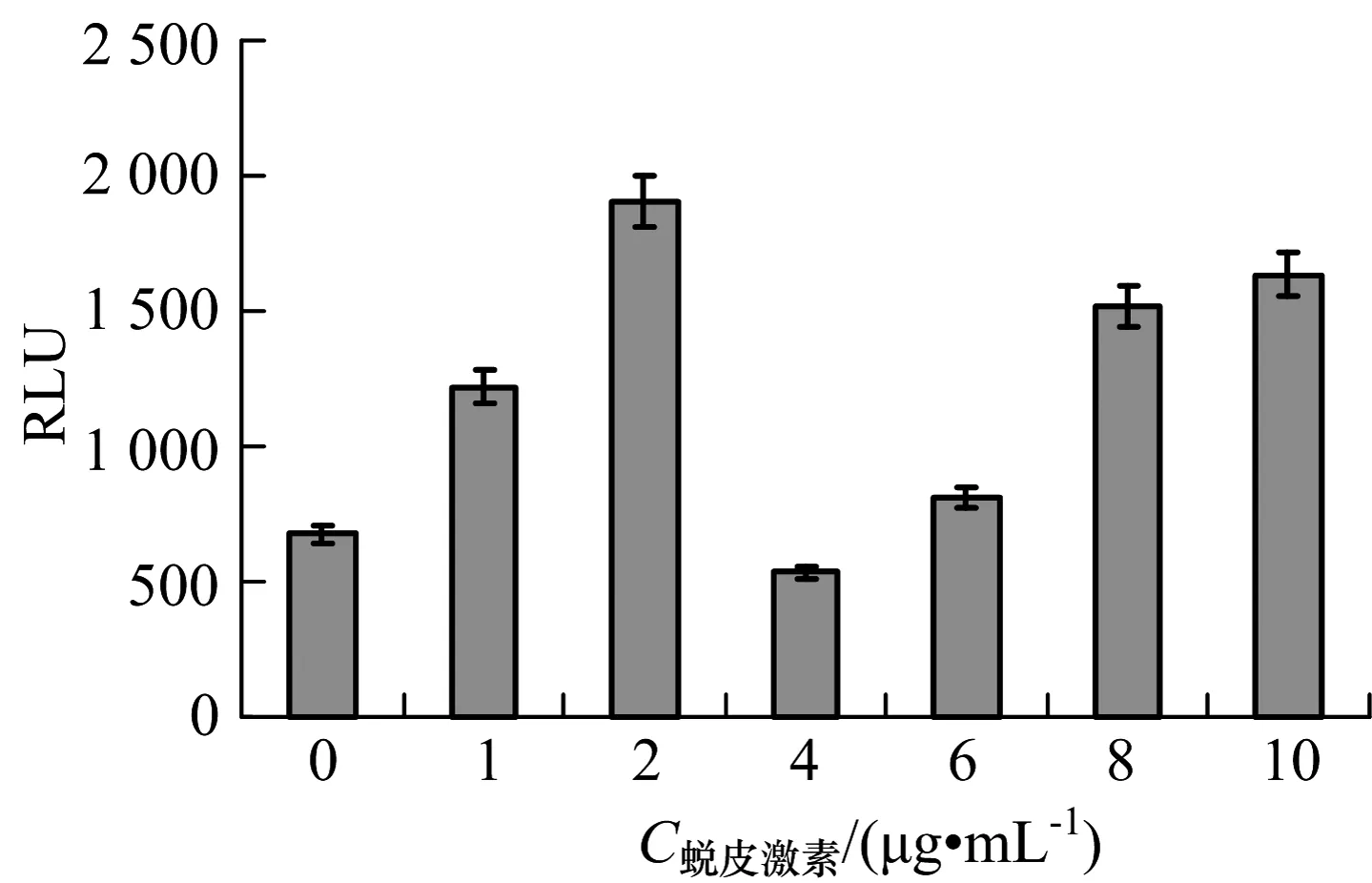
图2 20-OH-ecdysone对Bmdhr启动子的活性影响Fig.2 Effects of 20-OH-ecdysone on Bmdhr promoter activities
2.4 滞育激素对Bmdhr启动子活性的影响
将构建好的报告质粒pGL-Bmdhr-1364和pGL3.0 basic质粒分别转染BmN细胞,转染4~5 h后用滞育激素浓度为0做对照,10,20,40,60,80和100 nM的完全培养基替换旧培养基.72 h后收集细胞,检测LUC活性,并经空载体和总蛋白量矫正,结果见图3,当滞育激素浓度为10,20,40 nM时,启动子的活性显著增强(F=9.442,P=0.037<0.05),分别是浓度为0的1.7,2.3和1.5倍;而当滞育激素浓度为60,80和100 nM时,启动子活性变化不显著(F=0.491,P=0.522>0.05).
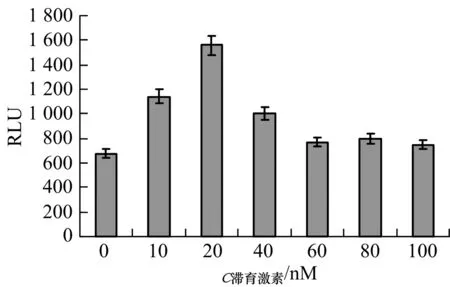
图3 滞育激素对Bmdhr启动子的活性影响Fig.3 Effects of DH on Bmdhr promoter activities
3 讨论
家蚕滞育激素受体基因的表达具有时空特异性,它与家蚕滞育密切相关[6].本实验克隆了2个不同长度的Bmdhr启动子片段,经对体外细胞瞬时表达分析,Bmdhr基因转录起始位点上游-1 364~-941 nt区间存在负调控元件.在线软件(http://alggen.lsi.upc.es/recerca/menu-recerca.html)和DNAstar软件分析显示,1 364 bp的Bmdhr启动子片段包含启动子基本元件如TATA box、GATA box,还有多个上游调控元件,如EcREs (PuG(G/T)TCA)、En(engrailed)元件、Zeste元件、AntP元件和DPE元件,其中-1 364~-941 nt之间存在2个EcRE元件、1个En元件和1个AntP元件.En元件对果蝇某些基因在转录水平有抑制作用[14],由此可推测En元件对Bmdhr基因的表达也有抑制作用,但这还需进一步实验证实.
在家蚕发育过程中,蜕皮激素单独作用能引起幼虫到蛹的变态[15].蛹期初期,在家蚕正常雌蛹血淋巴中蜕皮激素的浓度急骤增加[16],并且Bmdhr在此时的转录水平急速上升[6, 17],这说明蜕皮激素可能会增强Bmdhr启动子的活性.但是,当20-OH-ecdysone为4 μg/mL时,Bmdhr启动子的活性不但没有增强反而呈下降趋势,其原因则有待进一步地深入研究.
DH对Bmdhr启动子活性的影响同样具有剂量效应,其浓度在10~40 nM时,可显著增强启动子活性;当浓度达到60 nM时,启动子活性变化不显著.这种剂量效应与滞育激素对海藻糖酶基因启动子调控作用[18]是吻合的.
本研究结果为探索Bmdhr基因的表达调控和阐明家蚕滞育的分子机理积累了实验数据.但是,家蚕体内Bmdhr基因的真实表达调控情况,还需要在个体水平加以深入研究才能揭示.
[1] 黄君霆. 家蚕滞育分子机制的研究[J]. 蚕业科学,2003,29(1):1-6.
Huang Junting. Studies on the molecular mechanism of diapause in the silkworm,Bombyxmori[J].ActaSericologicaSinica,2003, 29(1): 1-6.(in Chinese)
[2] 徐卫华. 昆虫滞育研究进展[J]. 昆虫知识, 2008, 45(4):512-517.
Xu Weihua. Advances in insect diapause [J].ChineseBulletinofEntomology,2008, 45(4): 512-517.(in Chinese)
[3] 顾燕燕, 华荣胜, 周耐明,等. 家蚕滞育激素受体基因 (Bmdhr) 的分子克隆及定量分析[J]. 蚕业科学, 2008, 34(3):417-423.
Gu Yanyan, Hua Rongsheng, Zhou Naiming, et al. Cloning and quantitative analysis of diapause hormone receptor gene in the silkworm, Bombyx mori[J].ActaSericologicaSinica,2008, 34(3): 417-423.(in Chinese)
[4] Fukuda S. Function of the pupal brain and suboesophageal ganglion in the production of non-diapause and diapause eggs in the silkworm [J].AnnotationesZoologicaeJaponenses,1952, 25(1): 149-155.(in Japanese)
[5] Hasegawa K. The diapause hormone of the silkworm, Bombyx mori[J].Nature,1957, 179(4375):1300-1301.
[6] Homma T, Watanabe K, Tsurumaru S, et al. G protein-coupled receptor for diapause hormone, an inducer of Bombyx embryonic diapause[J].BiochemicalandBiophysicalResearchCommunications,2006, 344(1): 386-393.
[7] Kitagawa N, Shiomi K, Imai K, et al. Establishment of a sandwich ELISA system to detect diapause hormone, and developmental profile of hormone levels in egg and subesophageal ganglion of the silkworm, Bombyx mori[J].ZoologicalScience,2005, 22(2): 213-221.
[8] Fukuda S. The production of the diapause eggs by transplanting the suboesophageal ganglion in the silkworm[J].ProceedingsoftheJapanAcademy, 1951, 27: 672-677.
[9] Yamashita O, Hasegawa K and Seki M. Effect of the diapause hormone on trehalase activity in pupal ovaries of the silkworm, Bombyx mori L[J].GenCompEndocrinol,1972, 18(3): 515-23.
[10] Blin N,Stafford D W. A general method for isolation of high molecular weight DNA from eukaryotes[J].NucleicAcidsResearch, 976, 3: 2303-2308.
[11] Summers M D,Smith G E. A manual of methods for baculovirus vectors and insect cell culture procedures [M].USA:Bulletin B-Texas Agricultural Experiment Station,1987,1555:10-18, 38-46.
[12] Zhao Qiaoling,Shen Xingjia,Zhu Liangjun, et al. Characterization of CIb1 gene promoter from silkworm,Bombyxmori[J].ZeitschriftfurNaturforschung, 2007, 62c:875-880.
[13] Zhou Y J, Xiao Q L, Zhang Z F, et al. Foreign insect hormones stimulating the transcription of the ie-1 promoter of Bombyx mori nuclear polyhedrosis virus in vivo and in vitro[J].Bioscience,biotechnology,andbiochemistry,2002, 66: 1488-1494.
[14] Smith S T,Jaynes J B. A conserved region of engrailed, shared among all en-, gsc-, Nκ1-, Nκ2-and msh-class homeoproteins, mediates active transcriptional repression invivo[J].Development, 1996, 122: 3141-3150.
[15] 吕鸿声. 中国养蚕学[M].上海:上海科技出版社, 1991: 518-522.
[16] 张剑韵, 黄龙全. 桑蚕蛹期以昆虫激素类物质 MH, JHA, CA3 处理后卵巢增重曲线比较[J]. 蚕桑通报,1994,25(1):26-28.
Zhang Jianyun, Huang Longquan. Comparison of weight increasing curves ofBombyxmoripupa ovary after treatment of insect hormone moulting hormone, juvenile hormone analog and Imidazole compounds CA3[J].BulletinofSericulture,1994, 25(1): 26-28 (in Chinese)
[17] 王力刚,宋海韬,黄勇,等. 催青温度对家蚕二化性品种滞育激素受体基因表达的影响及基因的结构特征[J]. 蚕业科学,2011,37(2):215-223.
Wang Ligang,Song Haitao,Huang Yong,et al.Influence of incubation temperature on expression of diapause hormone receptor genes in bivoltineBombyxmorivariety and structural features of the gene [J].ActaSericologicaSinica,2011,37(2):215-223 (in Chinese)
[18] 沈兴家,唐顺明,易咏竹,等. 家蚕、野桑蚕海藻糖酶基因启动子的特性及其滞育激素的转录调节[J]. 蚕业科学,2004,30(2):147-150.
Shen Xingjia, Tang Shunming, Yi Yongzhu, et al. Characterization of trehalase gene promoters from silkworm,BombyxmoriandBombyxmandarinaand transcriptional regulatory effects of diapause hormone on them[J].ActaSericologicaSinica, 2004, 30(2):147-150 (in Chinese)
