不同保存方式下金龟甲虫DNA提取方法及28SrDNA序列分析
2013-11-12贾晨曦郭晓华刘广纯
贾晨曦,郭晓华,b,刘广纯,b
(沈阳大学a.生命科学与工程学院,b.辽宁省城市有害生物治理与生态安全重点实验室,辽宁 沈阳 110044)
核酸序列携带生物起源、进化、种群多样性等重要信息[1].核酸序列研究的重要前提是提取基因组DNA.金龟子是鞘翅目中较大的类群之一,具有重要的经济和生态价值.植食性种类多是农作物、林木、果树的重要害虫;粪食性或腐食性种类有清除粪便等保护环境作用.由于标本采集受季节、地域等因素限制,用活体或新鲜标本作为试材较为困难,标本保存方式十分重要[2].DNA 成功提取也受提取方法的直接影响[3]4869.有关昆虫标本保存和基因组DNA 提取方法的研究曾有过报道[4],但金龟子相关研究报道十分有限.探讨金龟子标本的最佳保存方式和DNA 提取方法,对于研究金龟类昆虫的分子系统发育关系,尤其对昆虫分类新型技术——DNA 条形码的研究具有重要意义[5].
1 材料与方法
1.1 材 料
以金龟科Scarabaeidae星花金龟属Potosia的白星花金龟Potosia(L.)brevitarsis(Lewis)作为实验材料.
样本于2010—2012年采自吉林、辽宁等地,捕捉法采集.
1.2 方 法
1.2.1 标本保存
(1)乙醇浸制标本.将采集的金龟子预先饥饿24h以上,使其消化道内物质消化完全(防止外源DNA 对目的DNA的干扰),分别浸入无水乙醇及75%乙醇中,12h 置换1 次乙醇,更换3次后于4℃冰箱保存,制成浸制标本.
(2)干制标本.将样本饥饿24h后,用昆虫针插于标本盒中,置于通风处自然阴干制成干制标本.
1.2.2 基因组DNA 提取
采用SDS蛋白酶K 法、CTAB法、饱和NaCl法3种方法提取DNA.用无菌水清洗金龟子标本胸部3~5次,并用滤纸吸干.
(1)SDS 蛋白酶K 法.①取虫体胸部肌肉0.1~0.2g,放入2.0ml EP管中,加入500μL匀浆液(0.1 mol/L EDTA,pH=8.0;0.1 mol/L NaCl;0.05 mol/L Tris-HCl,pH=7.6;10%SDS;2mg/mL 蛋白酶K)和少许灭菌的细石英砂,用玻璃棒研磨充分.②将研磨好的混合液置于55℃金属浴中消化12h 左右.③加入500μL Tris-平衡酚,上下颠倒充分混匀,置4 ℃离心机中,8 000r/min离心10min.取上清液至另一支EP管,重复此步骤一次.④加入与上清液等体积Cl液(V(氯仿)∶V(异戊醇)=24∶1),上下颠倒充分混匀,置离心机中4℃,10 000r/min离心10 min,取上清液至EP 管中.⑤在上清液中加入2倍体积的无水乙醇,放入-20 ℃冰箱内静置30 min,使DNA 沉淀,置离心机中12 000r/min离心5min,弃去乙醇.⑥加入-20℃保存的70%乙醇400μL,对沉淀物进行洗涤,12 000r/min离心5min,弃去乙醇,待完全干燥后加入50μL 1×TE缓冲液,置于-20℃冰箱中保存备用.
(2)CTAB法.参照Boyce的方法[6].①取虫体胸部肌肉置于2.0mL EP 管中研磨.②加入2×CTAB提取缓冲液(0.1mol/LTris-HCl,1.4 mol/L NaCl,0.02mol/L EDTA,0.2%β-巯基乙醇,0.05mol/L CTAB,pH=8.3)混匀,于65℃金属浴中消化1h 以上.③11 000r/min离心15 min,取上清液至另一支EP 管.④加入等体积Cl液,11 000r/min离心10min.取上清液,反复抽提3次.⑤加入等体积异丙醇,-20℃沉淀过夜.⑥弃去异丙醇,加400μL 70%乙醇洗涤DNA,自然干燥后加100μL TE 缓冲液溶解,置于4℃冰箱内保存备用.β-巯基乙醇和CTAB为美国Amresco公司生产.
(3)饱和NaCl法.参照张建珍的DNA 提取方法并略有改进[7].①取虫体胸部肌肉于2.0mL EP管中研磨.②加入400μL 匀浆液(STE,pH=8.0;1%SDS;200μg/mL 蛋白酶K),置于65℃金属浴中消化12h 以上.③加入300μL 饱和NaCl,涡旋45s后于离心机中10 000r/min离心30min,取上清液至另一支EP 管.④加入等体积异丙醇-20 ℃沉淀过夜.⑤弃去液体,向沉淀DNA 管中加50μL TE缓冲液,置于-20℃冰箱中保存备用.
1.2.3 基因组DNA的电泳检测
取5μL DNA 样品及3μL的上样缓冲液(6×loading buffer),在0.8%的琼脂糖凝胶上电泳,电泳缓冲液为1×TAE,Genefinder染色,凝胶成像系统拍照,保存结果.
1.2.4 PCR 扩增及测序
用FF:5′-ttacacactccttagcggat-3′和DD:5′-gggacccgtccttgaaacac-3′双 向 引 物[8],PCR 扩 增28SrDNA(D3-D6)核基因序列.50μL 反应体系包含10×buffer 5μL,dNTP 5μL,Taq DNA 聚合酶0.3μL,上下游引物各1.0μL,模板3μL,无菌水34.7μL.反应程序包括:94℃预变性4min,94℃变性30s、52℃退火30s、72℃延伸40s共40个循环,72℃延伸4min.1.5%琼脂糖凝胶电泳检测,拍照.将电泳条带明亮、未经纯化的扩增产物送上海生工有限公司进行纯化及双向测序,测序仪为ABI-PRISM 3730.
1.2.5 序列拼接及多重同源比对
应用DNAstar软件中的Seqman 进行自测序列正反链拼接,删掉引物部分并在NCBI数据库进行BLAST 相似性搜索,以保证测得序列为目的基因.用Clustal X2.0 软件将拼接序列与GenBank下载的花金龟属Cetonia aurata aurata(序列号EU084146)序列进行比对,保存为Nexus格式.
2 结果
2.1 基因组DNA提取
应用SDS-蛋白酶K 法、CTAB法、饱和NaCl法分别对3种不同保存方式的标本进行基因组DNA 提取,经0.8%琼脂糖凝胶电泳检测,结果显示,用3种提取方法提取不同保存方式标本的DNA 时,其获得率有一定差异.SDS-蛋白酶K 法提取无水乙醇保存标本、75%乙醇保存标本、干制标本的DNA 电泳条带清晰明亮(见图1);CTAB法也能提取一定量基因组DNA(见图2);饱和NaCl法提取无水乙醇保存的标本DNA 获得率较高(见图3 中1~3),而75%乙醇保存的标本DNA 获得率较低(见图3中6~8),干制标本基本没有提出DNA(见图3中4~5).
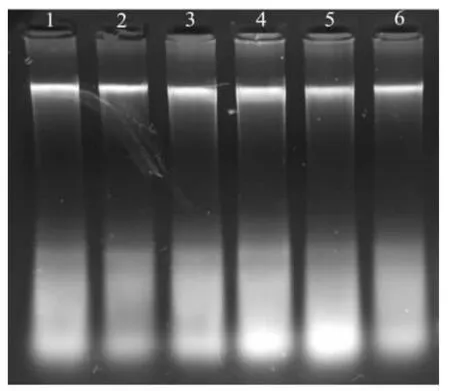
图1 不同保存方式下SDS-蛋白酶K法提取DNA的电泳图谱Fig.1 The gel electrophoresis pattern of genomic DNA extracted by SDS-protease K under different preservation methods
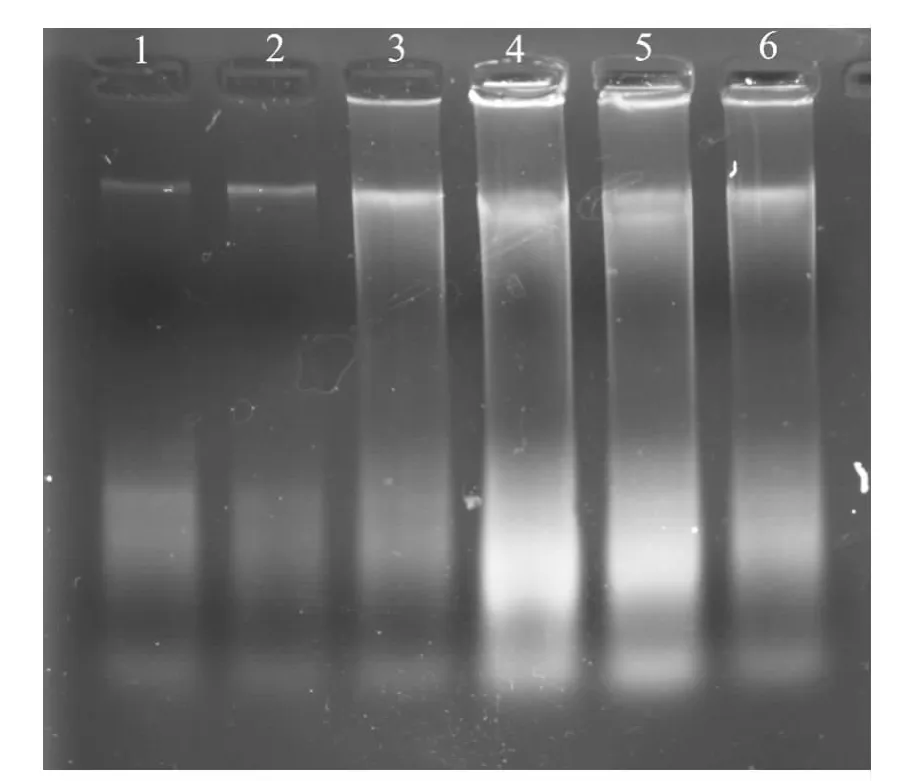
图2 不同保存方式下CTAB法提取DNA的电泳图谱Fig.2 The gel electrophoresis pattern of genomic DNA extracted by CTAB under different preservation methods

图3 不同保存方法下饱和NaCl法提取DNA的电泳图谱Fig.3 The gel electrophoresis pattern of genomic DNA extracted by Saturated NaCl under different preservation methods
2.2 28SrDNA基因序列的PCR扩增
用不同保存方法和DNA 提取方法获得的DNA 提取液作为模板,进行28SrDNA 基因序列PCR 扩增并电泳检测,结果见图4.其中用SDS-蛋白酶K 法提取3种方法保存标本的DNA,均扩增出28SrDNA 基因序列(1~5);CTAB 法也可以从无水乙醇保存(6~7)、75%乙醇(8~9)、干制(10)的标本中扩增目的基因,但干制标本扩增目的基因的效果没有达到100%(11);用饱和NaCl法时,仅无水乙醇保存的1个标本扩增出目的基因(13),另一标本的目的基因也未得到有效扩增(12),75%乙醇和干制保存的标本中则没有扩增出目的基因(14~15).
将自测的白星花金龟28SrDNA 序列与GenBank中Cetonia aurata aurata 同源序列进行BLAST 比较,结果显示同源性高达到99%以上.应用Clustal X 2.0软件进行多重比对的结果表明(见图5),通过不同保存方法和DNA 提取方法获得的DNA 模板所扩增的10个片段(a~j),其核苷酸序列完全一致,说明只要扩增出目的片段,其核苷酸序列正确并稳定.由于GenBank数据库中未见星花金龟属和白星花金龟的28S rDNA 序列,故以花金龟属代表种为对照,比对结果显示白星花金龟与Cetonia aurata aurata 相差3个核苷酸位点,反映出种属间的28SrDNA 序列差异.
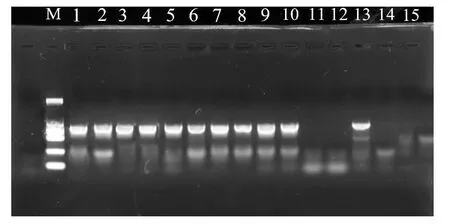
图4 不同保存方式和提取方法的PCR扩增产物(28SD3-D6rDNA片段)的凝胶电泳图谱Fig.4 The gel electrophoresis pattern of the PCR amplification products(28SD3-D6rDNA gene fragment)of the different preservation methods and extraction methods
3 讨 论

图5 不同保存方式和DNA提取方法下28SrDNA序列Clustal X 2.0多重比对(点代表与第一行碱基相同)Fig.5 Clustal X 2.0multiple alignment of the 28SrDNA sequences from specimens under the different preserved conditions and the different DNA-extracted methods(Identity with first sequence denoted by dots)
在许多情况下,长距离、大范围的标本采集后需要优选正确的保存方式;获得种类齐全,尤其是稀有种的标本信息,也要选择DNA 降解少的标本保存方法.昆虫标本保存方法不同,组织DNA降解程度亦不同.Pääbo等认为,干制标本早期受内源酶水解而破坏,有效避免DNA 降解的关键是尽量缩短动物死亡到完全干燥的时间.本研究采用捕捉方法采集标本,经1d饥饿处理,选用无水乙醇、75%乙醇、针插干制3种方法保存.采用SDS-蛋白酶K 法和CTAB 法提取DNA 时,3种保存方法基本可提取高质量的DNA,琼脂糖凝胶电泳检测时,基因组DNA 和扩增基因的电泳条带整齐、明亮;饱和NaCl法提取DNA 时,经无水乙醇保存的标本,有时可有效提取DNA 并扩增目的基因,而75%乙醇保存和干制标本的基因扩增不理想,有明显降解,无PCR 扩增条带.谭亮魁等研究天牛基因组DNA的提取方法及保存方式的结果表明,提取乙醇保存和干制标本时,CTAB法和SDS-蛋白酶K 消化法均优于饱和NaCl法,这与本研究结论相似[3]4870.张建珍用饱和NaCl法提取蝗虫基因组DNA的结果表明,70%乙醇固定的标本和部分干标本提取的总DNA 得率较低,而100%乙醇浸泡标本提取的总DNA 带型整齐[7].28SrDNA 是昆虫研究应用较多的DNA条形码序列.扩增目的片段的长度与DNA的降解程度关系密切.有学者对步甲的馆藏50年以上干制标本进行DNA 提取和基因扩增,获得250~345bp长度的28SrDNA 基因片段.本研究PCR扩增产物的电泳图谱表明,11个标本的PCR 扩增片段长度均为750bp以上(见图4),说明标本没有出现影响片段长度的降解现象.金龟类甲虫鞘翅坚硬,透水透气性差,夏季高温阴雨天气易使虫体霉变,组织完全阴干所需时间较长,因此,活体标本尽快浸入乙醇是最佳的保存方法.CTAB法在提取过程中不需要蛋白酶K 等价格较昂贵的药品试剂,并适于3种保存方式标本的DNA提取.同时尽量选择虫体胸部和腿部肌肉组织,避免消化道食物影响DNA 提取结果.
[1]刘殿锋,蒋国芳.核基因序列在昆虫分子系统学上的应用[J].动物分类学报,2005,30(3):484-492.(Liu Dianfeng,Jiang Guofang.The Application of Nuclear Genes Sequences in Insect Molecular Systematics[J].Acta Zootax Sin,2005,30(3):484-492.)
[2]张迎春,刘波,郑哲民,等.不同保藏处理的昆虫标本DNA提取及其随机扩增多态DNA 反应[J].昆虫学报,2001,45(5):693-695.(Zhang Yingchun,Liu Bo,Zheng Zhemin,et al.DNA Extraction and RAPD-PCR of Insect Specimens Preserved with Different Methods[J].Acta Entomol Sin,2001,45(5):693-695.)
[3]谭亮魁,王文凯.天牛基因组DNA 提取方法和标本保存方式的比较研究[J].安徽农业科学,2008,36(12).(Tan Liangkui,Wang Wenkai.Comparative Study on Different Extracting Methods of Genomic DNA from Cerambycidae and Different Samples Preservation Modes[J].J Anhui Agri Sci,2008,36(12):4869-4871,4903.)
[4]朴美花,陈学新,何俊华.膜翅目昆虫干标本的基因组DNA提取[J].动物分类学报,2002,27(4):672-676.(Piao Meihua,Chen Xuexin,He Junhua.Extraction of Genome DNA from Dried Specimens of Hymenopteran Insects(Insecta)[J].Acta Zootax Sin,2002,27(4):672-676.)
[5]李蓓,郭晓华,刘广纯,等.嗡蜣螂属Onthophagus十二种蜣螂线粒体COI基因的DNA 条形码研究[J].应用昆虫学报,2013,50(1):178-187.(Li Bei,Guo Xiaohua,Liu Guangchun,et al.The DNA Barcoding Application of MtDNA COI Genes in 12 Dung Beetle Species of Onthophagus[J].Chin J Appl Entomol,2013,50(1):178-187.)
[6]Boyce T M,Zwick M E,Aquado C F.Mitochondrial DNA in the Pine Weevil:Size Structure and Heteroplasmy[J].Genetics,1989,123:825-836.
[7]张建珍,郭亚平,马恩波.不同保存方式下蝗虫组织DNA的提取及RAPD分析[J].动物学杂志,2004,39(2):54.(Zhang Jianzhen,Guo Yaping,Ma Enbo.DNA Extraction and RAPD Analysis of Grasshopper Samples Kept under Different Conditions[J].Chinese Journal of Zoology,2004,39(2):53-57.)
[8]Monaghan M T,Inward D J G,Hunt T,et al.A Molecular Phylogenetic Analysis of the Scarabaeinae(Dung Beetles)[J].Mol Phyl Evol,2007,45(2):674-692.
