人类胎盘体外循环灌注模型的建立
2013-11-12马润玫郑巧玲
黄 桦,张 峻,马润玫,闫 晨,郑巧玲,姚 勤
(昆明医科大学第一附属医院1.临床药学科,2.妇产科,云南昆明 650032)
研究表明,有23% ~85%的妊娠期妇女在妊娠期间须接受药物治疗[1],使得妊娠期用药安全性受到社会日益关注。然而,由于妊娠期用药研究涉及伦理原则,人们很少或不能做人类的前瞻性研究,目前主要的参考依据仍源于动物实验或回顾性临床研究。但是,动物实验所提供的药物致畸作用信息鉴于种属差异不能保证用于人类毫无风险;而回顾性临床研究周期长,工作量大,收集病例困难,存在一定的伦理风险,且得到的数据只能为胎儿的风险评估提供概率。面对不可避免的妊娠期用药,有限的安全性信息不足以为胎儿的安全性提供保障。因此,进一步完善妊娠期用药的安全性信息,为临床提供直接、有力、可信的妊娠期用药安全性依据具有重要意义。
胎儿风险评估中一个重要的关键性因素是胎儿的药物暴露量,即药物经胎盘转运的程度,因此,进行药物的胎盘透过性研究是评价妊娠期用药安全性的重要依据。
人类胎盘体外循环灌注模型是将刚分娩出的胎盘进行小叶分离、灌注,建立母体面和胎儿面的双向循环,在体外模拟人体子宫,为原来无法在妊娠期妇女体内完成的胎盘透过性研究提供了一种可行的途径[2-3]。该模型目前已成为研究外来物质(如药物、毒物、环境污染物等)能否透过胎盘、对胎儿造成暴露的经典模型[3-5]。
迄今,国内尚无应用该模型进行药物透过性研究的报道,国外已应用该模型进行了格列本脲[6]、卡铂[7]、美罗培南[8]、二甲双胍[9]和双酚 A[10]等多种药物的胎盘透过性研究。鉴于种族差异不可将国外研究结果贸然用于中国人种,因此,为了完善中国妊娠期妇女用药安全性信息,本研究以安替比林为参照物,结合离体胎盘小叶灌注技术,在国内首次研制并建立人类胎盘体外循环灌注模型[11],为妊娠期用药安全性评价提供新的实验方法。
1 材料与方法
1.1 胎盘
自然分娩或剖宫产刚娩出的健康、完整和足月的人类胎盘20个,由昆明医科大学第一附属医院妇产科提供,均为患者签字同意交医院处理。待胎盘娩出后,浸于预先冷藏保存的含肝素生理盐水中,10 min内运回实验室,20 min内建立循环。
1.2 试剂与仪器
安替比林对照品,购自Adamas-beta公司,批号:P05396,纯度:98%;Krebs-Ringer干粉,购自美国Sigma-Aldrich公司,批号:070M8303;牛血清白蛋白,批号:10735078001,购自美国 Biosharp公司;碳酸氢钠注射液,批号:12030423,购自济南利民制药有限责任公司;0.9%氯化钠注射液,批号:M12100412,购自四川科伦药业股份有限公司;肝素钠注射液,批号:1201111,购自江苏万邦生化医药股份有限公司;水为自制超纯水。
Simplicity纯水仪,美国Millipore公司;蠕动泵,配有Masterflex L/S 07523-90泵控制台,Masterflex L/S easy-loadⅡ泵头,美国 Cole-Parmer公司;磁力搅拌器,常州国华电器有限公司;恒温水浴锅HH-6,常州国华电器有限公司;恒温加热箱(自制);密闭式静脉留置针20G×1.16〞,批号:1322498,美国BD公司;SH138-ISTAT血气分析仪,美国雅培公司;动脉采血器,批号:1284336,美国BD公司;i-STAT G3+血气分析片总裁,批号:N13054,美国雅培公司。
1.3 胎盘体外循环的建立
胎盘结构如图1所示。选择供应同一胎盘小叶的一对脐动静脉,穿刺插管后建立单个胎盘小叶的胎儿循环;胎儿面向下固定于胎盘室内,置于37℃恒温水浴中,将一端接有导管的两根钝头针插入同一胎盘小叶的绒毛间隙内2~3 mm,模拟子宫螺旋动脉,建立母体循环(图2)。以蠕动泵为循环动力,分别向母体和胎儿循环泵入灌流液,建立同一个胎盘小叶母体侧和胎儿侧的双向闭合循环。
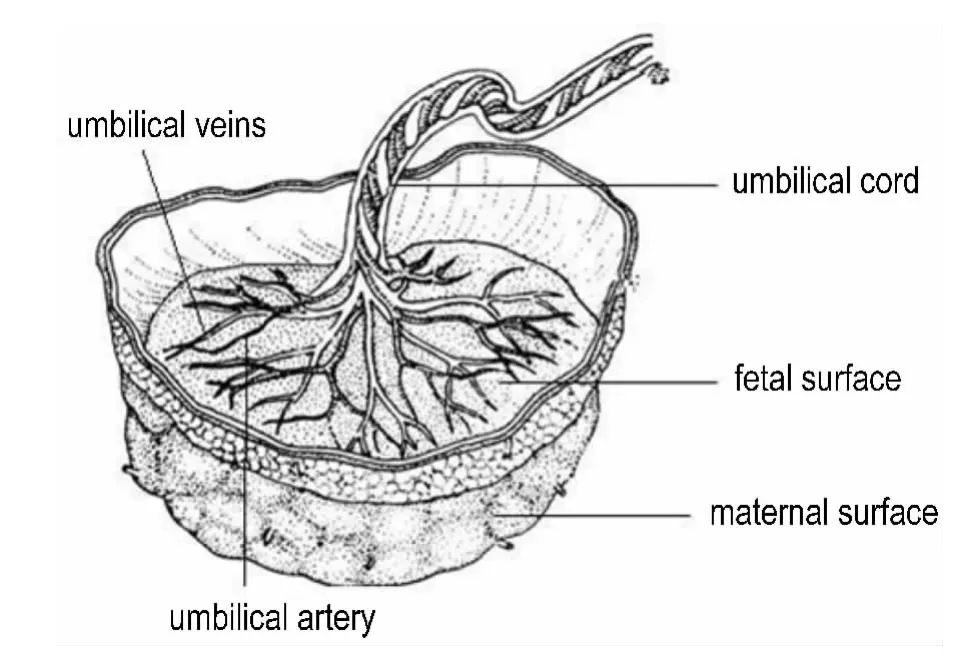
Fig.1 Structure of the human placenta.

Fig.2 Schematic diagram of placenta cannula.A:fetal surface(a fetal vein-artery pair supplying a well defined cotyledon was identified.The fetal vessels were cannulated,and the flow of perfusate is established).B:maternal surface(the lobule was clamped with the fetal side downward into a chamber.Perfusion of the maternal side began with insertion of blunt-tipped needles into the intervillous space 2-3 mm below the decidual surface).
人类胎盘体外循环灌注模型如图3所示,整个循环系统置于37℃恒温箱内。胎盘灌流液为Krebs-Ringer缓冲液[6,12],含白蛋白 22.5 g·L-1,加入适量碳酸氢钠注射液调节其pH值于7.2~7.4;使用前加热至37℃,并通过磁力加热搅拌器保持恒温(磁力搅拌器转速为4.5×g)。

Fig.3 Schematic presentation of human placental perfusion experimental setup.1:perfusion chamber;2:maternal reservoir;3:fetal reservoir;4:maternal artery;5:maternal vein;6:fetal artery;7:fetal vein;8:peristaltic pump;9:magnetic stirring apparatus;10:37℃ incubator.
1.4 胎盘体外循环灌注模型评价指标的检测
1.4.1 胎儿循环侧漏液率的检测
母体侧和胎儿侧循环建立后,在循环持续时间内,观察胎儿循环侧液体储备池中液体的体积有无变化。由于水分的自然蒸发以及胎儿侧循环需要施加一定压力等原因,允许胎儿侧液体有少量的损失。循环结束时量取胎儿循环侧液体储备池中液体的体积,计算液体渗漏量及渗漏率。若胎儿循环侧的渗漏率≤4 m·lh-1[3],则符合循环建立成功的评价指标。
1.4.2 安替比林透过率的检测
安替比林可通过被动扩散的方式透过胎盘屏障进入胎儿循环,且安替比林的胎盘透过率不受灌流液中蛋白含量以及灌流液中其他药物的影响,是胎盘透过性研究的常用阳性标记物[3,8,14-18]。循环开始前30 min,母体池中通入混合氧气(95%氧气+5%二氧化碳,25~35 kPa),以提高母体池中灌流液的含氧量,模拟母体动脉血的真实情况;胎儿池中通入混合氮气(95%氮气+5%二氧化碳,15~20 kPa),以降低胎儿池中灌流液的含氧量,模拟胎儿脐动脉血的真实情况。30 min预灌注后,母体池和胎儿池通气压力分别调整为20~30和10~15 kPa,同时在母体池中加入25 mg安替比林,使其中安替比林浓度为100 mg·L-1。循环灌注 3 h,母体侧流速12 ml·min-1,胎儿侧流速3 m·lmin-1。于循环开始后 0,5,10,15,20,30,45,60,75,90,105,120,150和180 min分别抽取胎儿池中样品,按本实验室所建HPLC法[13]测定胎盘灌流液中安替比林的浓度。当安替比林经胎盘转运达到平衡后,其胎盘透过率>20%[18-20]便可认为该模型建立成功。胎盘透过率公式为:透过率=CF/CM×100%,其中CF表示在胎儿循环侧的药物浓度,CM表示母体循环侧的最初药物浓度。
1.4.3 胎盘灌流液pH值的测定
人类胎盘体外循环灌注模型在体外模拟母体循环和胎儿循环,为保证整个循环过程中胎盘的活性,模拟母体和胎儿血液的母体池和胎儿池中灌流液pH值在整个循环过程中需控制在 7.2 ~7.4[14,19,20],否则认为建模失败。实验中于循环开始后0,30,60,90,120,150和180 min分别抽取母体池和胎儿池中样品进行血气分析,测定pH值。
2 结果
2.1 人胎盘体外循环灌注模型中的胎儿循环侧漏液率
本研究建立的20例人类胎盘体外循环灌注模型的胎儿侧漏液率如表1所示,胎儿侧漏液率在0.17 ~3.90 ml·h-1之间,均 < 4 ml·h-1,平均2.47 ±1.27 ml·h-1符合循环建立成功的评价指标,提示模型成功建立。
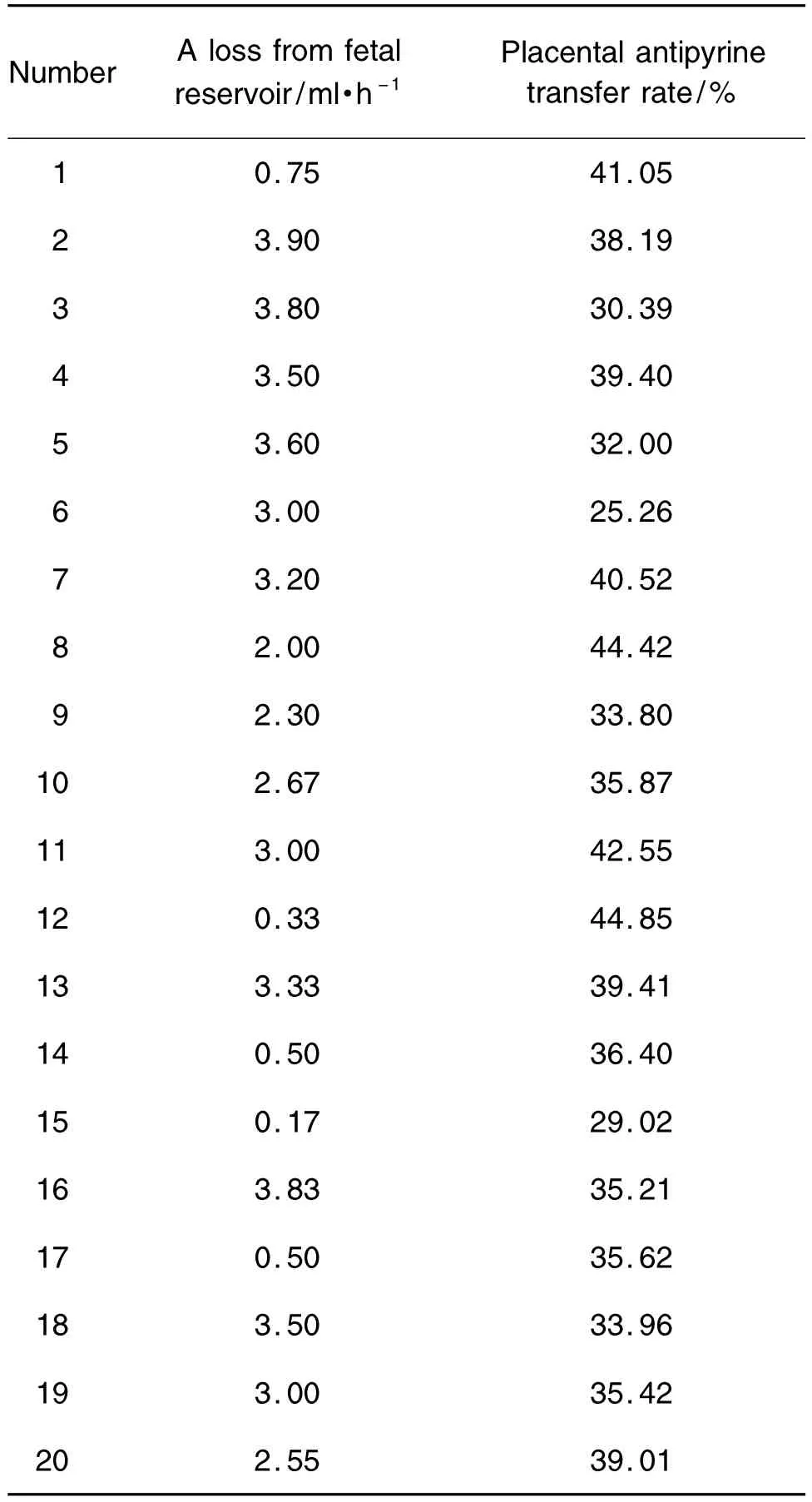
Tab.1 The loss from fetal reservoir and placental antipyrine transfer rate in human placental perfusion model
2.2 人胎盘体外循环灌注模型中安替比林的透过率
安替比林经胎盘转运达到平衡后的透过率如表1所示,安替比林经胎盘转运的透过率-时间图如图4所示,当灌流循环至100 min左右时,安替比林的胎盘透过率>20%;当灌流循环至150~180 min时,安替比林的胎盘透过率趋于平衡,循环结束时其平均胎盘透过率为(36.62±5.08)%。
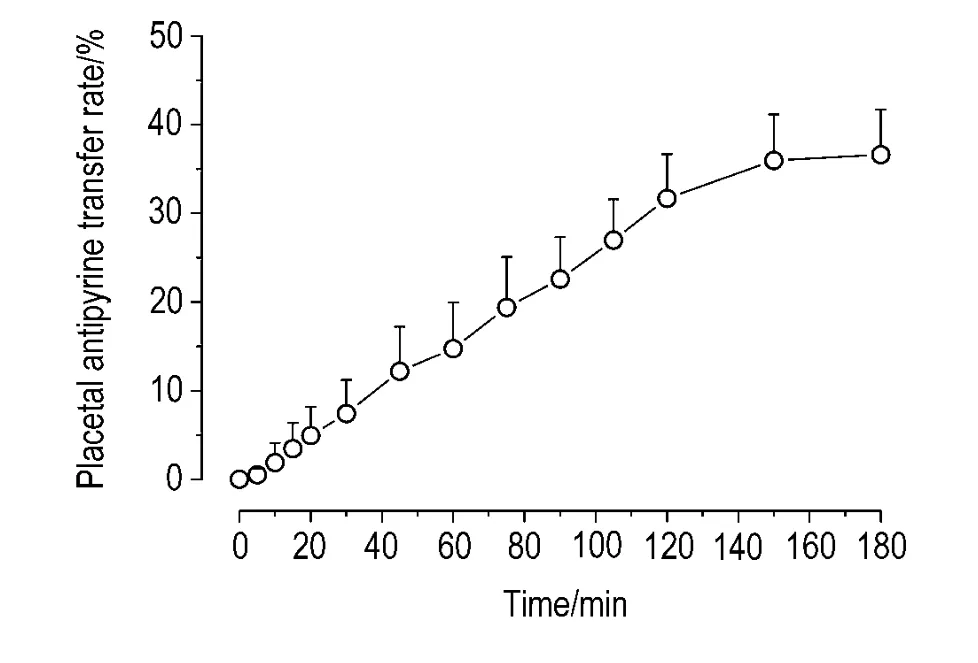
Fig.4 Placental antipyrine transfer rate in 3 h in human placental perfusion model.During the perfusion,samples were collected at 0,5,10,15,20,30,45,60,75,90,105,120,150 and 180 min from the fetal reservoir after addition of antipyrine.The samples were detected by HPLC.±s,n=20.
2.3 人胎盘体外循环灌注模型中胎盘灌流液的pH值
由表2可知,3 h持续循环过程中,母体池和胎儿池灌流液pH值均维持在7.2~7.4范围内。

Tab.2 pH of placental perfusate in human placental perfusion model
本研究所建立的人类胎盘体外循环灌注模型胎儿侧漏液率、安替比林透过率和循环过程中灌流液pH值均达到模型评价指标的要求,20例人类胎盘体外循环灌注模型建立成功。
3 讨论
人类胎盘体外循环灌注模型遵守医学伦理道德规范,不仅没有种属差异的限制,还在体外保留了完整的人类胎盘组织,完全按照人体子宫内胎盘循环原理设计,能够真实模拟孕妇、胎盘及胎儿三者血液循环在子宫内的状况,可直接反映人体胎盘的吸收、代谢和分泌功能以及药物的透过性。
本研究选取的是自然分娩或剖宫产刚娩出的、足月、完整的健康人类胎盘,且胎盘组织不能有任何破裂、损伤,要有完整的羊膜。实验中发现,如果胎盘组织有破裂或羊膜不完整会导致胎儿侧循环漏液。因此胎盘的选取是影响胎盘体外循环灌注模型是否能够成功建立的重要因素。
保证胎盘的活性是保证试验成功的关键因素。为了更长时间保持胎盘的活性,试验中需要严格控制试验条件。首先,胎盘体外循环的建立应在胎盘娩出后30 min内完成,这就要求研究人员需要掌握熟练的离体胎盘小叶穿刺和灌注技术。
其次,试验过程中还应实时监测胎儿池和母体池中的温度、pH值,使胎儿侧和母体侧液体储备池中灌流液的温度控制在36.5~37.5℃,pH值控制在7.2 ~7.4。
除上述条件外,还需模拟正常人体内和胎儿体内动静脉血液中的气体分压。正常人体动脉血液富含氧气和营养物质,其血氧饱和度为98%。灌流液中氧饱和度的变化可影响循环过程中胎盘的活性,从而影响药物的胎盘透过率。Bachmaier等[21]利用人类胎盘体外循环灌注模型考察了不同供氧程度对安替比林胎盘透过率的影响,利用光学显微镜和电子显微镜观察灌流前后胎盘组织的形态学变化。结果表明,降低灌流液的供氧量可引起胎盘绒毛结构的改变,安替比林的胎盘透过率也会因此大大降低。为了观察通入氧气前后灌流液中氧饱和度的变化,抽取灌流液进行氧饱和度和氧分压测定,未通入氧气时的氧分压为71 mmHg、氧饱和度为91%,以25~35 kPa的压力通入氧气30 min后氧分压为323 mmHg、氧饱和度为100%。结果表明,循环开始前30 min向灌流液中通入氧气可有效提高其氧分压和氧饱和度,为迅速改善离体胎盘组织的缺氧状况、维持胎盘的正常功能提供了保障。
综上所述,本研究在国内首次成功建立了人类胎盘体外循环灌注模型,该模型可进行药物和毒物等外源性物质的胎盘透过性研究,填补了国内利用体外模型进行人类胎盘透过性研究的空白,为原来无法在妊娠期妇女体内完成的药物安全性研究提供了一种可行的途径,为妊娠期用药安全性提供了可靠的体外研究模型和理论支持。
[1]Gendron MP,Martin B,Oraichi D,Bérard A.Health care providers'requests to teratogen information services on medication use during pregnancy and lactation[J].Eur J Clin Pharmacol,2009,65(5):523-531.
[2]Panigel M,Pascaud M,Brun JL.Radioangiographic study of circulation in the villi and intervillous space of isolated human placental cotyledon kept viable by perfusion[J].J Physiol(Paris),1967,59(1 Suppl):277.
[3]Hutson JR,Garcia-Bournissen F,Davis A,Koren G.The human placental perfusion model:a systematic review and development of a model to predict in vivo transfer of therapeutic drugs[J].Clin Pharmacol Ther,2011,90(1):67-76.
[4]Sun GY, Wu H, Zhang J. Progress in drug-transport across the human placenta[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2011,25(3):327-329.
[5]Myren M,Mose T,Mathiesen L,Knudsen LE.The human placenta -an alternative for studying foetal exposure[J].Toxicol In Vitro,2007,21(7):1332-1340.
[6]Kraemer J,Klein J,Lubetsky A,Koren G.Perfusion studies of glyburide transfer across the human placenta:implications for fetal safety[J].Am J Obstet Gynecol,2006,195(1):270-274.
[7]Al-Saleh E,Nandakumaran M,Al-Rashdan I,Al-Harmi J,Al-Shammari M.Maternal-fetal transport kinetics of carboplatin in the perfused human placental lobule:in vitro study[J].J Matern Fetal Neonatal Med,2007,20(9):695-701.
[8]Hnat M, Bawdon RE. Transferofmeropenem in the ex vivo human placenta perfusion model[J].Infect Dis Obstet Gynecol,2005,13(4):223-227.
[9]Nanovskaya TN,Nekhayeva IA,Patrikeeva SL,Hankins GD,Ahmed MS.Transfer of metformin across the dually perfused human placental lobule[J].Am J Obstet Gynecol,2006,195(4):1081-1085.
[10]Balakrishnan B, Henare K, Thorstensen EB, Ponnampalam AP,Mitchell MD.Transfer of bisphenol A across the human placenta[J].Am J Obstet Gynecol,2010,202(4):393.e1-e7.
[11]The First Affiliated Hospital of Kunming Medical University.An equipment for human placental transfer studies.China:201120210918.0[P],2011-12-07.
[12]Nanovskaya TN, Patrikeeva S, Hemauer S, Fokina V,Mattison D,Hankins GD,et al.Effect of albumin on transplacental transfer and distribution of rosiglitazone and glyburide[J].J Matern Fetal Neonatal Med,2008,21(3):197-207.
[13]Wu H,Yao Q,Zhou Q,Deng YL,Huang H,Zhang J.Determination of the concentration of antipyrine in placental perfusion by HPLC[J].China Pharm(中国药房),2012,23(10):884-886.
[14]Mathiesen L,Mose T,Mørck TJ,Nielsen JK,Nielsen LK,Maroun LL,et al.Quality assessment of a placental perfusion protocol[J].Reprod Toxicol,2010,30(1):138-146.
[15]Mathiesen L,Rytting E,Mose T,Knudsen LE.Transport of benzo[alpha]pyrene in the dually perfused human placenta perfusion model:effect of albumin in the perfusion medium[J].Basic Clin Pharmacol Toxicol,2009,105(3):181-187.
[16]Wick P,Malek A,Manser P,Meili D,Maeder-Althaus X,Diener L,et al.Barrier capacity of human placenta for nanosized materials[J].Environ Health Perspect,2010,118(3):432-436.
[17]Holmes HJ,Casey BM,Bawdon RE.Placental transfer of rosiglitazone in the ex vivo human perfusion model[J].Am J Obstet Gynecol,2006,195(6):1715-1719.
[18]Berveiller P,Mir O,Vinot C,Bonati C,Duchene P,Giraud C,et al.Transplacental transfer of oseltamivir and its metabolite using the human perfused placental cotyledon model[J].Am J Obstet Gynecol,2012,206(1):92.e1-e6.
[19]Kovo M,Haroutiunian S,Feldman N,Hoffman A,Glezerman M.Determination of metformin transfer across the human placenta using a dually perfused ex vivo placental cotyledon model[J].Eur J Obstet Gynecol Reprod Biol,2008,136(1):29-33.
[20]Peytavin G, Leng JJ, Forestier F,Saux M,Hohlfeld P,Farinotti R.Placental transfer of pyrimethamine studied in an ex vivo placental perfusion model[J].Biol Neonate,2000,78(2):83-85.
[21]Bachmaier N,Linnemann K,May K,Warzok R,Kuno S,Niemeyer M,et al.Ultrastructure of human placental tissue after 6 h of normoxic and hypoxic dual in vitro placental perfusion[J].Placenta,2007,28(8-9):861-867.
