雄黄对大鼠和兔的胚胎/胎仔的发育毒性
2013-11-12谷颖敏吴韬奋黄珍祯樊海艇吴文斌米金霞张超超汤家铭
谷颖敏,吴韬奋,黄珍祯,赵 源,樊海艇,吴文斌,米金霞,张超超,汤家铭
(上海中医药大学实验动物中心,上海 201203)
雄黄是一种常用的矿物质中药,其功能为解毒杀虫、燥湿祛痰和截疟,广泛用于复方中药和中成药中。但雄黄有毒,雄黄内服宜慎,不可久用,孕妇禁用[1]。被2010年版《中华人民共和国药典》收载为72种有毒中药之一。但目前雄黄对孕妇影响的临床报道以及雄黄的生殖毒性实验研究报道很少,在前期的研究中,发现雄黄对大鼠生育力与早期胚胎发育[2]、孕大鼠母体和胚胎/胎仔发育[3]无明显毒性作用。为了了解雄黄对不同种属生殖毒性的影响,本研究采用孕大鼠和孕兔进行了胚胎/胎仔发育毒性实验的比较,探讨雄黄的生殖毒性。
1 材料与方法
1.1 试剂和药品
雄黄饮片,批号H2007052401,水飞处理后保存,含量95.5%,产自湖南石门雄黄矿业,由上海市食品药品检验所提供。环磷酰胺(阳性对照),规格:每安瓿0.2 g,批号10102921,购自江苏恒瑞医药股份有限公司。沙利度胺原料药,白色粉末状,纯度99.23%,批号:120101,购自湖北大仝生物化工科技有限公司。
0.5%羧甲基纤维素钠溶液,批号F20090508,购自国药集团化学试剂有限公司。
1.2 动物
清洁级SD大鼠,雌性体质量180~230 g,雄性体质量300~350 g,由上海西普尔-必凯实验动物有限公司提供,饲养于本中心屏障系统;普通级新西兰兔,雌性体质量≥2.5 kg,交配后第4天由新昌县大市聚镇欣健兔场提供,饲养于本中心普通级兔饲养室。动物许可证号:SYXK(沪)2009-0069,常规饲养,饲养环境指标控制在国标规定的范围内。
1.3 交配及分组
大鼠以雌雄2∶1比例同居。次日上午用大鼠阴道内精子检查法确认交配。未交配成功者继续进行合笼交配,交配成功者按体质量分层随机分组,分为正常对照组、环磷酰胺(阳性对照)组、雄黄125,250和550 mg·kg-1组共5 组,每组17~19 只。
孕兔随机分为正常对照组、沙利度胺(阳性对照)组、雄黄31.3,62.5 和125 mg·kg-1组共5 组,每组孕兔最终达到8只以上。
1.4 动物给药及一般状态观察
大鼠从怀孕第6天~第15天ig给予雄黄125,250 和 550 mg·kg-1(按 1 ml/100 g),每天1次,共10 d,阳性对照组大鼠于怀孕第10天im注射给予环磷酰胺按10 mg·kg-1,正常对照组大鼠给予等容量的 0.5%羧甲基纤维素钠。兔按10 ml·kg-1给药,从怀孕第6天 ~第18天 ig给予雄黄 31.3,62.5和 125 mg·kg-1,每天 1 次,共13 d。兔阳性对照ig给予沙利度胺按200 mg·kg-1,每天1次,共13 d。给药期间按体质量变化调整给药量。
各实验组在给药期和停药后恢复期,每天观察行为活动、呼吸、皮毛、阴道分泌物、粪、尿等,进行体质量和摄食量测定。
1.5 母体体质量称量以及胎仔质量等的检测
孕大鼠于妊娠第20天进行解剖,孕兔于妊娠第29天解剖。
称量子宫、卵巢,观察并记录胎仔外观、黄体数、活胎数、死胎数、胎盘总质量、胎盘外观、胎仔体质量、胎仔性别,测量胎仔顶臀长和尾长,并计算着床数及晚期胚胎流失率。
取1/2胎仔经固定和茜素红S应用液染色后用于骨骼检查,取另1/2胎仔用Bouin液固定后用于内脏检查。
1.6 统计学分析
2 结果
2.1 雄黄对孕大鼠和孕兔母体的一般情况的影响
在实验期间,与正常对照组相比,孕大鼠雄黄125,250和550 mg·kg-1组和阳性对照组未见明显的外观异常,被毛光泽,活动佳,大便正常(呈雄黄色)。雄黄组体质量增长未发生明显的变化,与正常对照组比较无明显差异。
与正常对照组相比,孕兔雄黄125 mg·kg-1组给药后摄食量逐渐减少,部分母兔不进食,同时粪便也逐渐减少;给药3 d后,部分孕兔出现消瘦、被毛杂乱和无光泽等现象,并且活动逐渐减少,之后母兔陆续发生死亡(10/18);停止给药后,母兔摄食量逐渐恢复,其他异常也逐渐消失。雄黄 62.5和31.3 mg·kg-1组给药后孕兔也出现不同程度摄食量减少,个别孕兔逐渐消瘦、死亡(雄黄62.5 mg·kg-1组死亡1/10,31.3 mg·kg-1组死亡2/11)。
2.2 雄黄对孕大鼠和孕兔胚胎的形成及胎仔一般生长发育指标的影响
2.2.1 雄黄对孕大鼠和孕兔子宫、胎仔和胎盘质量的影响
与正常对照组相比,雄黄 125,250和550 mg·kg-1组对孕大鼠子宫连胎质量、子宫净质量及胎仔总质量及胎盘总质量等指标有随着剂量的增加而下降的趋势,但与正常对照组比较无显著意义。而阳性对照环磷酰胺组的各项指标均明显低于正常对照组(P<0.01)(表1)。

Tab.1 Effect of realgar on mass of uteruses,fetuses,and placenta in pregnant rats
如表2所示,与正常对照组相比,雄黄31.3,62.5 和125 mg·kg-1组对孕兔子宫连胎质量、子宫净质量及胎仔总质量及胎盘总质量等指标有随着剂量的增高而下降的趋势,但无统计学差异。阳性对照沙利度胺组的各项指标与正常对照组比较亦无显著差异。
2.2.2 雄黄对孕大鼠和孕兔胎仔存活的影响
如表3所示,与正常对照组相比,雄黄各剂量组的孕大鼠平均胎仔数、活胎数(率)无显著差异,而阳性对照环磷酰胺组活胎率明显降低(P<0.01),死胎率明显升高(P<0.01)。
如表4所示,与正常对照组活胎率90.90%比较,雄黄125和62.5 mg·kg-1组孕兔活胎率明显降低,分别为45.76%和72.73%,且随剂量的增高而降低,差异有极显著意义(P<0.01);阳性对照沙利度胺组及雄黄31.3 mg·kg-1组活胎率无显著差异。
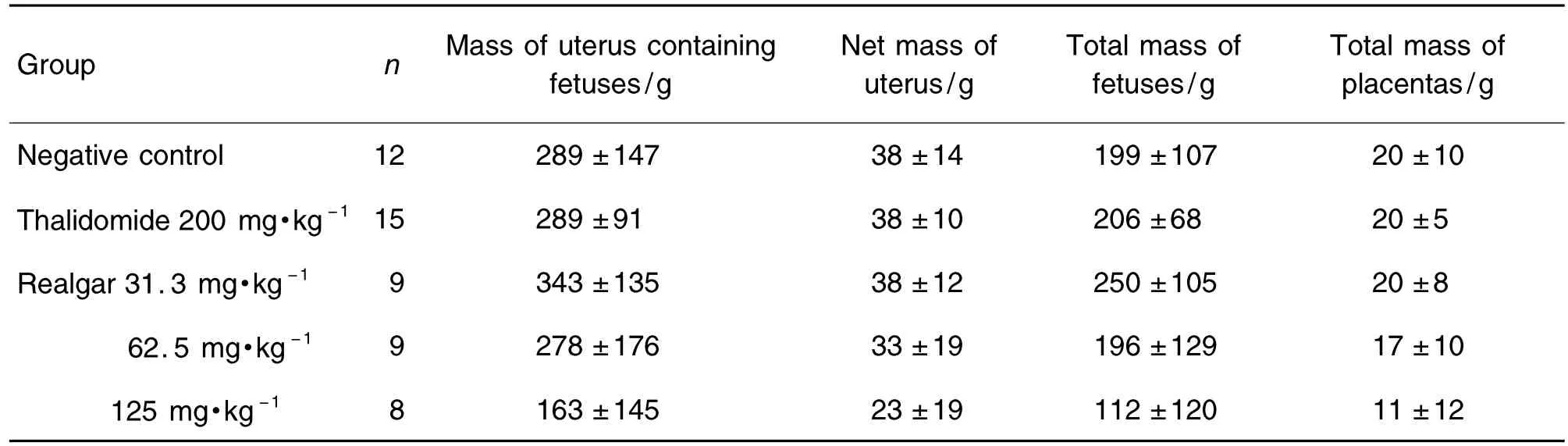
Tab.2 Effect of realgar on mass of uteruses,fetuses,and placentas in pregnant rabbits
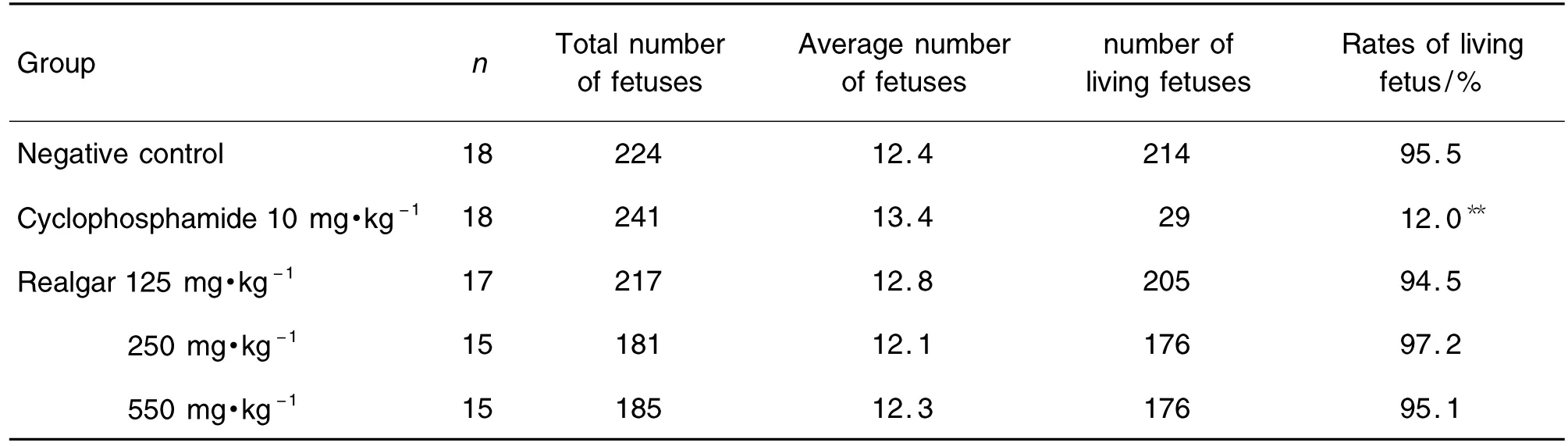
Tab.3 Effect of realgar on average numbers of fetuses and living fetuses in pregnant rats
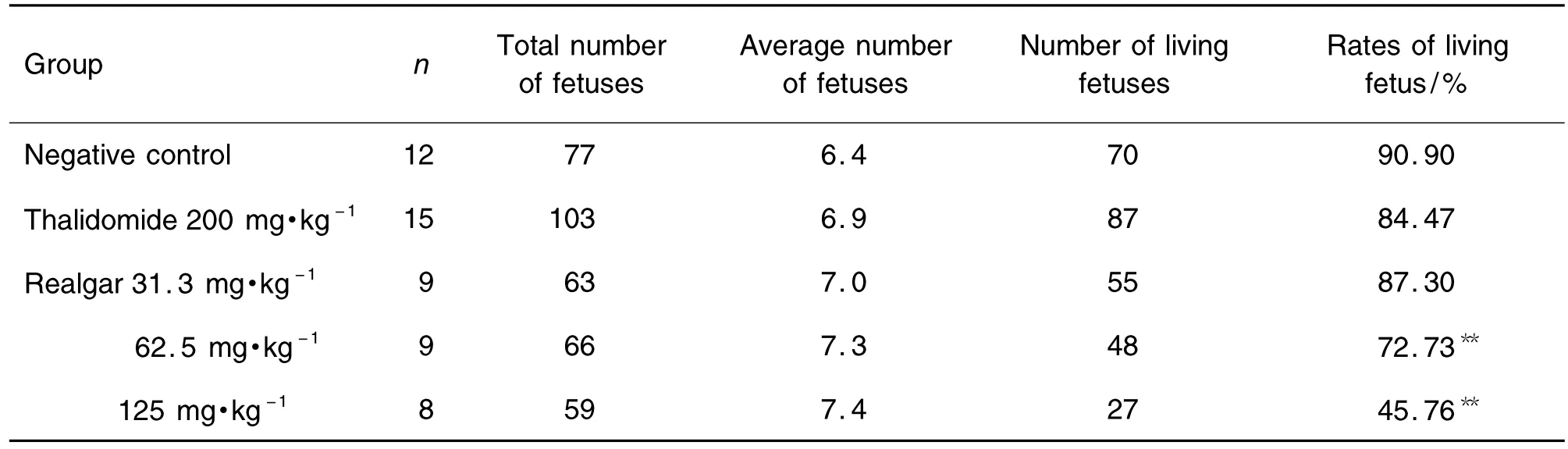
Tab.4 Effect of realgar on average numbers of fetuses and living fetuses in pregnant rabbits
2.2.3 雄黄对孕大鼠和孕兔晚期胚胎流失率的影响
如表5所示,与正常对照组比较,雄黄125,250和550 mg·kg-1组孕大鼠着床数、活胎数和晚期胚胎流失率差异无显著意义,而阳性对照环磷酰胺组的晚期胚胎流失率明显升高(P<0.01)。
如表6所示,与正常对照组的9.09%比较,雄黄125 和62.5 mg·kg-1组孕兔晚期胚胎流失率明显升高,且随剂量的增高而显著升高,分别为54.24%和27.27%(P <0.01);阳性对照沙利度胺组及雄黄31.3 mg·kg-1组晚期胚胎流失率虽然升高,但与正常对照组比较差异无显著意义。
2.2.4 雄黄对孕大鼠和孕兔胎仔体质量、顶臀长和尾长的影响
如表7所示,与正常对照组比较,雄黄250和125 mg·kg-1组孕大鼠的胎鼠体质量、顶臀长及尾长指标差异无显著意义,但与正常对照组比较,雄黄550 mg·kg-1组和阳性对照环磷酰胺组的胎鼠体质量、顶臀长、尾长指标均明显降低(P <0.01)。
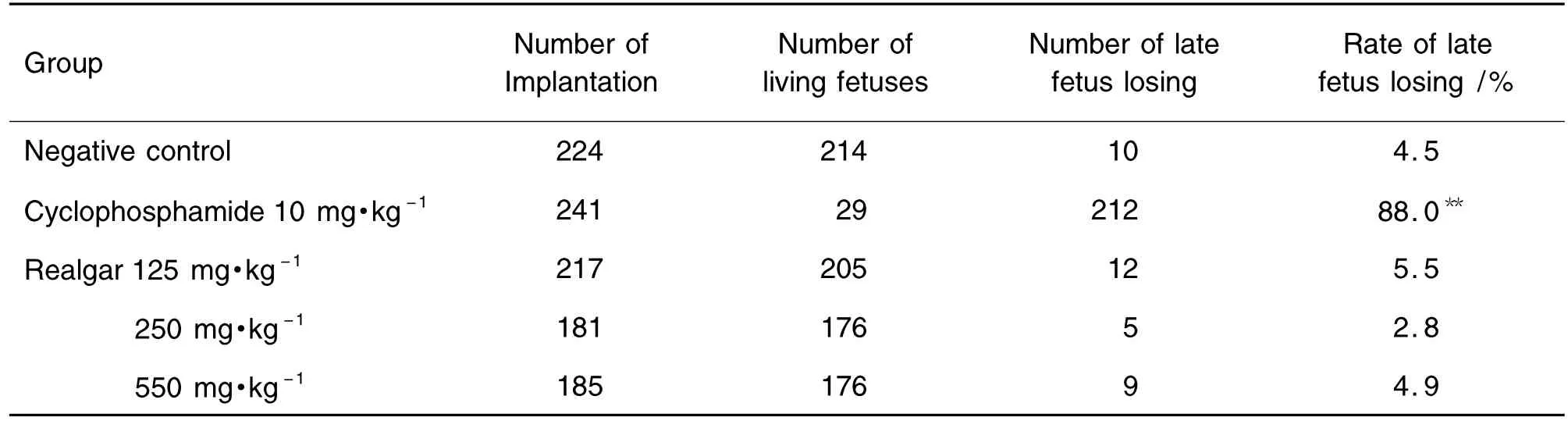
Tab.5 Effect of realgar on late fetus losing rate in pregnant rats

Tab.6 Effect of realgar on late fetus losing rates in pregnant rabbits

Tab.7 Effect of realgar on single fetus mass,tail length and crown-rump length in pregnant rats
如表 8所示,与正常对照组比较,雄黄31.3 mg·kg-1组孕兔胎仔体质量和顶臀长明显增加,雄黄25和125 mg·kg-1组胎仔体质量、尾长和顶臀长无显著差异;阳性对照沙利度胺组胎仔体质量及顶臀长明显升高(P<0.05);尾长明显缩短(P <0.01)。
2.3 雄黄对孕大鼠和孕兔胎仔外观、骨骼和内脏畸形的影响
2.3.1 雄黄对孕大鼠胎仔外观、骨骼和内脏畸形的影响
与正常对照组相比,雄黄 125,250和550 mg·kg-1组孕大鼠胎仔外观、骨骼和内脏,未见有畸形。阳性对照环磷酰胺组虽胎仔外观、骨骼和内脏未见畸形(表9),但胎鼠的肋骨、胸骨、颈椎、胸椎、腰椎和骶椎骨的骨化数均明显减少(资料未显示)(P<0.01),表明环磷酰胺可影响骨骼的发育。
2.3.2 雄黄对孕兔胎仔外观、骨骼和内脏畸形的影响
如表10所示,与正常对照组比较,雄黄31.3,62.5 和 125 mg·kg-1组孕兔胎仔外观、骨骼和内脏,未见有畸形。阳性对照沙利度胺组出现胎仔外观及骨骼畸形,外观畸形率28%,骨骼畸形率19.64%,有显著差异(P <0.01)。

Tab.8 Effect of realgar on single fetus mass,tail length and crown-rump length in pregnant rabbits

Tab.9 Effect of realgar on single number of apparent deformity,skeleton deformity and viscera deformity in pregnant rats

Tab.10 Effect of realgar on single number of apparent deformity,skeleton deformity and viscera deformity in pregnant rabbits
3 讨论
关于雄黄的毒性,目前文献大多局限于对含雄黄复方中成药的一般毒性和毒代动力学研究[4-6],而对雄黄的生殖毒性研究报道不多。在2010年版《中华人民共和国药典》中有24种(4.6%)的中成药含有雄黄,涉及常用药物较多,如小儿清热片、牛黄清心丸、牛黄解毒片和安宫牛黄丸等,因此正确评价雄黄的毒性对于指导临床合理使用这些中成药具有积极的作用。根据毒理学动物选择的原则,证实一种药物的毒性至少应在2种不同种属动物上进行实验,为此,本实验室在完成雄黄对大鼠胚胎-胎仔发育毒性研究的基础上,进一步用兔进行实验,观察比较雄黄对不同种属动物生殖毒性的影响。
雄黄的毒性存在于可溶性砷中,不同产地雄黄的可溶性砷含量各不同[4],为了使研究具有可比性,在实验中统一用产自湖南石门雄黄矿业的批号为H2007052401的雄黄饮片作为供试品,经上海市食品药品检验所检测,该批次雄黄总砷含量95.5%,可溶性砷含量3.32%。
在剂量设计上,2010年版《药典》记载的雄黄剂量为0.05 ~0.1 g,按成人60 kg计算,最高临床剂量约为1.7 mg·kg-1,折算成大鼠等效剂量约为10.5 mg·kg-1。在本研究中,根据预实验结果设计大鼠雄黄实验剂量为550,250和125 mg·kg-1组,根据计算[5]分别相当于人等效剂量的52,24和12倍。在完成大鼠实验后,根据大鼠的实验结果决定兔的实验剂量。
本研究结果显示,孕大鼠并没有表现明显的母体毒性反应,在胚胎/胎仔发育的指标中,除了雄黄550 mg·kg-1组的胎仔体质量、尾长和顶臀长与正常对照组比较差异有极显著意义外,子宫连胎质量、子宫净质量、胎仔总质量、胎盘总质量、平均胎仔数、活胎率和晚期胚胎流失率等指标与正常对照组比较,差异无显著意义;胎仔外观、骨骼和内脏均未见畸形,因而在孕兔的预实验中用雄黄275 mg·kg-1(相当于大鼠550 mg·kg-1组)灌胃给药进行实验。结果孕兔在给药后2~5 d全部死亡,尸体解剖发现雄黄可能对心血管系统有毒性作用。在正式实验中,兔的剂量设计选用大鼠雄黄250 mg·kg-1的等效剂量作为高剂量,设定雄黄 125,62.5和31.3 mg·kg-1,分别相当于人等效剂量的 24,12和6倍。结果发现雄黄125 mg·kg-1组18只孕兔中10 只死亡,雄黄62.5 mg·kg-1组10只孕兔中1只死亡,雄黄31.3 mg·kg-1组11只孕兔中2只死亡。母体毒性反应表现为摄食量减少、消瘦,且与剂量相关。
在孕兔胚胎-胎仔发育指标中,各剂量组的子宫连胎质量、子宫净质量、胎仔总质量、胎盘总质量、胎仔体质量、尾长和顶臀长等指标均随着雄黄剂量的增加而明显降低,但由于孕兔个体差异较大,表现为数据标准差较大,并未显示统计学差异。而雄黄62.5 和 31.3 mg·kg-1组的活胎率、晚期胚胎流失率与正常对照组比较,差异有极显著意义。但是在兔胎仔外观、骨骼和内脏检查中未发现有畸形。
比较孕大鼠和孕兔的实验结果,发现大鼠对雄黄毒性相对不敏感,表现在550 mg·kg-1下(相当于人等效剂量52倍)亦无明显临床毒性表现,雄黄250 和125 mg·kg-1下胚胎-胎仔发育指标与正常对照组比较无明显差异;而兔对雄黄毒性敏感,不仅有明显的临床表现,而且雄黄125和62.5 mg·kg-1组(分别相当于人等效剂量24倍和12倍)的活胎率降低,晚期胚胎流失率升高。目前不清楚孕兔活胎率降低和晚期胚胎流失率的升高的原因,是由于雄黄对孕兔母体的间接毒性引起的还是雄黄对胎仔的直接毒性作用,但对孕大鼠和孕兔胎仔的外观、骨骼和内脏检查结果,可以确认雄黄对大鼠和兔没有明显的致畸作用,这需要更深入的研究。
上述提示证明,雄黄对孕兔具有生殖毒性。这一实验结果印证了中医临床千百年来对雄黄毒性“孕妇禁用”认识的正确性。
[1]Chinese Pharmacopoeia Commission.Chinese Pharmacopoeia(中华人民共和国药典),Volume I[M].Beijing:Chemical Industry Press,2005:307.
[2]Wu WB,Tang JM,Zhu XW,Zhao Y,Jin RM.Studies on the toxicity of cinnabar on pregnant rats and embryo-fetal development[J].J Toxicol(毒理学杂志),2009,23(15):380-383.
[3]Li YM, Wu WB, Fan HT,Huang ZZ,Jiang X,Zhao Y,et al.Rat fertility and early embryo development toxicity of intragastric administration of realgar[J].Chin Pharm J(中国药学杂志),2012,47(24):1990-1994.
[4]Liang AH,Li CY,Wang JH,Xue BY,Li H,Yang B,et al.Toxicity study of realgar[J].China J Chin Mater Med(中国中药杂志),2011,36(14):1889-1894.
[5]Miao JW,Liang SX, Wu Q,Liu J,Sun AS.Toxicology evaluation of realgar-containing niu-huang-jie-du pian as compared to arsenicals in cell cultures and in mice[J].ISRN Toxicol,2011,2011:250387.
[6]Li CY,Liang AH,Wang JH,Xue BY,Li H,Yang B,et al.Arsenic accumulation following realgar administration in rats[J].China J Chin Mater Med(中国中药杂志),2011,36(14):1895-1900.
[7]Gu JJ,Huang ZZ,Gu YM,Tang JM,Xia J,Wang MB,et al.Soluble arsenic,valence arsenic and their acute toxicity in mice[J].Chin J Exp Tradit Med Form(中国实验方剂学杂志),2011,17(8):230-233.
[8]Huang JH,Huang XH,Chen ZY,Zheng QS,Sun RY.Dose conversion among different animals and healthy volunteers in pharmacological study[J].Chin J Clin Pharmacol Ther(中国临床药理学与治疗学),2004,9(9):1069-1072.
