β-氯氰菊酯对斑马鱼胚胎的发育毒性
2013-11-12徐永学刘丽丽闫艳春
徐永学,刘丽丽,王 健,闫艳春
(中国农业科学院研究生院生物学教研室,北京 100081)
拟除虫菊酯类(pyretbroids)农药是由国外公司于20世纪70年代开发的一类新型高效仿生杀虫剂,被誉为杀虫剂历史上的第三个里程碑;因其具有高效、安全、杀虫谱广、低残留等特点,被广泛用于农业生产。近年来,拟除虫菊酯类杀虫剂发展十分迅速,产量已占据全世界杀虫剂市场的30%[1],并被我国列入替代高毒农药的理想品种。
一种高效氯氰菊酯β-高效氯氰菊酯(乙体氯氰菊酯,beta-cypermethrin)属Ⅱ型拟除虫菊酯类成农药,化学名为(R,S)-α-氰基-3-苯氧基苄基(1R,3R)-3-(2,2-二氯乙烯基)-2,2-二甲基环丙羧酸酯,化学式为C22H19Cl2NO3,结构式见图 1[2],是氯氰菊酯经差向异构得到的两对活性较高的对映体[3]。因其生产工艺简单、生产成本低和药效更高以及对哺乳类动物毒性小等优点,在我国已占据了拟除虫菊酯类农药市场份额的50%以上[4]。但由于β-氯氰菊酯对鱼类具有高毒性,在许多国家其用量受到严格控制,如欧盟等国家都制定了最大残留量标准。
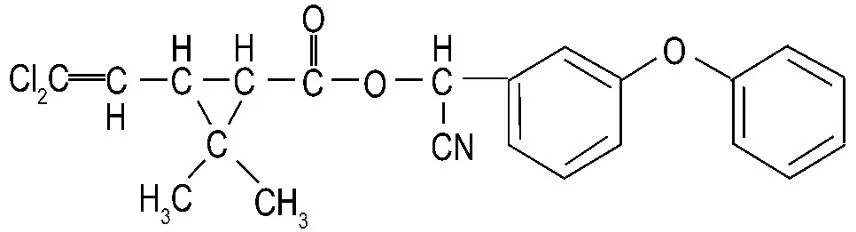
Fig.1 Chemical structure of beta-cypermethrin.
斑马鱼是一种小型热带淡水鱼,基因与人类基因的相似度达到87%,发育过程、器官构造、生理功能、基因结构等都与哺乳类动物非常相近。作为一种新的模式脊椎动物已被广泛用于毒理学的研究中,经济合作与发展组织在1996年将斑马鱼胚胎发育方法列入测定单一化学毒性的标准方法之一,并制定了详细的操作指南。斑马鱼胚胎应用于毒理学研究有诸多优点:体外受精,体外发育而且具有光学透明性,光学显微镜可穿透其组织,观察者可清楚地看到各个发育阶段,毒理测试时可方便评价毒理学终点;发育迅速,测试周期短,一般不超过1周即可完成;成鱼繁殖能力强,一条雌鱼一般每次可产卵100~300枚,每周可产卵1次,样本数可以很大,以确保统计学意义上的显著性;成鱼体型小,易于饲养管理,成本低。此外,最大优势在于有丰富的毒性反应指标(致死、亚致死、致畸)可供观察和分析[5],因此正逐步替代传统成鱼用于急性毒性实验等[6]。
本研究以斑马鱼胚胎为模型,观察β-氯氰菊酯暴露所导致的斑马鱼胚胎发育毒性,补充此类农药对胚胎发育毒性数据的短缺,为制定更加完善的环境评价标准及风险管理提供毒理学依据。
1 材料与方法
1.1 药物和仪器
β-氯氰菊酯,纯度>99%,由中国广东立威化工有限公司提供;丙酮,分析纯,中国北京化工厂;一次性培养皿和巴斯特吸管,中国江苏省海门市昊远实验仪器厂;LRH-250生化培养箱,中国上海一恒科技仪器有限公司;CKX41倒置显微镜,日本奥林巴斯公司;XMTD-6000电热恒温水浴锅,中国北京六一仪器厂;TH-300梯度混合器,中国上海沪西分析仪器厂有限公司;JPBJ-608型便携式溶解氧分析仪和PHS-3D雷磁pH计,中国上海精密科技仪器有限公司。
1.2 胚胎培养液
胚胎培养液即 Holt缓冲液,配方如下(g):NaCl 3.5,KCl 0.05,NaHCO30.025,CaCl20.1,用去离子水补至1 L。
1.3 斑马鱼的饲养
实验用鱼为AB品系斑马鱼,亲本斑马鱼由北京大学生命科学学院遗传学与发育生物学研究中心赠送。后经本实验室繁殖扩大饲养,至6月龄性成熟能够稳定产卵,体长4.0~5.0 cm,自然死亡率<0.5%。
饲养方案按照文献[7]进行,依据文献[8]对发育阶段分期。雌雄鱼分开饲养,光周期严格控制光照/黑暗14 h∶10 h,水温控制在 27.5~28.5℃,电导率为460~500 μS·cm-1,pH 6.75~7.25,溶氧>6.0 mg·L-1。每天早、中、晚定时投喂 3 次新鲜孵化的丰年虫无节幼体,并及时清理残食废物,每周检测水质以保证各参数稳定。
1.4 斑马鱼的交配与收卵
在交配产卵的前一天晚上,选择体型健壮、游动灵活的健康成年斑马鱼于专用交配盒内,亲鱼雌雄分开且比例为1∶1或1∶2,为保证水温维持在28.5℃,将配鱼缸置于水浴锅内。第二天早晨给予光照,抽隔板后30 min内完成交配产卵。根据Schulte和Nagel[6]的方法收集鱼卵。用巴斯特吸管将鱼卵收集于一次性培养皿中,用新鲜的养鱼水清洗数次以除去未受精卵、粪便等残留物,然后转移至光照生化培养箱,温度28.5℃,发育至受精后3 h(3 hours post-fertilization,3 hpf)左右在倒置显微镜下挑选出正常分裂的鱼卵,进行毒性实验。
1.5 β-氯氰菊酯的毒性观察
由于β-氯氰菊酯在空气、阳光下及在中性及微酸性介质中相对比较稳定,不易挥发,不易发生水解、光解等反应,所以采用换水式对斑马鱼胚胎进行毒性实验。为了排除未受精卵及先天发育异常的受精卵对毒性评价的干扰,确保对照组异常卵的发生率小于3%,选择在3 hpf时(囊胚期)开始染毒。选用一次性培养皿进行实验,每个培养皿做一个浓度,放入30枚鱼卵和40 ml溶液,β-氯氰菊酯0.05,0.1,0.15,0.2,0.6,1 mg·L-1,以及空白对照和助溶剂对照。为保证每个β-氯氰菊酯溶液浓度的准确性,开始染毒前先将鱼卵小心的转移到培养皿中,尽量去除水分之后再分别加入不同浓度的受试物溶液和对照液。然后将各培养皿迅速转移到生化培养箱中,温度恒定在28.5℃。显微镜下进行观察直至96 hpf,期间及时清除死亡的胚胎,并记录现象。
用丙酮作溶剂配制 β-氯氰菊酯 0.1 kg·L-1储液,然后用培养液Holt缓冲液稀释配成不同浓度的β-氯氰菊酯溶液,丙酮浓度不超过1%。β-氯氰菊酯溶液在实验当天临时配用,实验过程中每12 h更换一半受试物溶液,以保证溶液中各参数的稳定。
1.6 统计学分析
2 结果
2.1 β-氯氰菊酯对斑马鱼形态学的影响
与正常对照组比较,丙酮对照组斑马鱼胚胎在整个观察期(96 hpf)内发育进程非常同步且未观察到任何毒性反应,而 β-氯氰菊酯 0.05,0.1,0.15,0.2,0.6 和1 mg·L-1组胚胎在24 hpf以前形态上未观察到明显异常,从48 hpf以后表现出不同程度的毒性反应症状,如体轴弯曲、心包囊肿等(图2D2-E3);β-氯氰菊酯0.2,0.6 和1 mg·L-1组的部分胚胎在48 hpf即有明显体轴弯曲畸形反应(图2D2),β-氯氰菊酯0.05,0.1 和0.15 mg·L-1组在72 hpf才逐渐出现(图2C3);而心包囊肿在48 hpf时未观察到,至 72 hpf时除 β-氯氰菊酯0.05 mg·L-1组外都开始大量出现(图2D3);并且在72 hpf以后β-氯氰菊酯组胚胎全部沉于容器底部呈抽搐状态失去游动能力,而正常对照组胚胎孵化脱膜后呈悬状贴在容器壁上,在72 hpf时已能够自由游动。此外,与正常对照组相比,β-氯氰菊酯0.2,0.6 和1 mg·L-1组幼鱼在72 hpf时胸鳍发育受到严重抑制且黑色素减少体色偏黄(图2E3)。

Fig.2 Effect of beta-cypermethrin on morphological development of zebrafish embryos at 24 hpf,48 hpf and 72 hpf.A:normal control;B:acetone control;C,D and E:beta-cypermethrin 0.1,0.2 and 1 mg·L -1groups,respectively.1 -3:24,48 and 72 hpf,respectively.Arrows indicate pericardial edema in response to beta-cypermethrin stress.
2.2 β-氯氰菊酯对斑马鱼24 hpf自主抽动的影响
斑马鱼胚胎发育至24 hpf时尾部表现出强烈的抽动。图3结果显示,正常对照组胚胎为(0.72±0.19)min-1,β-氯氰菊酯1 mg·L-1组胚胎为(3.83±1.07)min-1。此外,与正常对照组相比,β-氯氰菊酯0.05,0.1 和0.15 mg·L-1组平均胚胎抽动次数无太大变化但波动程度明显增强,而β-氯氰菊酯0.2,0.6 和1 mg·L-1组胚胎抽动次数及剧烈程度随着β-氯氰菊酯组浓度的升高都显著增强,且类似抽搐状。
2.3 β-氯氰菊酯对斑马鱼48 hpf孵化率的影响
斑马鱼胚胎从48 hpf开始脱膜孵化,是胚胎发育过程的一个重要时期,常被用于毒性评价的重要毒理学终点,诸多文献报道了孵化率与毒性之间的关系[9]。本实验中,发现正常对照组胚胎48 hpf孵化率约为(15.5±1.2)%,β-氯氰菊酯 1 mg·L-1组为(98.9±4.3%)%。即β-氯氰菊酯加快了斑马鱼胚胎的孵化,且 β-氯氰菊酯 0.15,0.2,0.6和1 mg·L-1组的胚胎48 hpf时几乎全部孵化完成,而β-氯氰菊酯0.05,0.1 和0.15 mg·L-1组胚胎的孵化率呈现清晰的剂量依赖关系,即在一定浓度范围内,β-氯氰菊酯浓度与孵化率呈正相关性趋势(r=0.92,P<0.05)(图4)。
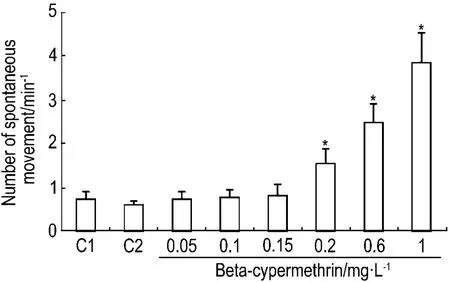
Fig.3 Effect of beta-cypermethrin on counts of spontaneous movements of zebrafish embryos at 24 hpf.C1:normal control;C2:acetone control.±s,n=3.*P<0.05,compared with normal control group.
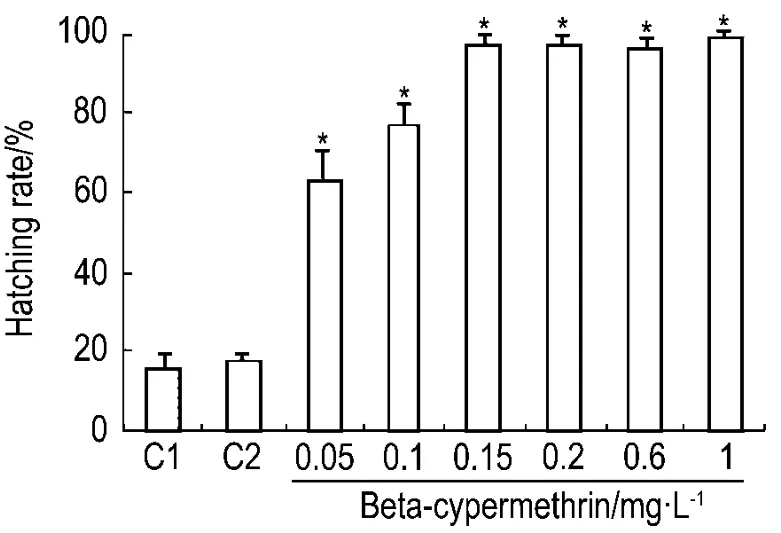
Fig.4 Effect of beta-cypermethrin on percentage of hatching in zebrafish embryos at 48hpf.C1:normal control;C2:acetone control.±s,n=3.*P<0.05,compared with normal control group.
2.4 β-氯氰菊酯对斑马鱼48 hpf心率的影响
心率是斑马鱼胚胎毒性测试实验中一个非常重要的亚致死毒理学终点。正常对照组48 hpf胚胎10 s心脏跳动约30.0次,β-氯氰菊酯组胚胎心率加快达到34.7次,且各β-氯氰菊酯组数值相近,但是72 hpf以后,随着心包囊肿的发生,有些个体心跳明显减弱,血液循环减慢,出现了严重异常。正常对照组胚胎心率与Kimmel等[8]报道的非常一致。
2.5 β-氯氰菊酯对斑马鱼体轴弯曲的影响
图5 结果显示;β-氯氰菊酯 0.05 mg·L-1组在72 hpf和96 hpf畸形率分别是 6.6%和 10%,β-氯氰菊酯1 mg·L-1组分别是97.8%和 100%;同一浓度β-氯氰菊酯,96 hpf胚胎畸形率明显高于72 hpf的畸形率;不同浓度β-氯氰菊酯组之间比较,浓度越高畸形率越高,呈现一定的时间剂量依赖性(r=0.87,P<0.05)。β-氯氰菊酯 0.6 和1 mg·L-1组胚胎在72 hpf时几乎全部畸形且部分个体出现严重的心包囊肿;发育至96 hpf时畸形加剧。
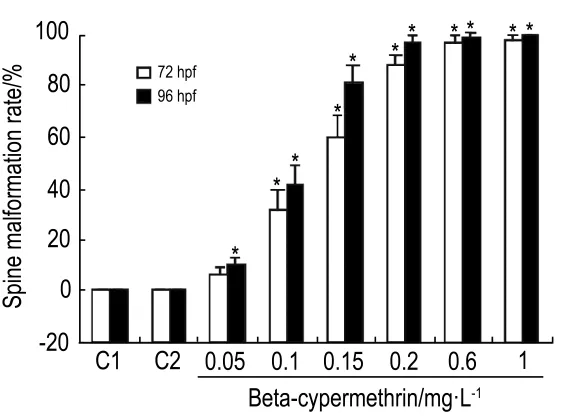
Fig.5 Effect of beta-cypermethrin on cumulative spine malformation rate in zebrafish embryos at 72 hpf and 96 hpf.C1:normal control;C2:acetone control.±s,n=3.*P<0.05,compared with normal control group.
3 讨论
本实验以丙酮作助溶剂,为避免助溶剂丙酮的毒害作用影响,控制β-氯氰菊酯溶液中丙酮浓度不能超过1%,经过多次预实验和观察,最终确立了β-氯氰菊酯浓度:0.05,0.1,0.15,0.2,0.6 和1 mg·L-1。在此浓度范围内 β-氯氰菊酯能够完全溶解,但是未能引起斑马鱼胚胎致死,因此,本研究未探讨β-氯氰菊酯对斑马鱼胚胎的剂量-致死效应关系,而主要对亚致死、致畸毒理学终点进行了观察探讨。
对于毒理学终点的观察,为方便定量与清晰的原则,主要选择了在5个重要且清晰的发育时间点(8,24,48,72和 96 hpf)进行仔细观察,包括24 hpf自主抽动、48hpf孵化率及心率、72和96 hpf色素沉积、体轴弯曲及心包囊肿等,并重点记录了24 hpf自主抽动次数、48 hpf孵化率以及72和96 hpf体轴弯曲个体比例。胚胎发育正常与否的判断主要参考Kimmel等的描述。
Kimmel等发现,斑马鱼自主抽动是由于肌肉系统和运动神经元系统接点发育引起,不受机体控制的活动,是运动神经系统未发育完全的表现。早在2002年,Drapeau等[11]对斑马鱼运动神经网络进行了深入研究,发现这种活动最早起始于14体节时期,至20体节时期达到高峰,随后随着神经系统的完善而逐渐减弱。本实验中,正常对照组斑马鱼胚胎在24 hpf时自主抽动次数平均每分钟不到1次,表明神经系统已发育到相对完善的时期,而β-氯氰菊酯组胚胎活动远强于正常和溶剂对照组,表明神经系统的发育受到抑制,β-氯氰菊酯对斑马鱼胚胎具有很强的神经毒性。
孵化过程是生化与机械力共同作用的结果。生化作用主要依赖孵化酶即Zn-金属蛋白酶对卵膜的降解作用;经酶作用后,胚胎尾部的抽动将卵膜撕破完成孵化过程。因此,对孵化酶或运动能力的毒害作用都会影响斑马鱼胚胎的顺利孵化。据报道能够抑制蛋白酶活性的金属离子如镉和铜等会降低孵化酶的活性,从而导致胚胎孵化延迟[12]。本实验发现,在一定浓度范围内,β-氯氰菊酯加速了胚胎的孵化。综合本实验观察结果推测β-氯氰菊酯可能未导致孵化酶活性降低,而自主抽动程度的加剧促进了卵膜的破裂,进而加速了孵化过程。对于β-氯氰菊酯与孵化酶的详细作用机制本实验未做探究,有待进一步验证。
斑马鱼心血管在20 hpf开始形成,能够收缩但尚未与发育中的血液循环系统相连,发育至30 hpf时心脏分化出心室和心房,36 hpf时开始规律的心跳[13]。正常生长条件下,48 hpf时主要的器官系统完成形态发生并开始破膜孵化,此时心脏功能已相对比较完善,是斑马鱼胚胎发育进程的一个重要转折点。心率容易受外界因素如温度、用药等的影响而加快,但通常会随着外界因素的消除而逐渐恢复正常。本实验中,除用药外其他实验条件完全相同,故斑马鱼胚胎心率的加快必然是由于β-氯氰菊酯暴露所致。有趣的是,β-氯氰菊酯组胚胎心率加快至每10 s 34.7次,且各浓度组数值相近,并未随着β-氯氰菊酯浓度的增大而明显增加,实际上这一心率数值很可能已接近斑马鱼胚胎心率的最大值,很难再有明显的增加。这也在某种程度上表明,在48 hpf之前斑马鱼胚胎可能由于受到卵膜的保护并未因为暴露于β-氯氰菊酯导致严重的心脏功能衰竭,而是通过增加心率加快全身血液的供应,以满足氧气、营养物质等的需要。但是在72 hpf后,β-氯氰菊酯组胚胎出现了不同严重程度的心包囊肿,故综合本实验结果,推断β-氯氰菊酯暴露至48 hpf时,很可能已经导致斑马鱼胚胎心功能不全但未严重衰竭,而在随后发育过程中加剧并引起诸多胚胎出现严重的心包囊肿,心跳微弱和血液循环减慢。
体轴弯曲等畸形是斑马鱼胚胎毒性检测实验中常出现的毒性反应。已有研究表明,四溴联苯醚[14]、四氯二苯并-p-二噁英[15]和铜[16]等都会引起斑马鱼胚胎发育畸形。体轴的弯曲通常是由于体轴肌肉组织损坏,包括肌肉细胞坏死及肌纤维受损,或脊椎骨原件自身发生畸形所致;此外,钙离子通道功能紊乱也会导致脊柱弯曲[17]。本实验中斑马鱼幼鱼体轴弯曲,可能是由于β-氯氰菊酯暴露导致肌肉组织损伤和神经肌肉系统发育受损两方面原因所致,具体机制还需进一步验证。
与其他脊椎动物相似,斑马鱼黑色素细胞由神经嵴发展而来[18]。斑马鱼胚胎发育至24 hpf黑色素开始出现[8]。本实验发现,72 hpf处理组幼鱼黑色素减少体色偏黄,很可能是由于早期神经发育受到抑制所致。
影响拟除虫菊酯类对鱼类毒性作用的因素很多。如鱼的年龄,一般认为斑马鱼胚胎较成鱼相比对外源毒物更为敏感。环境因素如温度也会影响拟除虫菊酯类对动物毒害作用,Weston等[19]发现拟除虫菊酯类对鱼类的毒性作用与温度成反向相关的关系。此外,所含异构体比例不同表现出的毒性作用差别也很大[20]。β-氯氰菊酯作为拟除虫菊酯类农药的一种,具有很强的疏水性,容易被鱼鳃吸附;另外,由于鱼体内缺乏水解拟除虫菊酯类的酶,拟除虫菊酯类在鱼体内的代谢主要靠氧化作用,致使拟除虫菊酯类对鱼类的毒性作用远大于对哺乳动物和鸟类的毒性作用[21]。在96 h观察期内,斑马鱼胚胎孵化完成之前并未出现卵凝结、尾部不延展、无体节和无心跳等致死毒理学终点,只观察到心跳加速,自主抽动强烈;而孵化完成之后逐渐出现了体轴弯曲、心包囊肿和体长较短(未作数据统计)等严重的畸形效应,甚至96 hpf时有些幼鱼只有微弱的心跳而身体已经完全不能动,表现出孵化完成后毒性更强的特征。推测很可能是由于β-氯氰菊酯具有很强的亲脂性,与斑马鱼胚胎卵膜结合,使其不易进入胚胎体内,而孵化后胚胎由于失去了卵膜的保护对化学物质更为敏感。曾有文献认为去卵膜之后能够改善胚胎毒性测试[22]。
动物实验研究表明,拟除虫菊酯类农药对处于发育时期的动物表现出更强的毒性[23]。并且已有报道称孕妇、儿童甚至婴幼儿尿液中含有拟除虫菊酯类农药代谢产物[24]。DeMicco 等[25]通过6 种常见拟除虫菊酯类对斑马鱼胚胎的神经发育毒性,发现拟除虫菊酯类对斑马鱼和哺乳动物引起的神经毒性非常相似且具有很强的神经毒性;而且其自主抽动随着浓度的增加而加剧与本实验的观察一致。Shi等[26]在氯氰菊酯对斑马鱼胚胎幼鱼的毒性研究中采用吖啶橙染色法发现神经系统呈现大量细胞凋亡,并出现体轴弯曲、心包囊肿等毒性反应;Xu等[20]对β-氯氰菊酯4种对映异构体的斑马鱼胚胎致畸毒性分别进行了研究,也有心包囊肿和体轴弯曲等畸形出现,但是未对神经毒性进行探讨。
欧盟等国家规定在谷物、水果和蔬菜中β-氯氰菊酯最大残留量为0.02 mg·L-1;在西红柿、豆荚蔬菜和玉米谷物中最大残留量为0.05 mg·L-1;在黄瓜中最大残留量为0.1 mg·L-1;在杏、莴苣和桃中最大残留量为0.5 mg·L-1,而在我国目前尚未制定β-氯氰菊酯残留限量。本实验中,β-氯氰菊酯0.05 mg·L-1对斑马鱼胚胎暴露20 h既能对神经系统产生严重的损害,暴露至72 hpf时引起体轴弯曲,而 β-氯氰菊酯 0.05 mg·L-1远低于欧盟国家制定的在杏、莴苣和桃中最大残留量0.5 mg·L-1,因此,这一数值可以为制定其在某些食物尤其是水产品中的残留限量提供重要的参考,且应当低于0.05 mg·L-1,确切的安全限量还需大量实验进行验证。此外,孕妇、儿童及婴幼儿应远离暴露有高效氯氰菊酯的环境,杜绝含有其高残留的食品,避免危害的发生。近期国内有学者发现,某地区95%被检孕妇尿中检测出拟除虫菊酯类代谢产物,且暴露水平高于国外相关数据,高暴露组幼儿的发育商显著低于低暴露组幼儿[27]。
综合本实验结果,β-氯氰菊酯对斑马鱼胚胎具有严重的神经毒性,对孵化完成后的幼鱼心脏和体轴等表现出严重的致畸效应并呈现明显的时间剂量依赖性,高浓度下还会严重抑制胚胎发育进程,为深入研究β-氯氰菊酯对斑马鱼胚胎的发育毒性提供了证据和线索。
致谢:感谢北京大学生命科学学院张博教授提供实验材料及斑马鱼饲养技术指导;感谢刘丽丽、王健、史延华和宋金龙在实验和本文写作中给予的大力支持与帮助。
[1]Köprücü K,Aydìn R.The toxic effects of pyrethroid deltamethrin on the common carp(Cyprinus carpio L.)embryos and larvae[J].Pestic Biochem Physiol,2004,80:47-53.
[2]Liu L,Hu JX,Wang H,Chen BJ,He Z,Xu LC.Effects of beta-cypermethrin on male rat reproductive system[J].Environ Toxicol Pharmacol,2010,30(3):251-256.
[3]Li WY,Yang HL,Jiang X,Zhang LN.Research progress on reproductive toxicity of cypermethrin and beta-cypermethrin[J].J Environ Health(环境与健康杂志),2010,27(7):652-654.
[4]Zhang L,Gao XW,Liang P.Beta-cypermethrin resistance associated with high carboxylesterase activities in a strain of house fly,Musca domestica(Diptera:Muscidae)[J].Pestic Biochem Physiol,2007,89:65-72.
[5]Lange M,Gebauer W,Markl J,Nagel R.Comparison of testing acute toxicity on embryo of zebrafish,Brachydanio rerio and RTG-2 cytotoxicity as possible alternatives to the acute fish test[J].Chemosphere,1995,30(11):2087-2102.
[6]Schulte C,Nagel R.Test acute toxicity in the embryo of zebrafish,Brachydanio rerio as an alternative to the acute fish test:preliminaryresults[J]. ATLA, 1994, 22:12-19.
[7]Westerfield,M. The Zebrafish Book.A Guide for the Laboratory Use of Zebrafish(Danio rerio)[M].4th ed.Eugene:University of Oregon Press,2000.
[8]Kimmel CB,Ballard WW,Kimmel SR,Ullmann B,Schilling TF.Stages of embryonic development of the zebrafish[J].Dev Dyn,1995,203(3):253-310.
[9]Fraysse B,Mons R,Garric J.Development of a zebrafish 4-day embryo-larvalbioassay to assess toxicity of chemicals[J].Ecotoxicol Environ Saf,2006,63(2):253-267.
[10]Hallare A,Nagel K,Köhler HR,Triebskorn R.Comparative embryotoxicity and proteotoxicity of three carrier solvents to zebrafish(Danio rerio)embryos[J].Ecotoxicol Environ Saf,2006,63(3):378-388.
[11]Drapeau P,Saint-Amant L,Buss RR,Chong M,McDearmid JR,Brustein E.Development of the locomotor network in zebrafish[J].Prog Neurobiol,2002,68(2):85-111.
[12]Servizi JA,Martens DW.Effects of selected heavy metals on early life of sockeye and pink salmon[J].In Pac Salmon Comm Prog Rep,1978,39:1-26.
[13]Barrionuevo WR, Burggren WW. O2consumption and heart rate in developing zebrafish(Danio rerio):influence of temperature and ambient O2[J].Am J Physiol,1999,276(2 Pt 2):R505-R513.
[14]Lema SC, Schultz IR, Scholz NL,Incardona JP,Swanson P.Neural defects and cardiac arrhythmia in fish larvae following embryonic exposure to 2,2',4,4'-tetrabromodiphenyl ether(PBDE 47)[J].Aquat Toxicol,2007,82(4):296-307.
[15]Yamauchi M, Kim EY, Iwata H, Shima Y,Tanabe S.Toxiceffects of2,3,7,8-tetrachlorodibenzo-p-dioxin(TCDD)in developing red seabream(Pagrus major)embryo:an association of morphological deformities with AHR1,AHR2 and CYP1A expressions[J].Aquat Toxicol,2006,80(2):166-179.
[16]Johnson A,Carew E,Sloman KA.The effects of copper on the morphologicaland functionaldevelopmentof zebrafish embryos[J].Aquat Toxicol,2007,84(4):431-438.
[17]Cheng SH, Wing KWA, Hung SC,Shiu SWR.Cellular and molecular basis of cadmium-induced deformities in zebrafish embryos[J].Environ Toxicol Chem,2000,19:3024-3031.
[18]Raible DW,Eisen JS.Restriction of neural crest cell fate in the trunk of the embryonic zebrafish[J].Development,1994,120(3):495-503.
[19]Weston DP,Asbell AM,Hecht SA,Scholz NL,Lydy MJ.Pyrethroid insecticides in urban salmon streams of the Pacific Northwest[J].Environ Pollut,2011,159(10):3051-3056.
[20]Xu C,Tu W,Lou C,Hong Y,Zhao M.Enantioselective separation and zebrafish embryo toxicity of insecticide beta-cypermethrin[J].J Environ Sci(China),2010,22(5):738-743.
[21]Demoute JP.A brief review of the environmental fate and metabolism of pyrethroids[J].Pestic Sci,1989,27:375-385.
[22]Henn K, Braunbeck T. Dechorionation as a tool to improve the fish embryo toxicity test(FET)with the zebrafish(Danio rerio)[J].Comp Biochem Physiol C Toxicol Pharmacol,2011,153(1):91-98.
[23]Sheets LP.A consideration of age-dependent differences in susceptibility to organophosphorus and pyrethroid insecticides[J].Neurotoxicology,2000,21(1-2):57-63.
[24]Lu C,Barr DB,Pearson MA,Walker LA,Bravo R.The attribution of urban and suburban children's exposure to synthetic pyrethroid insecticides:a longitudinal assessment[J].J Expo Sci Environ Epidemiol,2009,19(1):69-78.
[25]DeMicco A, Cooper KR, Richardson JR, White LA.Developmental neurotoxicity of pyrethroid insecticides in zebrafish embryos[J].Toxicol Sci,2010,113(1):177-186.
[26]Shi X,Gu A,Ji G,Li Y,Di J,Jin J,et al.Developmental toxicity of cypermethrin in embryo-larval stages of zebrafish[J].Chemosphere,2011,85(6):1010-1016.
[27]Qi XJ, Zheng ML, Wu CH, Chang XL, Wang GQ,Lu DS,et al.Impact of prenatal pyrethroid exposure on neurodevelopment of one-year old infants[J].J Hygiene Res(卫生研究),2011,40(6):693-697.
