敌敌畏对斑马鱼的遗传毒性和生殖毒性作用表现
2013-11-12蒲韵竹王丽星陈怡君钟玉绪付爱玲赵宝全
蒲韵竹,王 卓,王丽星,陈怡君,钟玉绪,李 前,付爱玲,赵宝全
(1.西南大学药学院,重庆 400715;2.军事医学科学院毒物药物研究所,北京 100850)
农副产品上残留的农药,具有长期残留性和生物蓄积性等特点[1],其被食用后虽不会导致急性中毒,但也会造成人类和动物有机体的损伤,甚至导致人类和动物的不孕不育,或者对后代产生影响[2]。敌敌畏是一种高效广谱的有机磷类农药,其生殖毒性和遗传毒性已有一些报道。Dirican等[3]发现敌敌畏可导致雄性小鼠精囊质量减轻,精子活力降低。Zhang等[4]发现高浓度敌敌畏对鲫鱼精子运动显著缩短,精子轨迹为曲线或原地不动。同时Farooq等[5]发现非致死浓度下敌敌畏可导致雌性鲤鱼性腺指数降低。Wang等[6]研究发现敌敌畏可导致中国仓鼠卵巢细胞染色体的畸变。Nan等[2]研究发现非致死浓度下敌敌畏可导致泥鳅红细胞细胞核出现微核。
斑马鱼与人类基因组相似度高达87%,与人类有着相似的毒性特征和信号传导通路,同时斑马鱼各器官和组织在解剖学、生理学和分子水平上已被证实与哺乳动物类似,这意味着利用斑马鱼所得毒性实验结果在多数情况能适用于人类[7]。斑马鱼遗传背景清晰,对有害物质非常敏感[8],可用于评价化合物毒性,已被国家标准化组织、美国环境保护局、经济合作与发展组织(OECD),以及中国农业部和环保部等各国和国际标准组织认定的生态毒性测试的标准鱼类[9],斑马鱼被称为是21世纪新型毒性评价模型[10],目前已有研究者将斑马鱼用于评价纳米材料的亚急性毒性[11]。本实验以斑马鱼为动物,敌敌畏为药物,研究斑马鱼用于评价生殖毒性和遗传毒性可靠性,旨在建立斑马鱼亚急性条件下的生殖毒性和遗传毒性的快速评价模型,为农药及环境化合物毒性评价提供有效依据。
1 材料与方法
1.1 药品与仪器
敌敌畏乳油,质量分数77.5%,购自天津市华宇农药有限公司;姬姆萨染色液(Giemsa),购自国药集团公司;碘化丙啶(propidium iodide,PI),购自Sigma公司;SYBR-14,购自Invitrogen公司;Tricaine methane sulfonate(MS-222),为北京爱普华美生物科技有限公司产品。荧光显微镜:日本Olympus;AEG-120精密电子天平:日本岛津;斑马鱼循环水养殖系统:北京爱生科技有限公司。
1.2 动物及分组给药
AB系斑马鱼由北京大学生命科学学院提供,本实验室循环养殖系统驯养,雄雌各半,体长25~35 mm。循环养殖水根据 Brand等[12]的方法配制:每1000 L去离子水中含75 g碳酸氢钠,18 g海盐和8.4 g硫酸钙,水温(28~29)℃,pH 值7.2左右,总硬度 62 mg·L-1(以 CaCO3计),电导率485 μS。光照/黑暗周期为 14 h∶10 h。斑马鱼每日喂食2次人工孵化的卤虫幼体。
根据敌敌畏对斑马鱼急性毒性实验,其96 h LC50为19.18 mg·L-1,在此基础上,设定敌敌畏 0,0.97,2.92,4.87 mg·L-1组,每组随机选取大小相当的斑马鱼成鱼24尾(雄雌各半),采用换水实验,2 L塑料盒中放6尾鱼(雄雌分开),每24 h更换一次实验溶液,连续染毒7和14 d。所有组斑马鱼每2 d喂食1次。
1.3 性腺指数测定
分别于敌敌畏持续染毒7 d和14 d,各浓度组随机选取12尾斑马鱼(雄雌各半),用0.01%的MS-222麻醉剂,麻醉约2 min后,将鱼放入水中冲洗,用吸水纸吸去体表的水,电子天平称量其体质量。用大头针将麻醉后的雄鱼或雌鱼固定在塑料泡沫板上,在体式显微镜下,用解剖剪将其腹腔剪开,用镊将精囊或卵巢取出,放入1.5 ml离心管中称质量。计算性腺指数[13]。性腺指数=性腺质量(g)/体质量(g)×100。
1.4 雄性班马鱼精子质膜完整性检测
精囊称质量后,按照1∶20加入HBSS缓冲液〔(g·L-1)NaCl 8.0,KCl 0.4,CaCl2·2H2O 0.16,MgSO40.01,Na2HPO4·12H2O 0.15,KH2PO40.06,NaHCO30.35,C6H12O61.0,pH 7.5)中,用枪头充分破碎精囊,待精子充分释放后将精囊膜挑出,制成精子悬液。取 100 μl精子悬液到0.5 ml EP管中,加入 1 μl SYBR-14染料(终浓度为100 nmo·lL-1),4℃避光培育5 min,取出再加入10 μl PI(终浓度为 12 μmol·L-1),再 4℃避光培育5 min[14]。利用SYBR-14/PI对斑马鱼精子进行染色,在荧光显微镜下观察精子质膜完整性。活精子呈绿色荧光,死精子呈红色荧光。用10×20倍显微镜观察并拍照,用Image-Pro Plus6.0软件统计精子总数量及SYBR-14染色精子数量,并计算精子质膜完整性百分比。每尾鱼观察至少3个视野。精子质膜完整性(%)=SYBR-14染色精子数/精子总数×100%。
1.5 血细胞微核实验测定微核率
分别于敌敌畏持续染毒7和14 d后,各浓度组随机选取8尾斑马鱼(雄雌各半),断尾取血,制成血涂片,涂片晾干后,甲醇固定15 min,用pH 6.8磷酸缓冲液稀释的Giemsa液(体积比9∶1)染色10 min,pH 6.8磷酸缓冲液冲洗,晾干。血涂片置于10×100显微镜下观察、照相,并用Image-Pro Plus6.0软件进行统计,每张涂片随机观察2000个细胞,计算微核率(‰)。
1.6 统计学分析
2 结果与分析
2.1 敌敌畏对斑马鱼性腺指数的影响
由表1可见,与正常对照组相比,持续染毒7 d后,敌敌畏2.85 和4.65 mg·L-1组的雄性和雌性斑马鱼体质量和雌鱼性腺质量显降低(P<0.01),敌敌畏4.65 mg·L-1组雌鱼性腺指数显著降低(P<0.01)。持续染毒14 d 后,敌敌畏0.95,2.85和4.65 mg·L-1组雄性和雌性斑马鱼体质量和性腺质量及雌性性腺指数均小于正常对照组(P<0.01),提示随着染毒浓度的增加,雌雄两性斑马鱼体质量和性腺质量显著降低。在同一浓度下,敌敌畏0.95,2.85 和4.65 mg·L-1染毒14 d,雌鱼性腺指数明显低于染毒7 d组(P<0.01)。提示敌敌畏对斑马鱼体质量和性腺质量有显著影响。
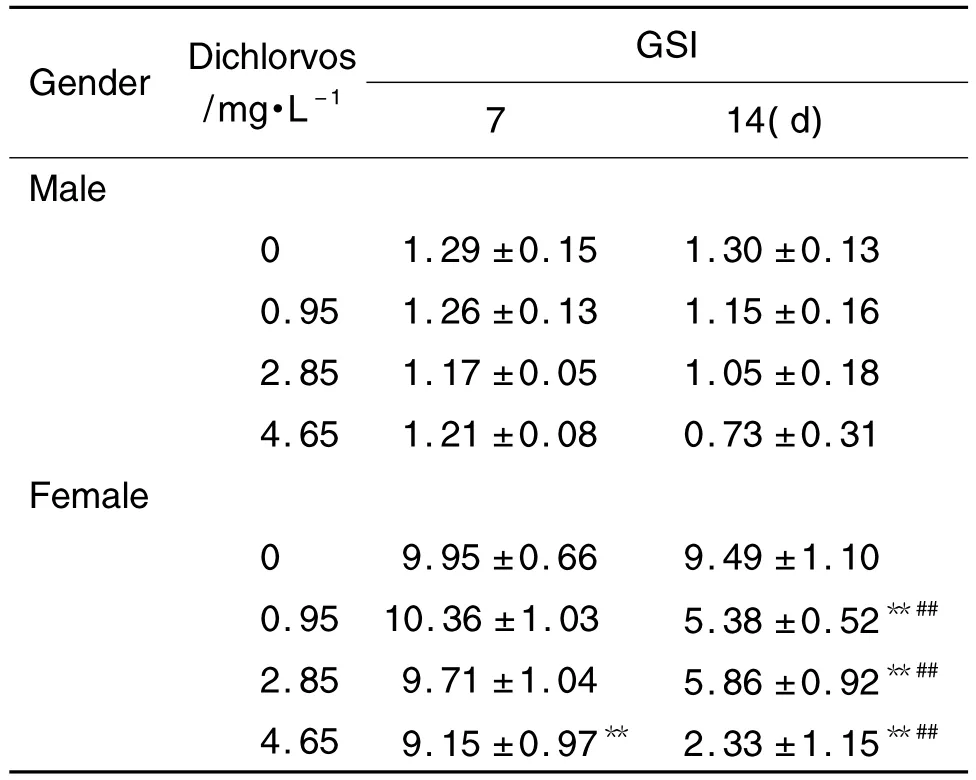
Tab.1 Effect of dichlorvos on gonadosomatic index(GSI)in zebrafish
2.2 敌敌畏对雄性斑马鱼精子数量及精子质膜完整性影响
由表2可见,与正常对照组相比,持续染毒7 d,敌敌畏4.65 mg·L-1组雄性斑马鱼的精子总数显著减少(P<0.01),持续染毒 14 d,敌敌畏 0.95,2.85 和 4.65 mg·L-1组精子总数显著减少(P<0.01)。敌敌畏2.85 和4.65 mg·L-1染毒14 d 后精子总数明显低于同浓度染毒7 d组(P<0.01)。
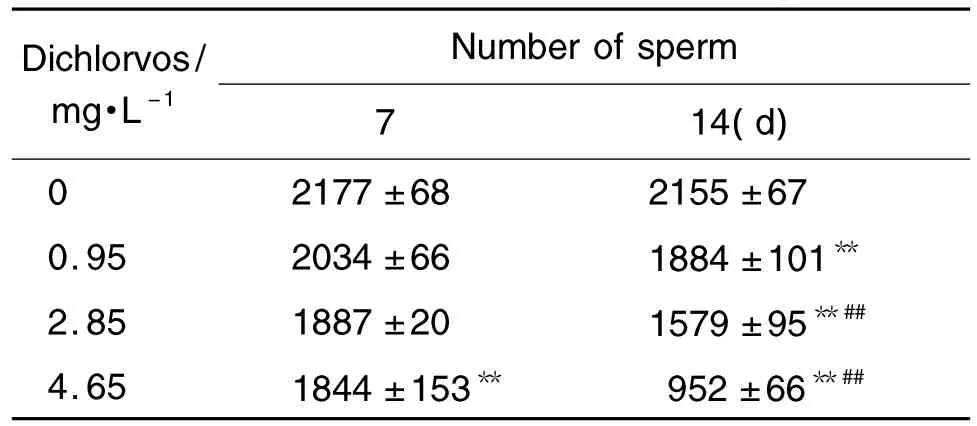
Tab.2 Effect of dichlorvos on number of sperm
表3结果显示,与正常对照组相比,敌敌畏2.85和4.65 mg·L-1染毒 7 d,雄性斑马鱼精子质膜完整率显著降低(P<0.01);持续染毒14 d,敌敌畏0.95 mg·L-1染毒组精子质膜完整率也显著降低(P<0.01)。相同染毒浓度,染毒14 d精子质膜完整率显著低于染毒7 d组(P<0.01)。
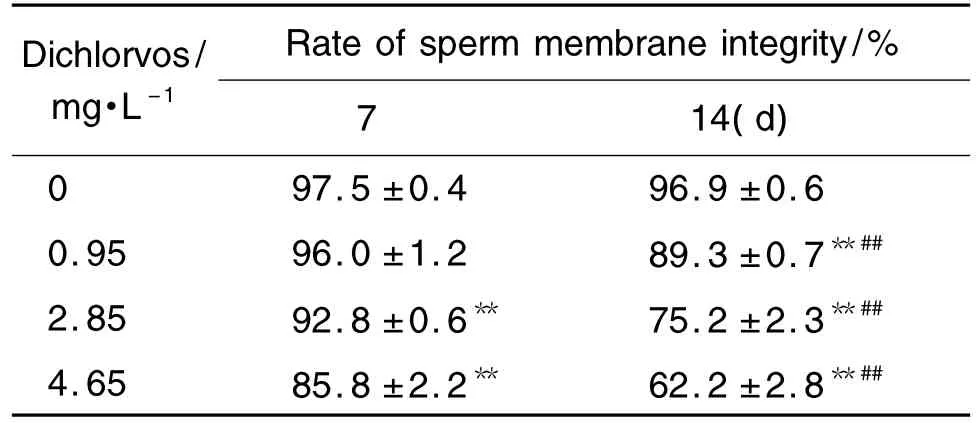
Tab.3 Effect of dichlorvos on sperm membrane integrity of male zebrafish
2.3 敌敌畏对斑马鱼血细胞细胞核的影响
斑马鱼红细胞除形成微核以外还形成核内空泡、核质外凸等异常现象。敌敌畏对斑马鱼红细胞微核率结果如表4所示。与正常对照组相比,敌敌畏4.65 mg·L-1持续染毒7 d,斑马鱼红细胞微核率显著上升(P<0.01),敌敌畏2.85和 4.65 mg·L-1持续染毒14 d的微核率显著上升(P<0.01),而敌敌畏0.95 mg·L-1组与正常对照组相比无统计学差异。提示敌敌畏毒性随着浓度的增加而变大,同样随着时间的增加毒性也增加。
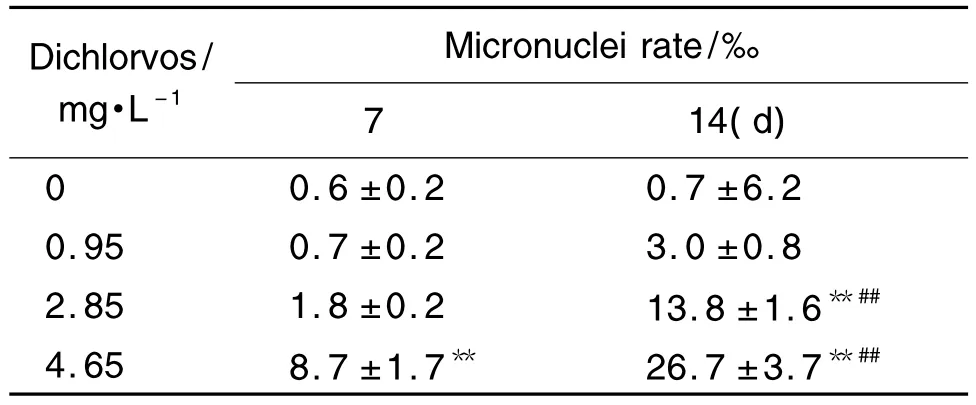
Tab.4 Effect of dichlorvos on micronuclei rate in zebrafish
3 讨论
目前国内评价有机磷农药对鱼类生殖毒性,常采用鲫鱼[4],孔雀鱼[15]和金鱼[16]等鱼类。本实验利用斑马鱼雌性性腺指数及雄性精子膜完整性来评价斑马鱼生殖毒性,旨在建立简单、快速评价有机磷农药生殖毒性的可能性。由于雄鱼用于配子产生的能量少于雌鱼[17],所以常用性腺指数来评价雌鱼的性腺发育与毒性情况[18]。本实验研究发现,敌敌畏染毒后14 d雌鱼性腺指数显著降低。Farooq等观察11月份到次年4月份期间敌敌畏非致死浓度下对雌性鲤鱼卵巢指数的影响,发现随观察月份的增加,卵巢指数不断增加,4月份的卵巢指数是11月份的3倍,说明鲤鱼的性腺指数不仅与给药浓度有关还与实验时间有关。而斑马鱼可全年产卵,得到的实验结果可不受实验时间影响。雄性生殖精子膜完整性是精子活动力、精子新陈代谢的基础,也是完成与受精过程有关活动的基础[19]。本实验结果显示,敌敌畏能降低雄鱼精子数量,且死亡精子增多;随着浓度及时间的增加,敌敌畏能显著降低雄鱼精子质量,这与Dirican等[3]用小鼠得到敌敌畏影响雄性精子质量结果一致。Zhang等[4]利用鲫鱼精子评价有机磷农药的生殖毒性,但鲫鱼精子体外直接接触有机磷农药的给药方式无法模拟现实情况下染毒方式及作用结果。与鲫鱼相比,采用斑马鱼成本低,个体小,饲养空间小,同时采用精子质膜完整性来评价精子质量,可以在不激活精子的情况下,通过荧光显微镜、荧光染料及图像分析软件,便能简单、快捷的评价化合物对雄性斑马鱼的生殖毒性。
鱼类血细胞微核实验是一种有效的体内遗传毒性检测方式,可用于在线监测水质及环境毒物评价[20]。微核形成可用于的检测染色体异常,是遗传毒性评价的重要依据[21]。常用的鱼类有鲤鱼[22],鲫鱼[23],泥鳅[2]和黄鳝[24]等。本实验选择斑马鱼一方面由于其遗传背景清楚,对于进一步机制研究有一定优势,另一方面斑马鱼的血红细胞体积较大,经吉姆萨染色后,其细胞质和细胞核在显微镜下结构清晰,易于观察微核。正常斑马鱼血细胞多呈椭圆形,其主核位于细胞正中间,主核多数呈卵圆形,少数呈圆形。斑马鱼在敌敌畏处理后,其造血系统的干细胞发生显著的变化,细胞染色体发生断裂而产生的断片或残留的染色体在胞浆内形成微核,斑马鱼红细胞因敌敌畏的诱发出现的核变异中,主要包含了微核和核异常。本实验结果表明,随敌敌畏作用时间和浓度的增加,斑马鱼微核率显著上升。Nan等用敌敌畏6.409 g·L-1染毒泥鳅9 d的微核率为 2.138‰,本实验用敌敌畏4.65 mg·L-1染毒斑马鱼7 d,微核率为8.7‰,并且染毒14 d后微核率升高3倍。虽然泥鳅对敌敌畏敏感,染毒剂量低,但是微核形成率没有斑马鱼高,同时斑马鱼取材方便,剪尾取血后不会死亡,鱼尾可在几天内重新长出,这对于长期研究及监测毒物的遗传毒性研究了提供便利条件。
本实验通过观察敌敌畏对斑马鱼生殖和遗传毒性的作用表现,说明斑马鱼具有做为研究药物及毒物的遗传及生殖毒性作用模型的可能。
[1]Jones KC,de Voogt P.Persistent organic pollutants(POPs):state of the science[J].Environ Pollut,1999,100(1-3):209-221.
[2]Nan P,Xiao Z,Chen JJ,Chang ZJ.Genetics toxicity and physiology toxicity of dichlorovos to Misgurnus anguillicaudatus[J].J Henan Normal Univ(Nat Sci Ed)〔河南师范大学学报(自然科学版)〕,2011,39(5):137-140.
[3]Dirican EK,Kalender Y.Dichlorvos-induced testicular toxicity in male rats and the protective role of vitamins C and E[J].Exp Toxicol Pathol,2012,64(7-8):821-830.
[4]Zhang YB,Hu JH,Li M,Zhou RR,Sun JZ.The sperm motility of Carassius auratus affected by organophosphorus pesticides,dichlorovos[J].J Liaocheng Univ(Nat Sci Ed)〔聊城大学学报(自然科学版)〕,2008,21(3):79-82.
[5]Farooq AM,Ghulam MS,Ulfat J,Javaid IM.Studies on influences of sublethal concentrations of organophosphate pesticide;dichlorvos(DDVP)on gonadosomatic index(GSI)of female common carp,Cyprinus carpio communis[J].Am-Euras J Toxicol Sci,2012,4(2):67-71.
[6]Wang TC,Lin CM,Lo LW.Genotoxicity of methoxyphosphinyl insecticide in mammalian cells[J].Zool Studies,2003,42(3):462-469.
[7]Wang JJ,Xu C,Tu YJ,Fu ZW,Liu WP.Experimental research and application of zebrafish and embryos in toxicology[J].Asian J Ecotoxicol(生态毒理学报),2007,2(2):123-135.
[8]Parng C.In vivo zebrafish assays for toxicity testing[J].Curr Opin Drug Discov Dev,2005,8(1):100-106.
[9]Hill AJ,Teraoka H,Heideman W,Peterson RE.Zebrafish as a model vertebrate for investigating chemical toxicity[J].Toxicol Sci,2005,86(1):6-19.
[10]Sipes NS,Padilla S,Knudsen TB.Zebrafish:as an integrative model for twenty-first century toxicity testing[J].Birth Defects Res C Embryo Today,2011,93(3):256-267.
[11]Ramsden CS,Henry TB,Handy RD.Sub-lethal effects of titanium dioxide nanoparticles on the physiology and reproduction of zebrafish[J].Aquat Toxicol,2013,126:404-413.
[12]Brand M,Granato M,Nüsslein-Volhard C.Keeping and Raising Zebrafish[M].Oxford:Oxford University Press,2002:7-37.
[13]Kingdom T, Allison ME. The Fecundity,gonadosomatic and hepatosomatic indicies of pellonula leonensis in the Lower Nun River,Niger Delta,Nigeria[J].Curr Res J Biol Sci,2011,3(2):175-179.
[14]Klimowicz-Bodys MD,Batkowski F,Ochrem AS,Saviˇc MA.Comparison of assessment of pigeon sperm viability by contrast-phase microscope(eosin-nigrosin staining)and flow cytometry〔SYBR-14/propidium iodide(PI)staining〕〔evaluation of pigeon sperm viability〕[J].Theriogenology,2012,77(3):628-635.
[15]Shi QY,Ru SG,Bing X.Effect of the toxicity of monocrotophos on reproductive power of the male guppy,Poecilia reticulate[J].J Safety Environ(安全与环境学报),2007,7(3):4-9.
[16]Fang Y. The reproduction toxicity of monocrotophos on male goldfish,Carassiues auratus(久效磷对雄性金鱼的生殖毒性研究)[D].Qingdao:Ocean University of China,2007:1-2.
[17]Rheman S,Islam ML,Shah MMR,Mondal S,Alam MJ.Observation on the fecundity and gonadosomatic index(GSI)of gray mullet Liza parisa(Ham.)[J].Bio Sci,2002,2(10):690-693.
[18]Patimar R.Rahman Patimar1.Some biological aspects of the sharpnose mullet Liza saliens(Risso,1810)in Gorgan Bay-Miankaleh Wildlife Refuge(the Southeast Caspian Sea).[J].Turk J Fish Aquat Sci,2008,8:225-232.
[19]Grossfeld R,Sieg B,Struckmann C,Frenzel A,Maxwell WM,Rath D.New aspects of boar semen freezing strategies[J].Theriogenology,2008,70(8):1225-1233.
[20]al-Sabti K, Metcalfe CD. Fish micronuclei for assessing genotoxicity in water[J].Mutat Res,1995,343(2-3):121-135.
[21]Liu LB,Wang LL.Application progress of high content analysis in discovery toxicology[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2012,26(6):893-896.
[22]Klobucar GI,Stambuk A,Pavlica M,Serti'c Peri'c M,Kutuzovi'c Hackenberger B,Hylland K.Genotoxicity monitoring of freshwater environments using caged carp(Cyprinus carpio)[J].Ecotoxicology,2010,19(1):77-84.
[23]Cavas T. In vivo genotoxicity evaluation of atrazine and atrazine-based herbicide on fish Carassius auratus using the micronucleus test and the comet assay[J].Food Chem Toxicol,2011,49(6):1431-1435.
[24]Zhang Y,Wang YK.Infection of cadmium to liver and micronucleus rate of red blood cell in mud eel[J].J Shaanxi Univ Technol(Nat Sci Ed)〔陕西理工学院学报(自然科学版)〕,2008,24(3):87-90.
