迈瑞BC5300 型全血细胞分析仪的性能评价
2013-11-11张磊宋清福高素芳刘金碌李军
张磊 宋清福 高素芳 刘金碌 李军
血细胞分析仪是临床检验中的常规检测设备,已有的血细胞分析仪经过维修后或新购置的血细胞分析仪经过运输,其检测性能可能会发生一定的变化。实验室在使用检测系统进行患者标本检测前,从保证检验质量考虑,必须在实验室的具体条件下用实验去证实或确认检测系统的基本分析性能符合临床要求,或和厂商提供的资料一致,才可以将检测系统用于常规检测。我们以ICSH[1]、美国CLSI[2-4]及FDA[5]制定的评价标准以及ISO15189-《医学实验室质量和能力的通用要求》[6]和《卫生部医疗机构临床实验室管理办法》[7]的相关条款的要求,自建检测系统需要进行精密度、方法比对和偏倚评估、线性、携带污染率评价。本文将我院新购置的迈瑞BC5300 型血细胞分析仪进行性能评价结果报告如下。
1 材料与方法
1.1 仪器、试剂与样本待评价仪器:迈瑞BC5300 型血细胞分析仪,配套试剂,校准品和质控品,由深圳迈瑞公司生产;对照仪器:SYSMEX XE5000 型血细胞分析仪,配套试剂,校准品和质控物,由日本SYSMEX 公司生产;样本:我院患者新鲜EDTA-K2 抗凝全血。
1.2 方法按照ICSH[1]、美国CLSI[2-4]及FDA[5]制定的评价标准以及ISO15189-《医学实验室质量和能力的通用要求》[6]和《卫生部医疗机构临床实验室管理办法》[7]相关条款的要求对迈瑞BC5300 型血细胞分析仪的精密度、方法比对和偏倚评估、携带污染率、线性进行评价测定,对迈瑞BC5300 血细胞分析仪进行日常清洗维护,进行本底检查,满足要求[白细胞(WBC)≤0.3×109/L,红细胞(RBC)≤0.03×1012/L,血红蛋白(HGB)≤1 g/L,血小板(PLT)≤10×109/L)]后采用配套校准物按照规范操作规程对血细胞分析仪进行校准,采用配套质控物进行日常室内质量控制。
1.2.1 重复性:根据CLSI EPl5-A 文件[3],每天选取患者新鲜EDTA-K2 抗凝血标本高、中水平各一份,分别连续重复测定11次,重复测定3 d[8],每天测定需自带质控,在2 h 内完成[9]。取2 ~11 次结果分别计算WBC、RBC、HGB、PLT 的CV 值与标准CV 值比较,计算其精密度。
1.2.2方法比对和偏倚评估:根据《卫生部医疗机构临床实验室管理办法》检查表(血液学部分)[6],检验同一项目的不同方法、不同分析系统应定期(至少6 个月)进行结果的比对。参照临床和实验室标准化学会(clinical and laboratory standards institute,CLSI)的《采用病人标本进行方法比对和偏倚评估方案(批准方案)第2 版》(EP9-A2)[2],制定本实验室检测系统间的方法比对操作程序。目前实验室主要使用的血细胞分析仪XE5000,除参加北京市临床检验中心、卫生部临床检验中心的室间质评,还参加Sysmex 公司全球在线质控系统SNCS(Sysmex Network Communication Systems SNCS),且每年进行2 次校准,每开机日做1 次两个水平的室间质控测定。仪器精密度、准确度、抗干挠能力等都优于其他仪器,故用此仪器测定结果做为真值,本仪器做为基准仪器,迈瑞BC5300 为考核仪器。
校准后每天选取新鲜EDTA-K2 抗凝血标本8 例(所选浓度范围应尽可能在考核方法测量范围内均匀分布,参比方法的范围应尽可能满足考核方法的范围要求。标准见表1),于两台血细胞分析仪上进行平行测定,双份标本应变换顺序,如按1 ~8和8 ~1 的顺序重复测定2 次,取其均值为测定值。每批测定需带质控,在2 h 内完成[9]。连续测定5 d,分别计算每个标本每个项目基准仪器测定值和考核仪器测定值差值占基准仪器测定值的百分比对测定结果进行分析。
1.2.3 线性:参照临床和实验室标准化学会(clinical and laboratory standards institute,CLSI)的《定量测量方法线性评价统计学处理方案(批准方案)》(EP6-A),制定本实验室自建检测系统的线性评价操作程序[4]。分别收集高WBC、RBC、HGB、PLT值新鲜全血标本离心浓缩分离得到接近预期上限的高值WBC、RBC、HGB、PLT 标本,以此样本为100%。用稀释液(离心制备同型乏血小板血浆)将浓缩后的血标本分别按90%、80%、70%、60%、50%、40%、30%、20%、10%、5%不同浓度进行稀释,分别从低到高测定不同稀释度的标本,每一份标本用迈瑞BC5300 测定3 次,取其均值为测定值,运用SPSS 软件将其与各稀释度的理论值做线性回归分析。
1.2.4 携带污染率:分别选取检测线性上限和下限附近的WBC、RBC、HGB 和PLT 新鲜EDTA-K2 抗凝全血标本,混匀后连续检测高值标本3 次(H1、H2、H3),马上连续检测低值标本3 次(L1、L2、L3),计算公式为:携带污染率(%)=[(L1-L3)/(H3-L3)]×100%[10,11]。与BC5300 产品说明[6]上规定的携带污染率比较。
2 结果
2.1 本底检查WBC、RBC、HGB 和PLT 的每次本底计数均为0。
2.2 重复性根据卫生部临检中心《血液分析仪校准要求》,BC5300 连续3 d 高、中值样本WBC、RBC、HGB 和PLT 的变异系数均小于仪器规定[12]的要求,显示了较好的重复性和重现性。见表1。
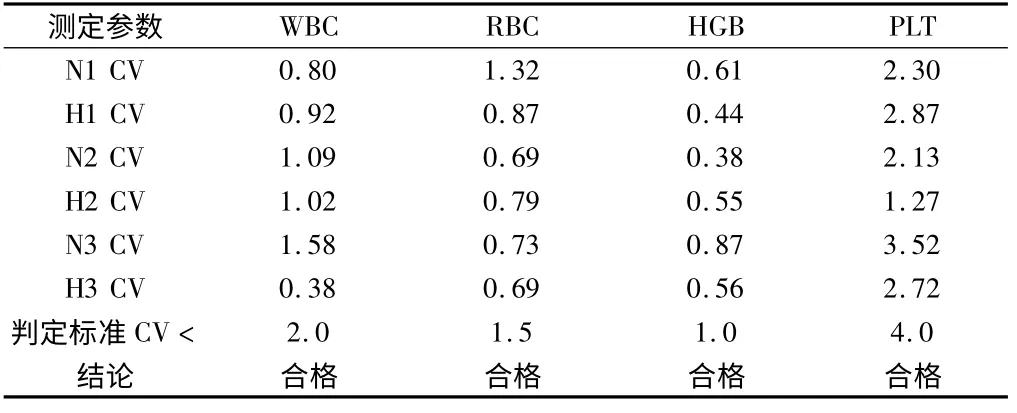
表1 WBC、RBC、HGB 和PLT 的重复性 %
2.3 方法比对和偏倚评估血细胞分析结果的偏差范围依项目不同而不同,采用1/2CLIA'88 标准做为偏差范围。比对的偏差范围在该范围内为满足要求,40 份标本中有32 份满足要求为比对合格,迈瑞BC5300 和sysmex XE5000 对WBC、RBC、HGB 和PLT 的测定具有良好的相关性。见表2。

表2 迈瑞BC5300 和sysmex XE5000 的比对结果 份(%)
2.4 线性WBC、RBC、HGB、PLT 的线性范围分别是0 ~104.3、0 ~10.4、0 ~267.2、0 ~1 103.7,相关系数均>0.99,能满足BC-5300 生产厂商的宣称要求和临床需求。见表3、4。

表3 WBC、RBC、HGB 和PLT 的线性方程

表4 WBC、RBC、HGB 和PLT 的线性范围
2.5 携带污染率WBC、RBC、HGB、PLT 等参数的高低值样本携带污染率检测均符合产品标准要求[6]。见表5、6。
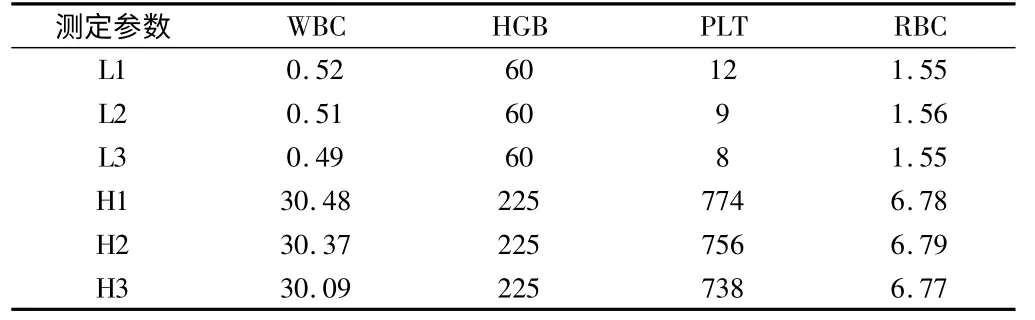
表5 携带污染率数据 %

表6 携带污染率结果
3 讨论
迈瑞BC5300 血细胞分析仪是迈瑞公司自主研发生产的全自动五分类血液细胞分析仪,采用电阻抗法检测RBC 和PLT的数目以及体积分布;采用比色法测量血红蛋白浓度;采用半导体激光流式细胞技术获得WBC 总数和五分类WBC 的分类统计计数[13]。在此基础之上,分析仪计算出其余参数的结果。迈瑞BC5300 全自动血细胞分析仪采用半导体激光系统,通过多角度的激光散射,可以提供细胞的大小、细胞核、细胞颗粒大小等复杂的信息,并结合细胞化学染色技术,准确地把嗜酸性粒细胞和嗜碱性粒细胞区分开来,同时可以筛选各类异常、幼稚细胞,从而实现更精确的五分类检测结果[12]。同时血细胞分析仪仍只能作为全血细胞分析的一种过筛手段,当遇到可疑情况,尤其是在病理条件下,其测定结果并不可靠,需要人工以显微镜复查。迈瑞BC5300 提供了复检提示功能,医院可以在仪器内选择复检规则或者自定义复检规则,仪器可以对相应的异常样本进行提示。同时为保障BC5300 计数结果准确可靠,就必须做好实验室质量管理工作,对操作人员进行培训,提高专业理论知识和操作能力,另外实验室还要保持恒温,做好日常维护保养工作和每天质控工作,并定期对仪器进行校准,以此来保证检验结果的准确性。本试验数据表明该仪器主要检测参数的重复性、仪器可比性、携带污染测试结果良好,CV 值、偏差百分比以及携带污染率均满足产品标准要求;仪器的线性范围较宽,4 个参数的线性范围基本涵盖了临床样本分布的浓度范围;仪器的检测结果与对照机SysmexXE5000 具有良好的相关性。
综上所述,BC5300 性能能达到厂家要求的标准,故障率低,操作简单,其分析功能能满足大中小型医院住院、门诊、急诊临床检验工作,是一种较理想的全自动五分类血液细胞分析仪。
1 ICSH.Guidelines for the evaluation of blood cell analysers including those used for differential leucocyte and retieulocyte counting and cell marker applications.Clin Lab Haemat,1994,16:157-174.
2 CLSI.Method Comparison and Bias Estimation Using Patient Samples;Approved Guideline-Second Edition;Document EP9-A2.940 West Valley Road,Suite 1400,Wayne,PA19087-1898.USA,2002.
3 CLSI.User Verificationof Performance for Precisionand Trueness;Approved Guideline-Second Edition;Document EP15-A2.940West Valley Road,Suite 1400,Wayne,PA19087-1898.USA,2005.
4 CLSI.Evaluation of the Linearity of Quantitative Measurement Procedures:A Statistical Approach;Approved Guideline;Document EP6-A.940WestValleyRoad,Suite1400,Wayne,Pennsylvania19087-1898.USA.2003.
5 Enter for Devices and Radiological Health(CDRH),U.S.Department of Foodand DrugAdministration(FDA).Class lI Special Controls Guidance Document:Premarket Notification for Automated Differential Cell Counters for Immature of Abnormal BloodCells;Final Guidancefor Industry and FDA.2001.
6 卫生部医疗机构临床实验室管理办法.
7 医学实验室质量和能力的通用要求(即ISO15189).
8 曾完威.迈瑞BC-5500 全自动血细胞分析仪的性能评价.检验医学与临床,2007,4:613-615.
9 苏庆军,赵燕,陈建国,等.血液标本存放条件对检测结果的影响.华北国防医药,2007,19:55-57.
10 中华人民共和国卫生部药典委员主编.中华人民共和国药典(二部).北京:化学工业出版社,2000.659.
11 国家食品药品监督管理局.YY/T 0653—2008 一中华人民共和国医药行业标准(血液分析仪),ICSII.100,C44,2009.6.
12 Operator’sManual:BC-5300AutomatedHematology Analyzer.Shenzhen,China:MindrayBio-Medical Electronics Co.Ltd,2010-04:B2-B4.
13 张旭凯,陆海峰.五分类血液细胞分析仪的原理及应用.中国医疗器械信息.2006,12:52-56.
