辛伐他汀预处理对脓毒症大鼠心肌细胞ICAM-1表达的影响及意义
2013-11-11张立涛于织波赵鹤龄
张立涛 于织波 赵鹤龄
脓毒症是由于感染引起的全身炎性反应综合征,并常导致组织损伤和器官功能异常,进一步发展可导致脓毒症休克、多器官功能障碍综合征。脓毒症时往往合并心肌细胞损伤,心脏功能障碍,且发生率很高,机制复杂,其中细胞间粘附分子-1(ICAM-1)在此过程中发挥了重要作用。已有资料表明ICAM-1是心肌炎性反应时中性粒细胞游走、聚集、发挥细胞毒作用必不可缺的跨膜蛋白质,与心肌损伤明显相关。他汀类药物即3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,是一种广泛应用的降脂药物,并可以减少患冠心病的风险。除此之外,他汀类药物尚有与降低血脂无关的多种生物作用,这种多效性包括:抗炎作用、免疫调节、抗氧化、抗凝血、稳定血管内皮等,因此理论上他汀类药物可以改善脓毒症患者的预后。本实验主要通过免疫组化的方法,观察脓毒症模型大鼠心肌细胞ICAM-1 的表达,并评价辛伐他汀预处理对其表达的影响及意义。
1 材料与方法
1.1 动物分组及处理清洁级健康雌性Wistar 大鼠60 只,体重200 ~250 g(河北医科大学实验动物中心,合格证编号:909043)。饲养于恒温(20℃)清洁饲养室,喂养普通大颗粒饲料,给予充足水分,通风良好,温度适宜。经1 周适应期后利用随机数字表完全随机化分组为正常组、脓毒症组和辛伐他汀组,每组20 例。辛伐他汀组开始喂养辛伐他汀20 mg/kg(舒降之,默沙东),用0.9%氯化钠溶液配成等浓度药液灌胃(5 mg/ml),1 次/d,持续2 周。正常组和脓毒症组用0.9%氯化钠溶液灌胃(4 ml/kg),1 次/d,持续2 周。2 周后脓毒症组和辛伐他汀组行盲肠结扎穿孔术,各组于术后48 h 分别取大鼠左心室心肌组织,置入10%中性甲醛溶液固定,梯度乙醇脱水,常规石蜡包埋。
1.2 动物模型制备采用盲肠结扎穿孔法(CLP)[1]建立脓毒症模型。麻醉前禁食8 h,以10%水合氯醛(350 mg/kg)腹腔注射麻醉后,将大鼠固定在实验台上。常规消毒腹部皮肤,于腹部皮肤正中做切口,长约2 cm,打开腹腔后小心分离盲肠,避免损伤肠系膜血管。盲肠如有粪便,则轻轻将其挤向与其相连的大肠,在盲肠与小肠及大肠交界处,用4-0 丝线环形结扎盲肠,避免结扎回肠和盲肠系膜血管。结扎完毕后仔细检查,保持肠道通路畅通。在与肠系膜相对的盲端肠壁浆膜面用18 号针头穿刺3 次,挤出适量肠内容物,并留置一宽约0.2 cm,长约3 cm橡皮引流条贯通盲肠,以防针孔闭合,轻轻将肠管放回原处,逐层缝合,关闭腹腔。
1.3 方法
1.3.1 石蜡切片行S-P 三步法免疫组织化学法染色:ICAM-1一抗为兔抗大鼠IgG 多克隆抗体(购于武汉博士德生物工程有限公司),抗体稀释比例为1∶200。
1.3.2 染色结果判定:ICAM-1 阳性染色为在细胞浆内出现黄色或棕黄色颗粒沉着。阳性细胞必须具备:①细胞结构清晰;②阳性颗粒定位、定性好;③着色明显高于背景。评分标准:参照Soslow[2]的评分方法,应用美国多功能真彩色细胞图象分析管理系统分析:每张切片随机取5 个(×200)高倍视野,采用阳性细胞显色强度和阳性细胞百分比双重判定进行评分,并将二者评分乘积作为最终评分进行统计学分析。评分标准:①显色强度判定:阴性为0 分,弱阳性为1 分,阳性为2 分,强阳性为3分;②阳性细胞百分比判定:着色细胞占总细胞数<1%为0分,1%~10%为1 分,11%~50%为2 分,51%~80%为3 分,81%~100%为4 分;③以阳性细胞显色强度和阳性细胞百分比得分之积作为最终结果进行判定,0 分为阴性,1 ~4 为弱阳性(+),5 ~8 分为阳性(++),9 ~12 为强阳性(+++)。
1.4 统计学分析应用SPSS 19.0 统计软件,等级资料采用多个独立样本比较的Kruskal-Wallis H 检验及成对比较,P <0.05 为差异有统计学意义。
2 结果
2.1 大鼠的一般情况脓毒症组大鼠术后表现出无活力、反应差、发绀、立毛和呼吸急促的特点。打开腹腔后可见血性腹水,可闻及恶臭味,并发现部分大鼠肠管水肿,盲肠发黑,可见脓苔。相比之下,辛伐他汀组大鼠表现相对较轻。
2.2 ICAM-1 免疫组织化学染色结果(1)正常组大鼠心肌细胞ICAM-1 蛋白表达微量。(2)脓毒症组大鼠心肌细胞胞浆内可见较多棕黄色或棕色颗粒沉着,与正常组比较明显增加(P<0.05)。(3)辛伐他汀组大鼠心肌细胞胞浆内棕黄色颗粒与脓毒症组比较明显减少,差异有统计学意义(P <0.05),与正常组比较差异有统计学意义(P <0.05)。见图1 ~3,表1。

图1 正常组心肌细胞ICAM-1 的蛋白表达(SP×400)
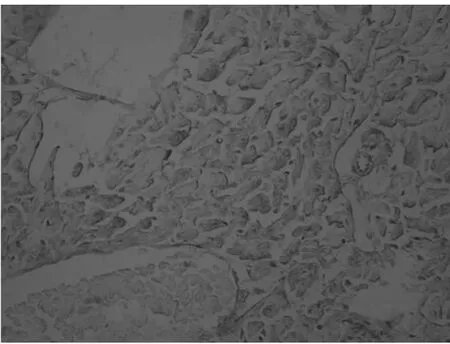
图2 脓毒症组心肌细胞ICAM-1 的蛋白表达(SP×400)

图3 辛伐他汀组心肌细胞ICAM-1 的蛋白表达(SP×400)

表1 3 组大鼠心肌细胞ICAM-1 蛋白表达情况比较n=20,例(%)
3 讨论
本研究参照相关文献采用盲肠结扎穿孔法制备脓毒症大鼠模型,通过盲肠的结扎和穿孔,使有菌的肠内容物污染腹腔造成弥漫性腹膜炎,诱发广泛的全身性炎性反应。结果表明:术后大鼠出现精神倦怠、躁动、寒战、发绀、腹胀和呼吸急促的特点。打开腹腔后可见血性腹水,可闻及恶臭味,并发现部分肠管水肿,盲肠发黑,可见脓苔。以上均提示脓毒症模型制备成功。
ICAM-1 是免疫球蛋白超家族的细胞表面跨膜蛋白质,是由细胞产生的介导细胞与细胞间或细胞与细胞外基质之间相互作用的一类膜表面糖蛋白分子,广泛表达于各种组织细胞表面。其与配体淋巴细胞功能相关抗原-1(LFA-1)相结合,参与细胞信号传导与活化、细胞的伸展和移动、生长及分化、炎性反应、血栓形成、肿瘤转移及创伤愈合等一系列重要的生理病理过程。正常情况下,心肌细胞表面ICAM-1 表达量极低,但在脓毒症时,细胞因子如白介素-1(IL-1)、肿瘤坏死因子α(TNF-α)等和脂多糖(LPS)可使心肌细胞ICAM-l 表达增加,而ICAM-l 在介导白细胞由血管内向血管外游走,并造成心肌损伤的过程中发挥了重要作用。van Griensven 等[3]证实ICAM-l 基因已被敲除的小鼠在脓毒症模型中的炎性反应明显减弱,肺脏、肝脏中性粒细胞浸润明显减少,组织损伤相对较轻,死亡率明显低于对照组。Davani 等[4]发现:LPS 可使心肌组织ICAM-1 表达明显增加,并使左心室心肌收缩力明显减弱,作者认为这与ICAM-l 所致心肌组织中性粒细胞浸润关系密切。本研究同样发现脓毒症模型组大鼠心肌细胞ICAM-1 蛋白表达明显增加,证明其与心肌炎性反应,中性粒细胞侵润,心脏功能障碍明显相关。
他汀类药物抗脓毒症作用机制较为复杂,同时也是多方面的。大量动物实验表明脓毒症时他汀类药物可以在不同水平、不同机制上发挥脏器保护作用,抑制炎性反应[5],改善功能障碍,降低脓毒症模型的死亡率[6]。本实验主要探讨辛伐他汀对脓毒症模型心肌细胞ICAM-1 表达的影响,结果显示:造模后48 h 经辛伐他汀预处理的脓毒症大鼠心肌细胞ICAM-1 的蛋白表达较脓毒症组明显减少(P <0.05),因此理论上可以减少脓毒症时心肌组织中性粒细胞的浸润,抑制炎性反应,改善心脏功能。关于辛伐他汀可以减少ICAM-l 表达的机制可能与其抑制心肌细胞内核转录因子-κB(NF-κB)等上游信号传导通路有关[7],具体机制有待进一步研究。
本实验主要通过免疫组化的方法研究辛伐他汀预处理对脓毒症大鼠心肌组织ICAM-1 表达影响,受研究方法与样本数所限,结果存在一定局限性。并且本实验结果虽然证实辛伐他汀预处理可以抑制ICAM-1 的蛋白表达,但是辛伐他汀组同正常组相比仍有明显差异,因此20 mg/kg 的辛伐他汀预处理剂量只是参考相关文献进行的探索性实验,其他剂量与种类的他汀类药物的实验效果有待进一步研究。
1 Hubbard WJ,Choudhry M,Schwacha MG,et al.Cecal ligation and puncture.Shock,2005,24:52-57.
2 Soslow RA,Dannenberg AJ,Rush D,et al.Cox-2 is expressed in human pulmonary,colonic,and mammary tumors.Cancer,2000,89:2637-2645.
3 van Griensven M,Probst C,Müller K,et al.Leukocyte-endothelial interactions via ICAM-1 are detrimental in polymicrobial sepsis.Shock,2006,25:254-259.
4 Davani EY,Boyd JH,Dorscheid DR,et al.Cardiac ICAM-1 mediates leukocyte-dependent decreased ventricular contractility in endotoxemic mice.Cardiovasc Res,2006,72:134-142.
5 Chaudhry MZ,Wang JH,Blankson S,et al.Statin(cerivastatin)protects mice against sepsis-related death via reduced proinflammatory cytokines and enhanced bacterial clearance.Surg Infect(Larchmt),2008,9:183-194.
6 Beffa DC,Fischman AJ,Fagan SP,et al.Simvastatin treatment improves survival in a murine model of burn sepsis:Role of interleukin 6.Burns,2011,37:222-226.
7 Madonna R,Di Napoli P,Massaro M,et al.Simvastatin attenuates expression of cytokine-inducible nitric-oxide synthase in embryonic cardiac myoblasts.J Biol Chem,2005,280:13503-13511.
