内镜黏膜下剥离术在食管病变治疗中的应用
2013-11-11王兵
王兵
内镜黏膜切除术(endoscopic mucosal resection,EMR)能够提供准确的组织学检测[1],成为内镜治疗常用方法。然而,应用EMR 在完整切除病灶和较大块切除方面较为困难。内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)较于EMR可达到将病灶整块切除且不受病灶大小限制的目的。因此,ESD 作为上消化道的微创治疗术,近年来得到迅速发展[2]。虽然ESD 技术较困难,但是在治疗食管病变方面却十分安全有效[3]。我院对食管病变患者28 例进行了ESD 治疗,报道如下。
1 资料与方法
1.1 一般资料选择2010 年1 月至2012 年1 月在我院对经胃镜检查疑似食管异性增生或食管早期癌变患者28 例进行ESD 治疗。28 例中男18 例,女10 例;年龄38 ~79 岁,平均年龄(41±8)岁。所有患者术前经血常规、小便常规、凝血功能、肝肾功能、血糖、肝炎7 项、心电图、胸片项目的检查,年龄较大者必要时行肺功能检查。纳入标准:(1)镜下表现为食管局灶性且边界清晰的息肉状、糜烂、充血、斑块性改变;(2)患者符合全身麻醉的条件。排除标准:(1)患者凝血功能异常;(2)CT 显示食管管壁增厚、淋巴结肿大明显;(3)食管病变浸润深度超过SM1(侵犯黏膜下上1/3)。
1.2 器械Olympus 公司GF-Q260 和GIF-Q260J 电子胃镜;ERBE 公司VIO-200D 高频电切装置和APC300 氩离子凝固器;NM-4L-1 注射针;FD-1U-1 热活检钳;HX-610-90、HX610-90 止血夹;Insulated-tipped (IT)刀(KD-610L);HOOK 刀(KD-620LR);圈套器内镜头端附加透明帽等。
1.3 方法
1.3.1 术前准备:常规检查患者心电图、血生化、凝血全套及血常规等。术前使用超声内镜检查病灶,评估病变浸润深度。病灶的肌层及浆膜层需完整,病变局限于黏膜层及黏膜层下层(超声镜下显示第1、2、3 层增厚,不规则)。评估治疗与麻醉的风险程度,与患者签署知情同意书。
1.3.2 手术方法:①术日准备:手术当日患者禁食。对患者建立静脉通路。术中常规鼻饲吸氧,患者左侧卧位,放置牙垫,心电监护。充分考虑和评估手术时间、病灶部位和患者一般状况,行全身麻醉。维持静脉通路,监测呼吸频率、心率、血压以及血氧饱和度;②Lugol 染色[4]:胃镜发现病灶后,使用喷洒管在镜下喷洒0.9%氯化钠溶液冲洗病变区域及周围管壁。将1.2%Lugol 液由上至下的喷洒在病变食管壁及周围2 cm 范围内,喷洒量约在10 ml。10 s 后,用0.9%氯化钠溶液再次冲洗被Lugol 液覆盖的管壁区域,尽量吸出残余的碘液(图1);③标记:在染色确定病变区域后,用氩气刀对病灶外缘0.5 cm 处进行电凝标记(图2);④黏膜下注射:充分抬起病灶区,将靛胭脂混合液(靛腚紫5 ml+肾上腺素1 ml+生理盐水100 ml)于标记点外侧多点注射,每点注射量2 ml,直至病灶从肌层隆起。(图3);⑤切开与剥离:病变周围黏膜由远侧至近侧沿标记点使用Hook 刀切开。对大病灶使用IT 刀由近及远进行剥离,对小病灶使用圈套器通电切除。为预防术后创面迟发性出血,应用氩气血浆凝固术(APC),使用热活检钳对创面可见血管进行预防止血处理,最终病灶被切除(图4);⑥术后处理:ESD 术后常规禁食48 h,给予质子泵抑制剂、止血药及抗生素等药物;⑦回收标本:大标本使用网篮取出,小标本直接吸至透明帽缓慢取出待送病理检查。检查病灶是否切除完整。

图1 食管中段黏膜下肿瘤,Lugol 染色后,病灶呈不染区,箭头所示为病变区
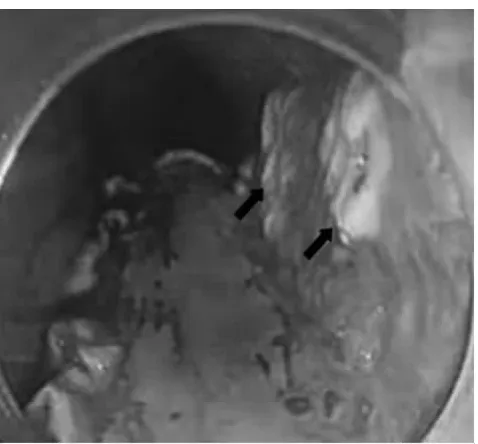
图2 电凝标记,箭头所示为标记点
1.4 观测项目术后密切观察头颈部有无皮下气肿,必要时行X 线检查,并进行对症治疗。术后3 d,无气肿及出血可进流食。术后1、2、6、12 个月分别进行复查,观察创面的愈合程度及病灶有无复发情况。

图3 黏膜下注射,充分抬起病灶区
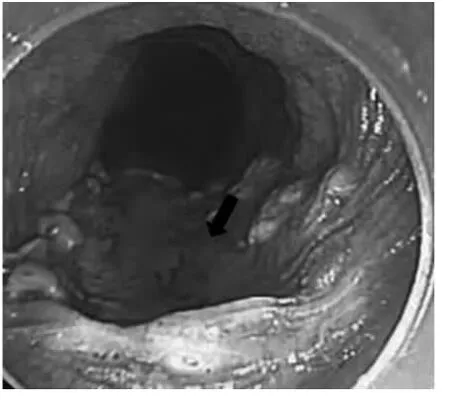
图4 病灶切除后,箭头为病灶区
2 结果
2.1 手术情况ESD 手术28 例,成功完成剥离26 例(92.9%)。1 例为巨大平滑肌瘤(7.0 cm×1.0 cm)剥离困难,停止剥离;1 例为食管囊肿(4.0 cm×1.5 cm)剥离时出现头颈部气肿,停止剥离,进行保守治疗,气肿2 d 后很快减退。手术时间15 ~150 min,中位数75 min。
术中创面均有少量出血,用热活检钳电凝成功止血,其中1例(3.6%)术中出现难以控制的大出血约750 ml,应用三腔管食管囊压迫出血部位止血成功。术后患者均未发生皮下气肿、发热等症状,3 例患者术后7 ~14 d 略感胸痛,对症治疗后无明显不适。
2.2 术后病理28 例中术后经病理诊断为异型性增生13 例(46.4%),原位癌6 例(21.4%),早期鳞癌7 例(25%),食管囊肿2 例(7.1%)。
2.3 术后随访与复查于术后1、2、6、12 个月随访,内镜复查。检查显示原病灶区周围疤痕集中,创面基本愈合,Lugol 液染色观察均无病变残留和复发。
3 讨论
近些年来,EMR 在消化道病变的治疗中被广泛的应用。不但治疗效果相同于外科手术效果,而且其充分体现出创伤小、恢复快、痛苦少等微创性优点。然而,对于大于2 cm 的病变需要分块切除,一次性完整切除难度性大,即使小于2 cm 的病变,其一次性完整切除率也仅在65%~93%,病灶容易复发。ESD 与EMR 相比,可实现较大病灶的一次性完整切除,复发率较低,且能提供较完整的标本进行病理诊断。ESD 在治疗食管早期癌及癌前病变的有效性和安全性已得到普遍认可。本组经我院治疗的28 例经ESD 手术治疗的患者,除两例终止手术外,其余26 例患者在随访,复查中未发现病变残留和复发。
常见内镜黏膜下剥离术并发症:出血、穿孔、食管狭窄及病灶复发。(1)出血。早期ESD 术中时间长,出血的发生率较高。近些年,由于操作技术逐渐改进,术中时间缩短,出血发生率降低。本组术中出现难以控制的大出血1 例。ESD 术中止血通过电凝或APC,术后出血则发生在12 ~24 h,术后出血则常通过内镜下止血。术中及时处理暴露的血管和创面对预防术后出血十分重要。(2)穿孔。同其他消化道部位相比,食管的管壁较薄,因此在进行ESD 手术治疗时,食管更易发生穿孔[5]。在术中出现穿孔时需立即终止剥离,吸净食管和胃腔内的气体及液体。术后密切观察头颈部有无气肿等症状,患者禁食、进行胃肠减压,静脉滴注抗生素预防感染。穿孔时,进行X线检查纵膈气肿和胸腔积气的情况,严重情况进行置管引流。本组1 例患者剥离时出现头颈部气肿,停止剥离,进行保守治疗,气肿逐渐减退。(3)食管狭窄。Mizuta 等[6]研究表明,食管肿瘤周径较大,ESD 治疗后常见并发症是食管狭窄。其研究建议当需整块切除的食管病变周径超过50%时,必须非常谨慎的选择ESD 手术,防止食管狭窄并发症的发生。本组患者所剥离的病灶均小于食管周径的50%,术后均未发生食管狭窄。(4)病灶复发。ESD 术后病灶复发的发生率较低,在切除的标本中发现切除边缘残留肿瘤的切缘,应再次切除,以防复发的可能性。本组患者切缘未有肿瘤侵入,术后复查未发现复发。
在日本,ESD 已被确立为上消化道早期肿瘤内镜切除的标准方法。2007 年,Fujishiro[7]提出ESD 治疗食管病变的适应证为食管重度异型增生、原位癌、黏膜内癌。ESD 治疗的禁忌证:伴有严重的心肺疾病、血液病、凝血功能障碍及服用抗凝剂的患者在凝血功能未纠正前严禁行ESD 治疗;病变基底部黏膜下注射后抬举较差的病变,提示病变可能浸润固有肌层或浆膜层,应慎行ESD。
总之,ESD 对于食管癌前病变及早期食管癌,在确定病变范围和浸润深度后的治疗,是十分有效和安全的方法。
1 Ahmad NA,Kochman ML,Long WB,et al.Efficacy,safety,and clinical outcomes of endoscopic mucosal resection:a study of 101 cases.Gastrointest Endosc,2002,55:390-396.
2 Oda I,Gotoda T,Hamanaka H,et al.Endscopic submucosal dissection for early gastric cancer:Technical feasibility,operation time and complications from a large consecutive series.Dig Endosc,2005,17:54-58.
3 Ishihara R,Iishi H,Uedo N,et al.Comparison of EMR and endoscopic submucosal dissection for en bloc resection of early esophageal cancers in Japan.Gastrointest Endosc,2008,68:1066-1072.
4 林荣凯,梁英杰,钟楚玉,等.内镜下碘染色对早期食管癌及癌前病变的诊断研究.基层医学论坛,2010,14:716-717.
5 Ono S,Fujishiro M,Koike K.Endoscopic submucosal dissection for superficial esophageal neoplasms.World J Gastrointest Endosc,2012,4:162-166.
6 Mizuta H,Nishimori I,Kuratani Y,et al.Predictive factors for esophageal stenosis after endoscopic submucosal dissection for superficial esophageal cancer.Dis Esophagus,2009,22:626-631.
7 Fujishiro M.Perspective on the practical indications of endoscopic submucosal dissection of gastrointestinal neoplasms.World J Gastroenterol,2008,14:4289-4295.
