镰刀霉菌(Fusarium sp)JN158 色素提取和分离技术的研究
2013-11-09王永威沈健增蔡宇杰廖祥儒李枝玲张大兵
王永威, 沈健增, 蔡宇杰*, 廖祥儒, 李枝玲, 张大兵
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;2.江苏汉邦科技有限公司,江苏 淮安223001)
色素一个比较宽泛的术语,日常生活中习惯把食用色素称为色素,在人们的生活中有着重要的作用;它可以改善物品和食品的颜色,是决定产品品质的关键因素之一。色素一般分为天然色素和合成色素[1]。天然色素主要来源于植物、动物和微生物等[2],植物色素主要来源于天然植物的根、茎、叶、花、果实;动物色素来源于动物身体及组织器官内累积的天然有色颗粒,例如昆虫、鱼类、鸟类及兽类等,有着各式各样的颜色,包括保护色和警戒色;动植物色素一般对身体无害,并且有许多还具有医疗保健作用[3-4];合成色素虽然色泽鲜艳、稳定性好、着色力强,且易于溶解、调色、成本低,但是很多化学合成色素具有毒性和致癌性[5],因此,很多合成色素被禁用,逐渐被天然色素所取代[1]。随着人民认识的提高,人们对食品的安全问题关心的更多,因此,天然色素对人们未来的生活将会起到更大的作用。
但是动植物色素的生产受到时间和空间等许多因素的限制,因此不能满足日益增加的需求量;可是,用微生物生产色素就不受那么多的因素影响,可以一年四季连续不断的发酵生产,可以满足日益增加的需求量,并且,微生物色素大部分具有活性和医疗作用[6];因此,采用微生物生产天然色素将逐渐成为天然色素来源的重要渠道[7];不过,现在开发的微生物色素种类非常少,文献报道的也不多[8-12],相对于动植物色素的种类,现在迫切需要开发新的微生物色素,以满足社会的需求。着眼于微生物生产色素的优势,作者对镰刀霉菌发酵产生的色素进行了提取技术和分离技术方面的初步研究,色素的分离方法主要有薄层层析法和色谱法[13-14],作者用高效液相色谱法取得良好的分离效果,为进一步研究镰刀霉菌色素提供了可靠的理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 菌种 镰刀霉菌(Fusarium sp)JN158菌株,作者实验室筛选并保藏。
1.1.2 培养基 PDA斜面培养基(g/L):土豆 200,葡萄糖 20,琼脂 20,pH 自然;种子培养基(g/L):土豆 200,葡萄糖 20,pH自然;液态发酵培养基(改造的高氏培养基)(g/L):葡萄糖 20,蛋白胨 1,氯化钠0.5,磷酸氢二钾 0.5,硫酸镁 0.5,硫酸亚铁 0.01,pH自然。
1.1.3 试剂 蒸馏水,乙酸,三氟乙酸,盐酸,氢氧化钠,甲醇,乙醇,乙酸乙酯,石油醚,乙醚,苯甲醇,甲苯,吡啶,氯仿,二甲亚砜,葡萄糖,氯化钠,磷酸氢二钾等均为分析纯试剂。
1.1.4 仪器 高速冷冻离心机:HITACHI公司产品;PB-10 pH计:赛多利斯科学仪器有限公司产品;冷冻干燥机EZ585Q:美国FTS公司产品;Agilent1200液相色谱仪:美国安捷伦公司;722分光光度计:上海第三分析仪器厂。
1.2 实验方法
1.2.1 菌体的发酵与色素的提取 在超净台内,从试管斜面上挑取一块菌落到含有种子培养基50 mL的250 mL的三角瓶中,放入200 r/min、30℃的摇床中培养48 h,按照6%的接种量接到30 L的气升式发酵罐中(装液量20 L),通气量为30 L/min,培养80 h。发酵液冷冻离心机离心10 min得到蓝色菌体(8 000 r/min,4 ℃),菌体冷冻干燥后,加入 5 倍体积的乙酸溶液浸提5 h,浸提液以8 000 r/min,4℃离心10 min,取上清液,菌体再用乙酸溶液浸提几次,直至无色素溶出,合并上清液,真空浓缩至膏状,依次加10倍体积的乙酸乙酯、丙酮各洗涤3次,以8 000 r/min离心10 min,去除脂类物质,取上清液真空浓缩至膏状,再冷冻干燥得到色素粗品,保藏备用。
1.2.2 提取剂的选取 取干燥菌体16份,每份0.500 g,研钵粉碎后,放入150 mL干净的烧杯中,再分别加入蒸馏水、pH=12的氢氧化钠、pH=2的盐酸、无水乙醇、pH=2的无水乙醇、pH=12的无水乙醇、丙酮、无水乙醚、三氯甲烷、乙酸乙酯、石油醚、甲苯、苯甲醇、二甲亚砜、乙酸、三氟乙酸溶液50 mL到150 mL的烧杯中,用保鲜膜封闭,放到30℃,200 r/min的摇床中浸提,两天后观察浸提液颜色。
1.2.3 色素最大吸收波长的测定 准确称取一定量色素溶解于乙酸中,用紫外分光光度计对之进行全波长扫描。
1.2.4 色素溶解性验证 分别准确称量色素样品14份,每份0.100 g,放入20 mL的试管中,分别加入蒸馏水、pH=2的氢氧化钠、pH=12的盐酸、无水乙醇、pH=2的无水乙醇、pH=12的无水乙醇、氯仿、pH=2的氯仿、pH=12的氯仿、乙酸乙酯、pH=2的乙酸乙酯、pH=12的乙酸乙酯、乙酸、三氟乙酸15~20 mL的试管中,试管振荡2 min后静置30 min,观察溶液的颜色。
1.2.5 色素的HPLC分离 分离条件:色谱柱,Phecda C18(5 μm,4.6 mm×250 mm);柱温,25 ℃;DAD 检测器检测波长,254 nm;流量,1.0 mL/min;进样量,10 μL。流动相A是含体积分数0.1%TFA的乙腈,流动相B是含体积分数0.1%TFA(氟乙酸)的蒸馏水,梯度洗脱程序见表1。

表1 流动相梯度程序Table 1 Gradient program of mobile phase
2 结果与讨论
2.1 镰刀霉菌最佳培养时间的选择
以改造后的高氏培养基为基础培养基对镰刀霉菌进行液体发酵培养,每日定时取样测定紫色素产量、菌体干质量和pH值,结果如图1。
在发酵过程中,发酵效果的优劣与培养基组成和菌体自身的生理性状有关。随着培养时间的延长,菌体生物量会逐渐增加,但是,菌体繁殖到一定程度后,由于营养物质消耗和代谢产物积累,菌体逐渐趋于老化,菌体会自溶。
由图1可知,菌体培养的第2天,才有紫色素产生,这是因为,该色素是菌体的次级代谢产物;随着菌体的生长,紫色素的产量就越来越多。当培养到第4天时,紫色素的产量达到最大,之后色素产量开始下降,同时,菌体的干质量浓度也开始下降,这是因为营养基本上被消耗完,菌体开始自溶,菌体内的物质跑到发酵液中;色素产量下降,可能是因为菌体自溶导致色素与许多物质(氧气)发生相互作用,色素本身结构发生了变化。在整个发酵过程中,由于菌体的快速生长,使得葡萄糖被利用而产酸,所以发酵液的pH值略呈现下降趋势。

图1 镰刀霉菌JN158生长曲线与色素的产量曲线Fig.1 Growth curve ofFusarium sp.JN158 and production curve of pigment
2.2 色素最佳提取时间的选择
在100 mL的烧杯中,用50 mL乙酸在200 r/min条件下浸提每克干燥菌体,每2 h测量吸光值,吸光度随浸提时间的变化如图2。

图2 吸光度随浸提时间的变化曲线Fig.2 Absorbance curve with the extraction time
从图中可知,吸光度随着浸提时间的增加而增大,当浸提时间超过10 h时,吸光度变化不大,也就是色素达到了溶解平衡,因此,以后选择12 h为浸提时间。
2.3 pH对镰刀霉菌素色泽变化的影响
镰刀霉菌色素,在酸性介质中呈深紫红至紫红色,并随pH的增大,亮度增加,在酸性pH值范围,色泽具有相对的稳定性,在碱性条件下,镰刀霉菌色素形成蓝色沉淀,这与有的色素会随着pH的变化而颜色也随之变化不同[13],这说明,酸碱对色素的结构变化起到很大的作用,但是,在酸性条件下,色素的结构不会随着酸性强度的改变而发生很大的变化。
2.4 色素提取剂的选取和溶解性验证
30℃条件下,溶剂浸提两天后试验结果见表2。

表2 不同溶剂的提取结果Tab.2 Extraction results of different solvents
由表2的实验结果可知,乙酸、三氟乙酸和pH=1的无水乙醇对色素有一定的提取能力,其余的溶剂都没有。这表明,该色素的溶解性很独特,因为,国内文献上报道的色素提取剂一般就是蒸馏水,甲醇,乙醇,乙酸乙酯,醚类等,而在本实验中这些溶剂都不能从菌体中提取到色素,足见该色素溶解的独特性。因为乙酸比乙醇价格便宜,三氟乙酸具有毒性,因此,作者选乙酸作为提取剂。
色素溶解性验证实验结果见表3。
由实验结果可知,色素可以溶解于酸性的有机溶剂或有机酸,不能溶解于其余的溶剂。这表明,影响色素溶解效果的因素主要有两个,第一个,溶液必须是有机溶剂;第二,有机溶剂必须是酸性。很可能是因为酸性改变了色素的空间结构,使之能溶解在有机溶剂中,而碱性环境使色素结构又发生变化,变成原来的空间结构。可以用这个特点,对色素进行多次萃取。
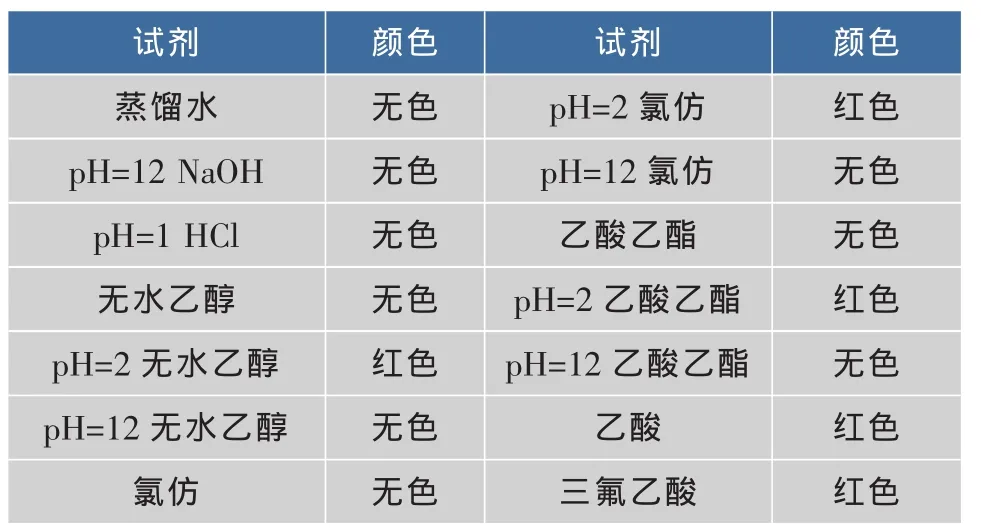
表3 不同溶剂的溶解结果Table 3 Dissolution results of different solvent
2.5 色素的最大吸收波长
经全波长扫描得到色素的最大吸收波长是510nm。

图3 紫色素可见光吸收光谱Fig.3 Absorption spectrum of purple pigment in visible light wavelength
2.6 色素的HPLC分离
2.6.1 洗脱程序的选择 通过多次试验,找到色素分离的最佳梯度洗脱程序(见表1);其中,以质量分数0.1%TFA的体积分数45%乙腈作为流动相的色素分离图谱见图4,用最佳洗脱程序分离得到的分离图谱见图5。
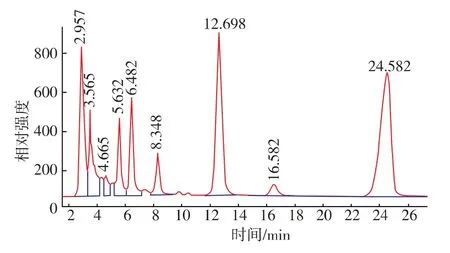
图4 乙腈为流动相的色素分离图谱Fig.4 Chromatogram mapofpigmentwith45%acetonitrile as mobile phase

图5 最佳梯度程序的色素分离图谱Fig.5 Chromatogram map of pigment with the best gradient elution program
比较两张图谱,可知:单一用体积分数0.1%TFA的体积分数45%乙腈作为流动相不能把极性物质与弱极性的色素成分分开,这是因为,45%的乙腈洗脱能力太强,导致极性成分与色素一起被冲出;可是,梯度洗脱程序中,开始3 min内,用体积分数2%~6%的乙腈先把极性成分冲出来,也就是图4中前6 min的成分,图3中前5 min的成分,而这样的洗脱强度不会对色素的吸附产生多大的影响,然后,直接适当加强洗脱强度,这样弱极性的成分就可以分开,实现了极性成分与弱极性成分的分离,同时也实现的弱极性成分之间的分离。
2.6.2 流动相的选择 把梯度洗脱程序中的乙腈换成甲醇分离色素得到的图谱见图5。
比较图5和图6可知:两者都实现了极性成分与弱极性成分的分离,但是,用甲醇作为流动相没有实现色素成分较好的分离,这个与流动相和色素成分之间的相互作用有很大的关系,不同的流动相适合不同成分的分离,所以,选择乙腈作为分离色素的流动相。

图6 甲醇为流动相的色素分离图谱Fig.6 Chromatogram map of pigment with methanol as mobile phase
2.6.3 色素成分的分析 图5中,使用的是DAD检测器,得到以下色素成分信息(表5、图7、图8)。
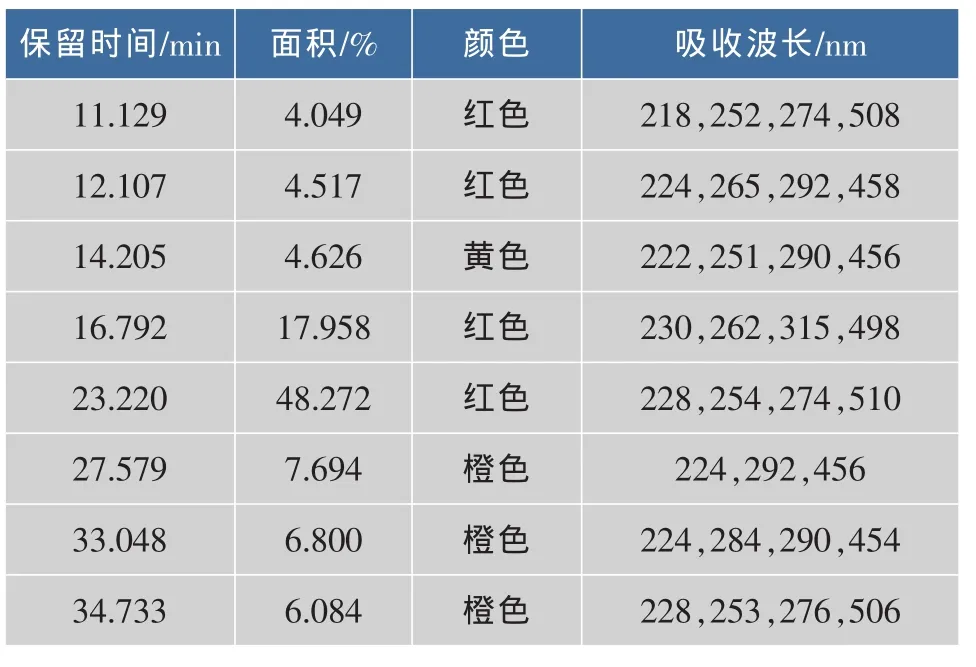
表5 色素成分信息Table 5 Information of pigment from Fig.4
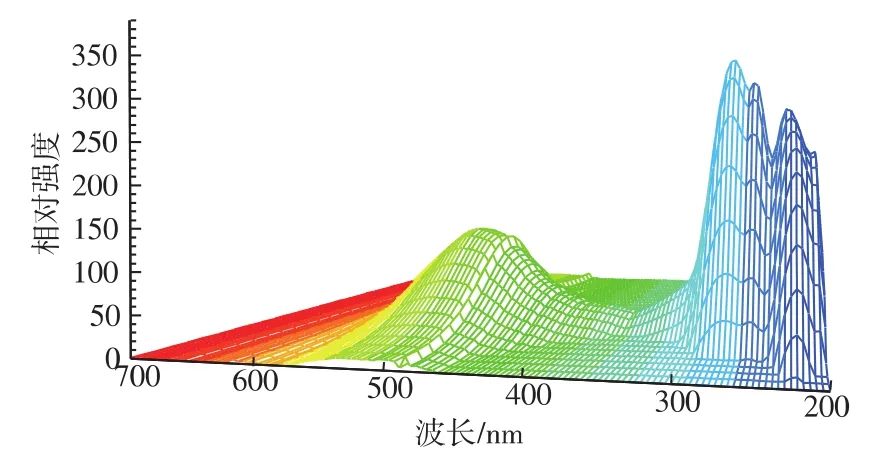
图7 16.792 min色素的吸收图谱Fig.7 Absorption spectrum of the pigment of 16.792 minute in 200~700 nm
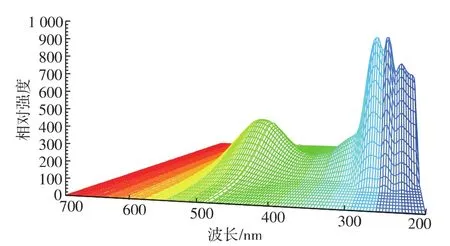
图8 23.220 min色素的吸收图谱Fig.8 Absorption spectrum of the pigment of 23.220 minute in 200~700 nm
表5可知:该镰刀霉菌色素共有8种成分,其中,4种红色,3种橙色,1种黄色;其中23.220 min的色素成分将近占到色素总量的一半,11.792 min的色素含量次之,12.107 min和14.205 min的色素含量相近,33.048 min和34.733 min的色素含量相近;11.129 min、23.220 min、34.733 min 的色素成分在508 nm附近有最大吸收峰,说明这几个色素成分 很 可 能 有 共 同 的 结 构 ,12.107、14.205、27.579、33.048 min的色素成分在456 nm附近有最大吸收峰,说明这几个色素成分很可能有共同的结构,16.792 min的色素成分在498 nm有最大吸收峰;一般黄酮类物质在255 nm和355 nm附近有最大吸收峰,但是,这8种色素成分在355nm附近没有吸收峰,说明,该色素不是黄酮类物质[14-15]。
3 结语
研究了镰刀霉菌(Fusarium sp)JN158色素的提取条件、溶解特性和液相分离方法,选用乙酸作为提取剂,选择4 d作为发酵时间,选择12 h作为浸提时间;该色素只能在酸性的有机溶剂或有机酸中溶解;色素在酸性条件下为红色,色素的颜色随着pH的改变不会发生颜色的很大变化;用高效液相色谱法实现了色素的良好分离,选择乙腈作为流动相,找到了较好的梯度洗脱程序,分离得到8种色素成分及自的吸收波长,其中,4种红色,3种橙色,1种黄色,且该色素属于黄酮类物质。
从色素的溶解性可知,该色素的性质非常特殊,有文献报道,有的色素在碱性条件下能溶解而在酸性条件沉淀[18],而该色素的溶解性与之相反,也没有文献报道这样溶解性的色素,说明其结构应该很特殊,该色素的结构正在研究中。
[1]陈运中.天然色素的生产及应用[M].北京:中国轻工业出版社,2007.
[2]邓祥元,王淑军,李富超,等.天然色素的资源和应用[J].中国调味品,2006,10(10):49-53.DENG Xiang-yuan,WANG Shu-jun,LI Fu-chao,et a1.Resources and application of natural pigments[J].China Condiment,2006,10(10):49-53.(in China)
[3]王薇.食用天然色素的营养保健作用[J].中国食物与营养,2005,1(1):45-47.WANG Wei.The nutrition health effects of natural pigment[J].Food and Nutrition in China,2005,1(1):45-47.(in Chinese)
[4]张庆杰,丁霄霖.番茄红素的保健作用与开发[J].食品与发酵工业,1997,23(4):72-75.ZHANG Qing-jie,DING Xiao-lin.Lycopene role in health care and development[J].Food and Fermentation Industries,1997,23(4):72-75.(in Chinese)
[5]Sava V M,Yang S M,Hong M Y,et al.Isolation and characterization of melanic pigments derived from tea and tea polyphenols[J].Food Chemistry,2001,73(2):177-184.
[6]Butler M J,Day A W.Fungal melanins:a review.Can J Microbial,1998,44(9):1115-1136.
[7]王君,张宝善.微生物生产天然色素的研究进展[J].微生物学通报,2007,34(3):580-583.WANG Jun,ZHANG Bao-shan.Research progress on natural pigments produced by microorganisms[J].Microbiology,2007,34(3):580-583.(in China)
[8]Leonid V B,Jan K H,Wim K.5-hydroxyaloesaponarin aminorblue pigment in an actinorhodin negative mutant of Streptomyces coelicolorA3(2)[J].J Biotechnol ApplBiochem,1997,26:195-201.
[9]Abbas A,Edwards C.Effect of metals on Streptomyces coelicolor growth and actinorhodin production[J].J Appl Environ Microbial,1990,56:675-680.
[10]Lu L,Cui H L,Chen Y N.Isolation and identification of Streptomyces sp.and assay of its exocellular water-soluble blue pigments[J].J Folia Microbial(Praha),2002,47(5):493-498.
[11]卢艳杰,陈正行,姚惠源.玉米蛋白粉中黄体素和玉米黄素的分离与定性[J].食品与生物技术学报,2003,22(5):11-14.LU Yang-jie,CHEN Zheng-xing,YAO Hui-yuan.Separation and characterization of lutein and zeaxanthin in corn gluten meal[J].Journal of Food Science and Biotechnology,2003,22(5):11-14.(in Chinese)
[12]赵庆喜,薛长湖,徐杰,等.反相高效液相色谱-柱后衍生法分析检测鱿鱼中的生物胺[J].食品与生物技术学报,2007,26(3):15-18.ZHAO Qing-xi,XUE Chang-hu,XU Jie,et al.Determination of biogenic amines in squid by reversed phase high-performance liquid chromatography and post-column derivatization[J].Journal of Food Science and Biotechnology,2007,26(3):15-18.(in Chinese)
[13]寇娴,张雁冰,赵清治,等.竹黄中红色素的提取与鉴定[J].河南药科大学学报,1999,34(2):80-81.KOU Xian,ZHANG Yan-bing,ZHAO Qing-zhi,et al.The Extraction and identification of red pigment from Shiraia[J].Journal of Henan Pharmaceutical University,1999,34(2):80-81.(in Chinese)
[14]Teris A vanBeek.Chemical all alysis of Ginkgo biloba leaves and extracts[J].Journal of chromatography A,2002,967:2l-55.
[15]凌云,何板作,鲍燕燕,等.浮萍的化学成分研究[J].中草药,1999,30(2):88-89.LING Yun,HE Ban-zuo,BAO Yan-yan,et al.The study of chemical composition on duckweed[J].Journal of Chinese Herbal Medicine,1999,30(2):88-89.(in Chinese)
[16]王学增,王景晨,王亚蕾,等.碱溶酸沉淀法提取黑米天然色素的研究[J].信阳师院学报,1995,7(4):392-395.WANG Xue-zeng,WANG Jing-chen,WANG Ya-bei,et al.Alkali solution and acid precipitation method to extract natural pigment of black rice[J].Journal of Xinyang Teachers College,1995,7(4):392-295.(in Chinese)
