灵芝超微粉理化特性研究
2013-11-09杨晓丽地里热巴沙它尔叶传松沈立荣
杨晓丽, 地里热巴·沙它尔, 李 翔, 叶传松, 沈立荣*
(1.浙江大学 生物系统工程与食品科学学院,浙江 杭州 310058;2.江苏华强纳米科技有限公司,江苏 南京210041;3.浙江龙泉佳宝生物科技有限公司,浙江 丽水 323700)
灵芝(Ganoderma Lucidum)是我国传统名贵药用真菌,是列入《中华人民共和国药典》的法定中药材[1],具有“扶正固本、滋补强壮”功效,应用历史悠久[2],临床上主要用于治疗慢性支气管炎、消化不良、神经衰弱、冠心病、肝炎、高血脂、高血压、白细胞减少症等疾病。现代研究表明,灵芝含有灵芝多糖、灵芝多肽、灵芝酸(三萜类)等150多种成分,灵芝多糖是其中的主要成分[3-5]。目前灵芝是卫生部公布的可用于保健食品的中药材和新资源食品,已广泛应用于保健食品,以灵芝为原料开发的各类保健食品,具有抑制肿瘤、免疫调节能力、调节血脂、延缓衰老、耐缺氧、化学性肝损伤辅助保护、缓解体力疲劳等功能。
超细粉碎技术是指将物料颗粒粉碎至粒径在30 μm以下的一种微粉碎技术,由于颗粒的微细化导致表面积和孔隙率的增加,超细粉体具有独特的物理化学性能,如良好的分散性、吸附性、溶解性、化学活性、生物活性等[7]。当超细粉颗粒粒径达到10 μm以下时,称为超微粉[8-9]。超微粉技术是对超细粉技术的进一步深化,如中药粉体颗粒平均粒径达到2~5 μm时,可使粉体的均匀性明显提高,使粉末更加细腻,药性及口感更佳,直接服用可大大提高活性成分的吸收强度和吸收量,有效提高中药的生物利用度[8]。目前有关灵芝超微粉的研究还未见报道,为此作者采用超微粉碎技术,对灵芝子实体进行了超微粉碎加工,并对其超微粉进行了表征和主要功能性成分粗多糖浸出率检测,以期为灵芝提供新的深加工途经。
1 材料与方法
1.1 材料与试剂
灵芝子实体切片(干品)由浙江龙泉佳宝生物科技有限公司提供。灵芝常规粉(60目)和超细粉由该公司采用旋片式粉碎机和气流粉碎机加工得到。超微灵芝粉由江苏华强纳米科技有限公司加工,主要工艺为:将干燥灵芝切片剪切粗粉碎、除粗渣、细粉碎、纳米粉碎细粉和防氧化处理,真空包装后备用。无水乙醇、苯酚、硫酸、柠檬酸钠、甘油均为国产分析纯试剂,葡萄糖标准品购自中国药物生物制品检定所。
1.2 仪器与设备
粗粉碎机CSC-A型、细粉碎机GUA-G型和纳米粉碎机HO-100型:江苏华强纳米科技有限公司南京理工大学国家超细粉体工程技术研究中心提供;T6新世纪紫外可见分光光度计:北京普析通用仪器有限责任公司产品;TD6001电子天平:余姚市金诺天平仪器有限公司产品;BS124S型分析天平:赛多利斯科学仪器有限公司产品;Mastersizer 2000激光粒度分析仪:英国马尔文公司产品;H550s金相显微镜:日本Nikon公司产品;数码相机HC—3Oozi:日本FuJIX公司产品;LXJ-IIB飞鸽离心机:上海安亭科学仪器厂产品;DSK-24型水浴锅:嘉兴市中新医疗仪器有限公司产品;SHB-IIIA型真空循环泵:上海豫康科教仪器设备有限公司产品;RE-52AAB型旋转蒸发仪:上海嘉鹏科技有限公司产品;DGX-9143 B-2型热风干燥箱:上海福玛实验设备有限公司产品。
1.3 方法
1.3.1 灵芝粉体粒度检测 将样品用甘油分散后,用激光粒度分析仪进行测定,获得颗粒粒度分布表。样品样貌采用H550s金相显微镜和数码相机HC-3Oozi拍摄。
1.3.2 灵芝粉体粗多糖溶出率检测 取葡萄糖标准品105℃干燥至恒重,精确称量100 mg干燥至恒重的葡萄糖标准品,用蒸馏水溶解并定容至1 000 mL。精密吸取0.1 mg/mL的葡萄糖标准溶液0.0、0.1、0.5、1.0、1.5、2.0 mL,分别置于 25 mL 具塞试管中,准确补充蒸馏水至2.0 mL,加入5%苯酚溶液1.0 mL,混匀,加入浓硫酸10.0 mL,混匀,室温静置20 min,在485 nm下测定其吸光度。以葡萄糖标准品质量浓度为横坐标,吸光度为纵坐标绘制标准曲线[8]。得到葡萄糖标准曲线为 y=6.569 1x+0.052 6 R2=0.982,在葡萄糖质量浓度为0.005~0.100 mg/mL范围内线性关系良好。
分别称取由普通机械粉碎的60目常规粉、气流粉碎机粉碎的超细粉、纳米粉碎机粉碎的超微粉样品各3 g(精确到0.01 g),置于250 mL烧杯中,加水 120 mL,沸水浴,分别浸提 20、40、60、90、120、180 min,过滤后浓缩滤液,用无水乙醇沉淀粗多糖,离心(4 000 r/min)10 min,弃去上清液,用乙醇多次洗涤得到的沉淀,离心(3 500 r/min)10 min,除去蛋白后,加蒸馏水溶解定容,最后用苯酚硫酸法测定其吸光度(X)[8],代入葡萄糖标准曲线计算样品中的粗多糖浸出量,再按公式 “粗多糖浸出率(%)=粗多糖浸出量(g)/样品质量(g)×100”计算出样品中的粗多糖浸出率(%)。每种样品在不同时间点做3次平行实验,数据采用SPSS软件作方差分析。
2 结果
2.1 3种灵芝粉体粒度分布比较
对采用旋片机粉碎、气流粉碎和纳米粉碎技术得到的3种灵芝粉体的粒度分布检测结果表1和图1,从该结果可见,第一种粉体粒度范围(D50~D90)在 128.94~430.33 μm,分布不对称,出现双峰,体积平均粒径为181.53 μm,均匀性差;第二种粉体D50~D90在 15.12~65.82 μm,分布范围很宽,体积平均粒径为 29.26 μm; 第三种粉体 D50~D90在 2.92~6.03 μm,分布范围很窄,粒度分布为成正态分布的单峰,100%的粉体粒径(D100)小于 9.96 μm,显示均匀性较高。按参考文献[6~8]对粉体粒度的界定,这3种粉体分别属于常规粉、超细粉和超微粉。上述常规粉、超细粉和超微粉的比表面积分别为0.23,1.24,3.63 μm/g,超微灵芝粉的比表面积分别是常规粉和超细粉的15.8倍和2.9倍。由此可见,采用纳米粉碎设备加工灵芝可成功制备出超微粉。
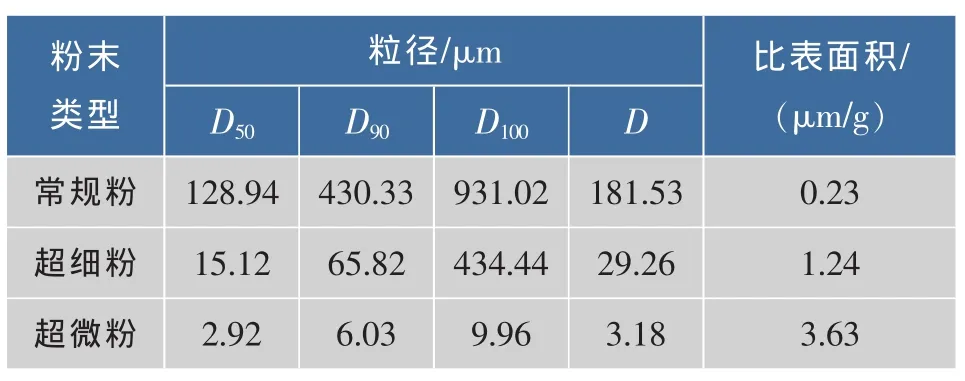
表1 不同灵芝粉体粒度分布比较Table 1 Comparison on the particle size distribution of different Ganoderma Lucidum powder
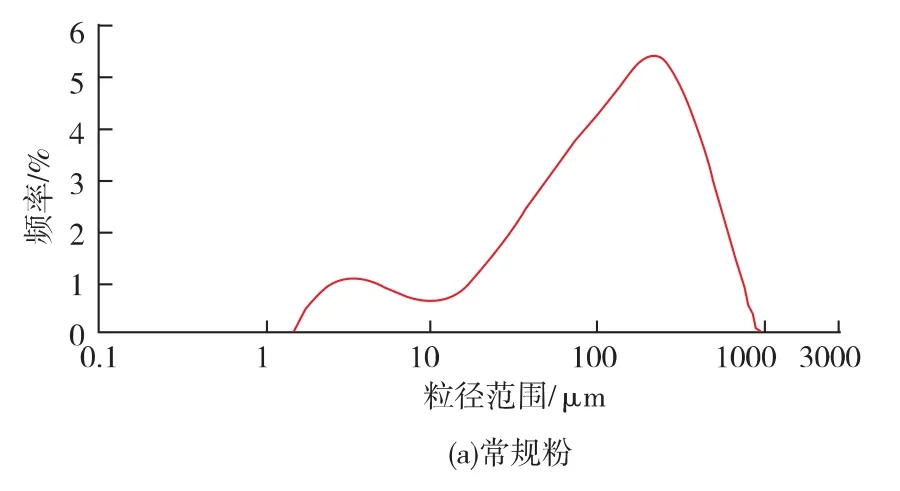

图1 不同灵芝粉体粒度分布比较Fig.1 Distribution of granule diameter of Ganoderma powders with different sizes
2.2 粉体显微形态
从3种灵芝粉体的显微照片(图2)可见,超微灵芝粉(图 2(c))与常规粉(图 2(a))和超细粉(图 2(b))的显微形态存在明显差别。在同样放大倍数下,常规粉和超细粉体的颗粒大小很不均匀,有许多纤维状或块状物。而超微粉的颗粒大小较为均匀,没有明显的纤维状或块状物。


图2 不同粒度灵芝粉的显微照片(100倍)Fig.2 Photomicrographs of Ganoderma Lucidum powders with different sizes(100×)
2.3 不同粒度灵芝粉体粗多糖浸出率比较
对不同粒度的灵芝粉作不同时间粗多糖的浸出率(%)比较,结果(表2和图3)显示,总体上,随着浸提时间的延长,不同粒度灵芝粉的粗多糖浸出率基本呈逐渐提高趋势;在3 h内粒度大小与粗多糖的浸出率反比,按粗多糖浸出率由高到低,排序为超微粉>超细粉>常规粉,差异达到极显著水平(F≤0.01)。超微灵芝粉在 20 min时的浸出率(3.03%)就已经超过了常规灵芝粉在2 h时的浸出率(2.15%),与超细粉在2 h时的浸出率(3.04%)几乎相当。随着浸提时间的延长,超细粉的多糖浸出率不断提高,在3 h时可达到4.22%;而常规灵芝粉在2 h之内的粗多糖浸出率增长缓慢,在2 h到后才有较大幅度的增长,估计要将常规灵芝粉中粗多糖最大限度的浸提出来至少需要3 h以上,浸提十分缓慢;超细粉的粗多糖浸出率在短时间虽然远高于常规粉,但远远低于超微粉。结果说明超微粉化可使灵芝子实体粉末的粗多糖生物利用度得到进一步提高。
3 结语
作者以灵芝子实体为原料,采用纳米加工工艺,制备得到灵芝超微粉。经表征和检测,所获得的粉体颗粒粒径小于10 μm,符合超微粉规格[6-7]。通过显微观察发现,灵芝超微粉中细胞已完全破壁,这可使其中的有效成分与溶剂直接接触,加快溶出速度,在较短时间内尽可能多的将有效成分释放,使其生物利用度得到有效提高[7]。实验对比发现,灵芝超微粉在浸提时间20 min内多糖的溶出速度分别为常规粉和超细粉的1.80倍和1.34倍,这充分说明了灵芝超微粉更利于有效成分的释放。因所用温度为100℃,而人体的正常温度只有37℃,远远低于实验温度,有研究[10]表明,温度越高,灵芝多糖的浸出率越高。若直接摄入灵芝粉或含有灵芝粉的食物,超微粉将更利于人体对功能性成分的吸收利用,这为灵芝超微粉保健食品新产品开发提供了有效依据。
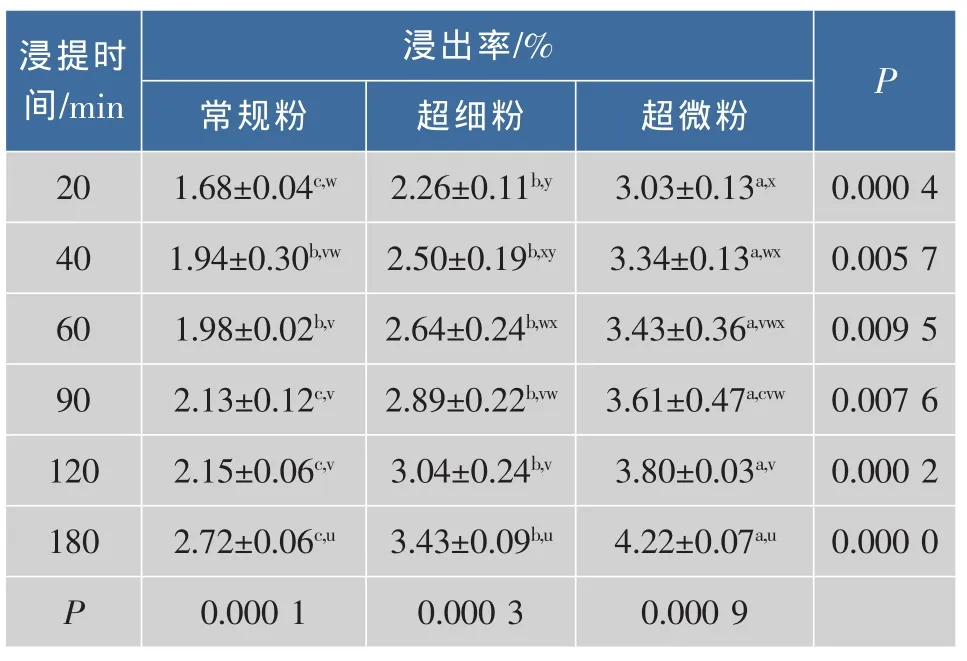
表2 不同粒度灵芝粉粗多糖比较浸出特性比较Table 2 Comparison on the dissolution characteristics of polysaccharides of Garnoderma powders with different sizes
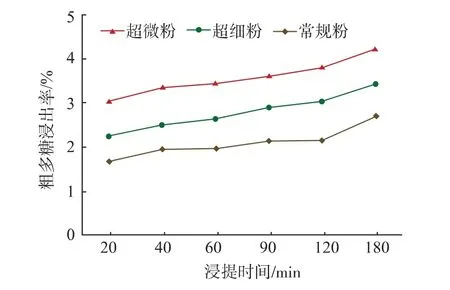
图3 不同粒度灵芝粉在3 h内的粗多糖浸出率Fig.3 Leaching characteristics of polysaccharides of Ganoderma powders with different sizes within 3 hours
采用超细和超微化加工提高中药和功能食品有效成分生物利用度,具有广阔的应用前景[11-12],如通过海带超细加工,可使海带粉的比表面积、吸水系数大大增加,粗多糖浸出速度大大提高[13];通过银杏叶超细粉加工,使粉体比表面积增加,银杏黄酮的浸出速度大大提高[14];通过超细加工,使麋角的水溶性蛋白质溶出度比普通粉提高1.41倍[15];使黄芩超微粉(粒径<10 μm,相当于 1250目)的黄芩苷溶出率比普通细粉(80目)提高13.9%[16],甚至比超声波协助下的200目黄岑粉末的黄芩苷溶出率还高3%[17]。据邓雯等报道,根据中药材性质和粉碎度不同,微粉化一般可节省药材30%~70%[18]。灵芝是我国医药保健品中应用最多和最广泛的名贵中药材之一,开发超微粉可为深加工产业和新产品开发提供新的技术支撑。
[1]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2010.
[2]林志彬.灵芝的现代研究[M].北京:北京医科大学出版社,1996.
[3]吕超田,姚向阳,孙程.灵芝主要活性物质及其药理作用研究进展[J].安徽农学通报,2011,17(1):50-51,94.LU Chao-Tian,YAO Xiang-yang,SUN Cheng.Progress of researches on main active substances and pharmacology of Ganoderma lucidum[J].Anhui Agricultural Bulletin,2011,17(1):50-51,94.(in Chinese)
[4]刘思好,王艳,何蓉蓉,等.灵芝的化学成分[J].沈阳药科大学学报,2002,65:72-75.LIU Si-hao,WANG Yan,HE Rong-rong,et al.Chemical constituents of Ganoderma lucidum (Leys.ex Fr.)Karst[J].Journal of Shenyang Pharmaceutical University,2002,65:72-75.(in Chinese)
[5]张狂,张志才,王玉红,等.灵芝菌丝体碱提水溶性多糖工艺条件及对涯自由基的清除作用 [J].食品与生物技术学报,2005,24(3):98-100.ZHANG Jue,ZHANG Zhi-cai,WHANG Yu-hong,et al.Studies on water soluble polysaecharides from the myeelia of Ganoderma lucidunby alkaline extraction[J].Journal of Food Science and Biotechnology,2005,24(3):98-100.(in Chinese)
[6]罗付生,韩爱军,杨毅,等.超细粉体技术在中药行业中的应用[J].中草药,2001,32(10):941-942.LUO Fu-sheng,HAN Ai-jun,YANG Yi,et al.Application of superfine powder technology in TM[J].Chinese Traditional and Herbal Drugs,2001,32(10):941-942.(in Chinese)
[7]杨连威,赵晓燕,李婷,等.中药超微粉碎后对其性能的影响研究[J].世界科学技术-中医药现代化.基础研究,2008,10(6):77-81.YANG Lian-wei,Zhao Xiao-yan,LI Ting,et al.Ultrafine grinding and its effects on traditional Chinese medicine[J].World Science and Technology/Modernization of Traditional Chinese Medicine and Material Medica,2008,10 (6):77-81.(in Chinese)
[8]谢瑞红,王顺喜,谢建新,等.超微粉碎技术的应用现状与发展趋势[J].中国粉体技术,2009,15(3):64-67.XIE Rui-hong,WANG Shun-xi,XIE Jian-xin,et al.Application and development trend of ultrafine comminution technology[J].China Powder Science and Technology,2009,15(3):64-67.(in Chinese)
[9]中华人民共和国农业部.食用菌中粗多糖含量的测定[M].北京:中国农业出版社,2008.
[10]李艳,赵海燕,吕建宁.灵芝多糖提取工艺研究[J].中成药,2006,28(7):1052-1054.LI Yan,ZHAO Hai-yan,LU Jian-ning.Study on extraction process of ganoderma lucidum polysaccharides[J].Chinese Traditional Patent Medicine,2006,28(7):1052-1054.
[11]王劲,郭天德.分级技术在中药超细粉体生产中的应用[J].中国粉体技术,2008,(1):36-38.WANG Jin,GUO Tian-de.Application of grading technology in the Chinese traditional medicine[J].China Powder Science and Technology,2008(1):36-38.(in Chinese)
[12]张洁,于颖,徐桂花.超微粉碎技术在食品工业中的应用[J].农业科学研究.2010,31(1):51-54.ZHANG Jie,YU Ying,XU Gui-hua.Technology of superfine grinding and its application in food industry[J].Journal of Agricultural Sciences,2010,31(1):51-54.(in Chinese)
[13]张炳文,郝征红,李允祥,等.海带超细粉理化特性的研究[J].食品科学,2008,29(8):43-45.ZHANG Bing-wen,HAO Zheng-hong,LI Yun-xiang,et al.Study on physical and chemical properties of ultrafine kelp powder[J].Food Science,2008,29(8):43-45.(in Chinese)
[14]刘学俊,郝征红,岳凤丽,等.银杏叶超细粉的理化特性研究[J].食品科技,2009,34(1):63-65.LIU Xue-jun,HAO Zhen-hong,YUE Feng-li,et al.Study on physical and chemical properties of ultra-fine ginkgo leaves particles[J].Food Science and Technology,2009,34(1):63-65.(in Chinese)
[15]王丽娟,刘训红,丁玉华.麋角超细粉体表征及其水溶性蛋白质溶出度研究[J].南京中医药大学学报,2010,3(2):132-134.WANG Li-jun,LIU Xun-hong,DIN Yu-hua.Studies on the characterization of David's deer horn superfine powder and dissolution of its water soluble protein[J].Journal of Nanjing Agricultural TCM,2010,3(2):132-134.(in Chinese)
[16]史国富,张璐.黄芩超微粉与普通粉溶出度较[J].山西中医学院学报,2011,12(2):34-35.SHI Guo-fu,ZHANG Lu.Comparison between ultrafine powder and ordinary powder of Skullca[J].Journal of Shanxi College of Traditional Chinese Medicine,2011,12(2):34-35.(in Chinese)
[17]贾艳萍,张春玲.微波辅助提取黄芩苷[J].食品科技与生物技术学报,2008,27(3):57-59.JIA Yan-ping,ZHANG Chun-ling.Studies on microwave-assisted extraction of baicalin[J].Journal of Food Science and Biotechnology,2008,27(3):57-59.(in Chinese)
[18]邓雯,夏荃,詹若挺,等.中药超微粉碎技术的研究进展[J].食品与药品,2007,9(11A):59-62.DENG Wen,XIA Quan,ZHAN Ruo-ting,et al.Research progress on ultrafine pulverization technology in traditional Chinese medicine[J].Food and Drug,2007,9(11A):59-62.(in Chinese)
