急性肺损伤大鼠肺组织中NF-КBp65和IL-8表达的意义及黄芪的干预作用
2013-11-08贺兼斌廖慧中易高众湖南省怀化市第一人民医院呼吸内科湖南怀化48000南华大学附属第一医院呼吸内科湖南衡阳400
贺兼斌,廖慧中,向 志,易高众,张 平 (.湖南省怀化市第一人民医院呼吸内科,湖南 怀化 48000;.南华大学附属第一医院呼吸内科,湖南 衡阳 400)
急性肺损伤大鼠肺组织中NF-КBp65和IL-8表达的意义及黄芪的干预作用
贺兼斌1,廖慧中1,向 志1,易高众1,张 平2(1.湖南省怀化市第一人民医院呼吸内科,湖南 怀化 418000;2.南华大学附属第一医院呼吸内科,湖南 衡阳 421001)
目的:研究内毒素(lipopolysaccharide,LPS)诱发急性肺损伤(acute lung injury,ALI)大鼠肺组织中核因子-КBp65(nuclear factor-kappaB,NF-КBp65)和白细胞介素8(interleukin 8,IL-8)的表达,用黄芪干预,观察和探讨黄芪对ALI的治疗效果及作用机制。方法:24只Wistar大鼠,随机均分成三组。对照组,706代血浆2 ml/(kg·只)尾静脉注射;模型组,LPS6mg/(kg·只)溶于706代血浆2 ml/(kg·只)尾静脉注注;黄芪组,LPS用法同模型组,2 h后尾静脉注射黄芪2 ml/(kg·只)。观察各组动物反应,黄芪干预2 h后颈动脉快速放血处死,行动脉血气分析,右肺称湿重后,90℃烘箱内24 h至恒重,称干重,计算湿/干重比(Wet weight/Dry weight,W/D)。左肺4%甲醛固定、石蜡包埋、组织切片(5 μm),HE染色,病理观察,免疫组化及图像分析系统检测NF-КB和IL-8的表达。结果:黄芪组呼吸窘迫减轻,对照组、模型组、黄芪组呼吸频率分别为(44.2±3.5)次/min,(112.7±6.1)次/min,(71.8±4.3)次/min;血气分析:动脉血氧分压(PaO2)分别为(12.51±0.38)kPa,(9.01±0.72)kPa,(11.27±0.51(kPa;二氧化碳分压(PaCO2)分别为(4.07±0.17)kPa,(4.60±0.41)kPa,(4.30±0.43)kPa;PH 值分别为(7.39±0.04)kPa,(7.33±0.14)kPa,(7.35±0.08)kPa。肺湿/干比分别为(5.1±4.3),)11.3±3.8),(7.8±3.6)。模型组肺组织有典型的 ALI病理学改,黄芪干预后,病理学改变较模型组轻。NF-КBp65表达的灰度值分别为(169.4±6.57),(107.6±5.81),(148.3±6.47),IL-8表达的灰度值分别为(181.6±7.18),(122.4±5.27),(154.1±6.39)。结论:ALI大鼠肺组织中NF-КBp65和IL-8表达明显升高,ALI的发病机理可能与NF-КBp65和IL-8表达升高所致的炎性反应调控失衡有关;黄芪对大鼠ALI有明显的治疗效果,可能与其下调NF-КBp65和IL-8表达有关。
核因子-КB;白细胞介素8;急性肺损伤;急性呼吸窘迫综合征;黄芪
ALI是呼吸系统的危重病,病死率很高,严重威胁患者生命,ALI的防治是医疗领域的一项重大难题,其发病机理复杂,迄今尚未能完全阐明,近年认为它与炎症调控失衡有密切关系,其中NF-КB对许多参与免疫与炎性反应的基因表达起调控作用,IL-8对多形核白细胞(poly-morphonuclear leukoeytes,PMN)有趋化作用,是重要促炎因子和组织损伤的炎性介质,研究表明它们与ALI炎性反应调控失衡有关[1-2]。黄芪对ALI有一定治疗作用[3],但具体机制不清。本研究用LPS诱发ALI动物模型,检测ALI大鼠肺组织NF-КBp65和IL-8表达,采用黄芪干预治疗,观察并探讨黄芪对ALI的治疗作用及机制。
1 材料与方法
1.1 实验动物:雄性Wistar大鼠24只,体重(300±50)g左右,由南华大学医学实验动物部提供[生产许可证号:SCXK(湘)2004-0009,使用许可证号:SYXK(湘)2004-0011]。
1.2 药品及主要试剂:黄芪注射液(批号:Z51021776,每支10 ml,相当于20 g生药)由成都地奥九泓制药厂提供,内毒素脂多糖(E.coli O111B)购于美国Sigma公司,NF-КBp65兔抗鼠单抗及SABC试剂盒购于武汉博士德公司,IL-8兔抗鼠单抗及即用型SABC试剂盒由长沙瑞晶公司提供,DAB显色剂均购自福州迈新生物工程公司。
1.3 动物模型建立:2%戊巴比妥钠(45 mg/kg)腹腔注射麻醉,LPS(6 mg/kg)溶于706代血浆尾静脉注射诱发ALI动物模型。
1.4 分组及用药:24只Wister大鼠,随机均分成三组,对照组:706代血浆2 ml/(kg·只)尾静脉注射;模型组:LPS 6 mg/kg/只溶于706代血浆2 ml/(kg·只)尾静脉注射;黄芪组:LPS同模型组,2 h后腹腔注射黄芪2 ml/(kg·只)。5 h后,2%戊巴比妥钠腹腔注射麻醉,颈动脉取血备用、处死。
1.5 观察指标及方法
1.5.1 动物反应观察:观察各组动物呼吸频率,活动情况,口唇及四肢末端紫绀变化情况,鉴定动物模型。
1.5.2 血气分析:实验结束后颈动脉放血处死,用澳大利亚产348Ph/Blood Gas Analyzer测动脉血 PH值,血氧分压(PaO2),二氧化碳分压(PaCO2)等。
1.5.3 剖胸取右肺称湿重后,置90℃烘箱内24 h至恒重,称干重,W/D。
1.5.4 光镜观察:左肺用4%中性甲醛溶液固定、石蜡包埋、组织切片(5 μm),HE染色,病理观察。
1.5.5 免疫组化:免疫组化SABC法检测NF-КBp65和IL-8的表达。操作严格按试剂盒说明书进行,用PBS缓冲液代替一抗作阴性对照。NF-КBp65主要表达于胞浆,胞核少量表达,为棕黄色颗粒;IL-8主要表达于单核细胞、巨噬细胞和内皮细胞胞浆,呈棕黄色颗粒,采用Luzex-F病理图像分析系统测定肺组织中NF-КBp65和IL-8的平均灰度值(灰度值与蛋白质表达水平负相关)。
2 结果
2.1 各组大鼠的一般表现:对照组精神佳,呼吸平稳,RR40~50次/min,无紫绀。模型组注射LPS 5 min后即出现呼吸加快,45 min后RR110~120次/min,活动减少,烦躁不安,发绀,呼吸窘迫,模型成功。黄芪组注射LPS后表现同模型组,黄芪干预后,紫绀减轻,RR下降,各组比较差异有统计学意义(P<0.01),具体情况见表1。
2.2 黄芪对肺湿、干重和W/D的影响:与对照组相比,模型组肺湿、干重和W/D显著增加(P<0.01);黄芪组以上指标明显降低(P<0.05),但高于对照组,见表1。
表1 处死前各组大鼠呼吸情况及处死后肺湿、干重和W/D比较±s)
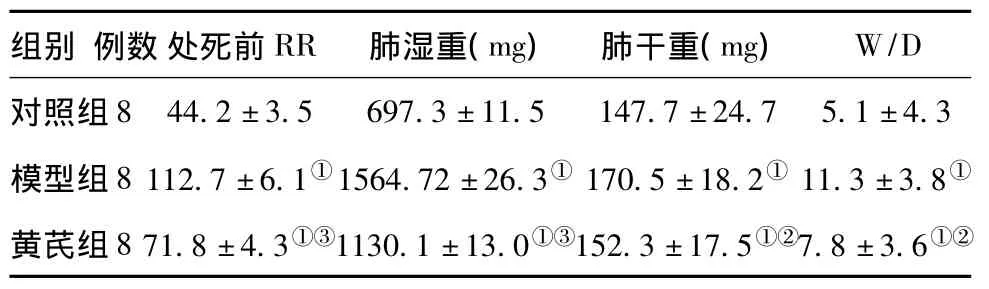
表1 处死前各组大鼠呼吸情况及处死后肺湿、干重和W/D比较±s)
注:与对照组比较,①P<0.01;与模型组比较,②P<0.01;与模型组比较,③P<0.05
组别 例数处死前RR 肺湿重(mg) 肺干重(mg)W/D对照组8 44.2±3.5 697.3±11.5 147.7±24.7 5.1±4.3模型组8 112.7±6.1①1564.72±26.3① 170.5±18.2① 11.3±3.8①黄芪组8 71.8±4.3①③1130.1±13.0①③152.3±17.5①②7.8±3.6①②
2.3 肺组织形态学观察:对照组肺无明显异常改变,镜下肺泡结构清晰;模型组肺暗红色,体积增大,高度充血,水肿,较多出血灶,镜下见出血,肺泡壁增厚,间质水肿,大量炎性细胞浸润;黄芪干预后,病理改变较模型组明显减轻,见图1~2。
2.4 血气分析:模型组PaO2明显低于对照组(P<0.01),经黄芪干预后,PaO2上升,黄芪组与模型组PaO2比较差异有统计学意义(P<0.05),模型组及黄芪组PaCO2较正常对照组上升(P<0.05),但模型组与黄芪组间比较,差异无统计学意义(P>0.05),模型组和黄芪组出现呼吸性酸中毒,pH值下降,与正常对照组比差异有统计学意义(P<0.05),见表2。
2.5 NF-КBp65和IL-8的表达:对照组NF-КBp65在胞浆中少量表达,细胞核基本不表达,模型组胞浆和胞核都有广泛高表达,黄芪组NF-КBp65在胞浆和细胞核表达比模型组有明显下降,见图3~4,表2;IL-8主要表达于单核细胞、巨噬细胞和内皮细胞胞浆,其表达情况与NF-КBp65类似,见图5 ~6,表2。
表2 各组血气分析和NF-КBp65、IL-8灰度值的比较(±s)

表2 各组血气分析和NF-КBp65、IL-8灰度值的比较(±s)
注:与对照组比较,①P<0.01;与对照组比较,②P<0.05;与模型组比较,③P<0.05
组别 例数 PaO2(kPa) PaCO2(kPa) PH值 NF-КBp65灰度值 IL-8灰度值对照组 8 12.51±0.38 4.07±0.17 7.39±0.04 169.4±6.57181.6±7.18模型组 8 9.01±0.72① 4.60±0.41① 7.33±0.14② 107.6±5.81① 122.4±5.27①黄芪组 8 11.27±0.51①③ 4.30±0.43① 7.35±0.08② 148.3±6.47①③ 154.1±6.39①③
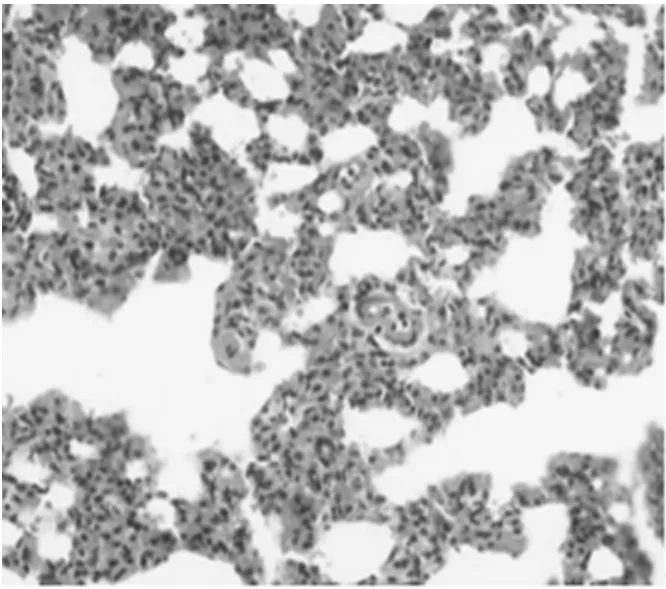
图1 模型组病理观察(HE×200)
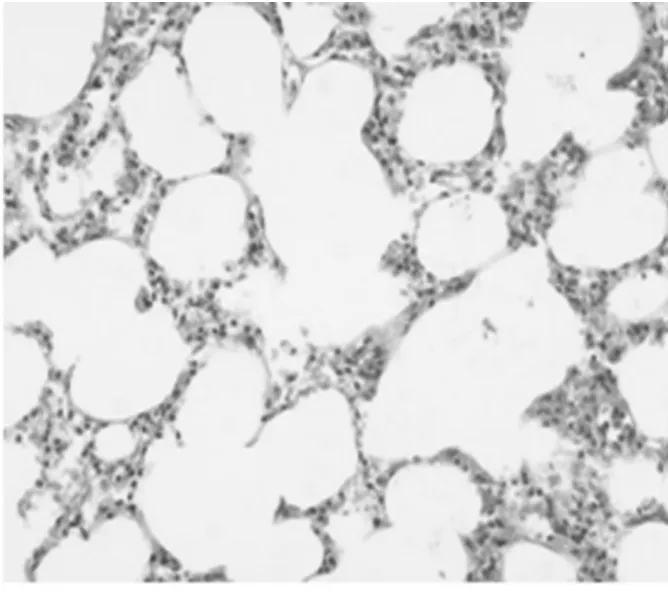
图2 黄芪组病理观察(HE×200)
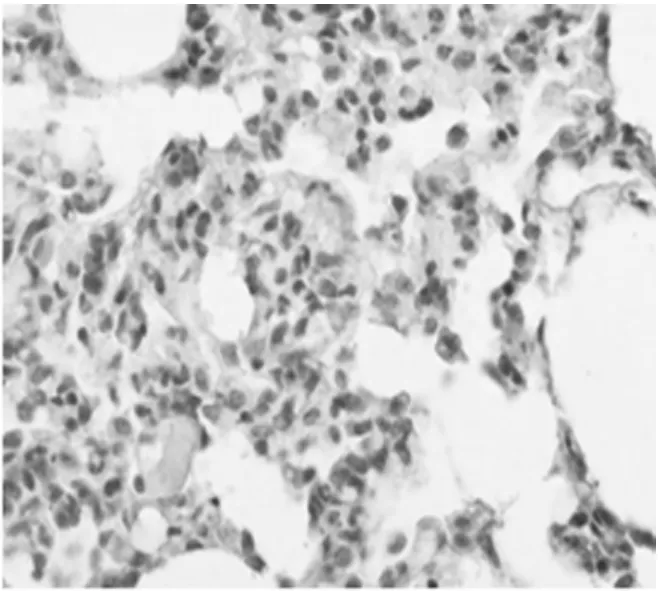
图3 模型组NF-КBp65表达(SABC×
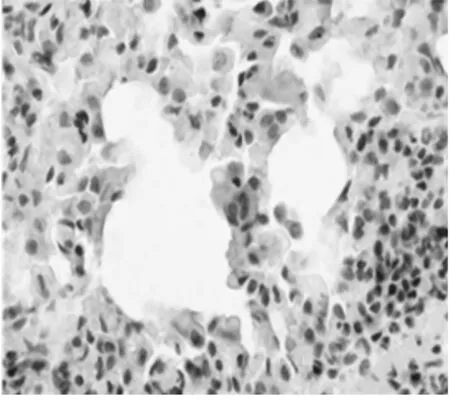
图4 黄芪组NF-КBp65表达(SABC×400)
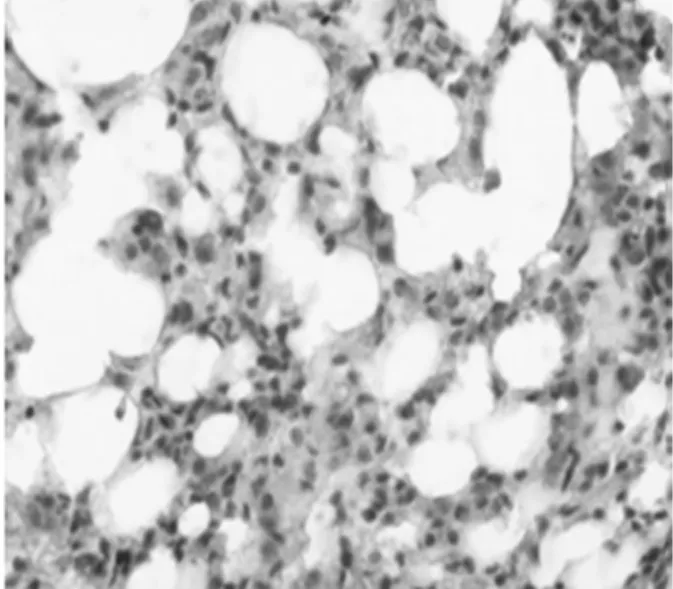
图5 模型组IL-8表达(SABC×400)
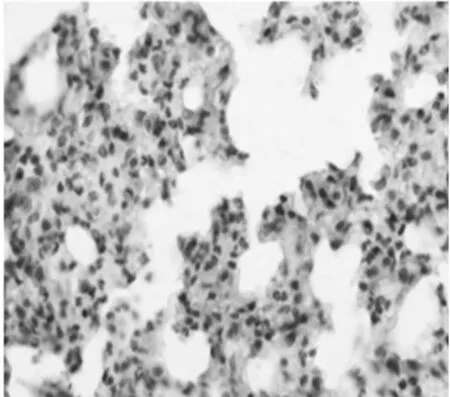
图6 黄芪组IL-8表达(SABC×400)
3 讨论
ALI发生和发展存在过度失控的炎性反应,其病理改变伴有PMN渗出、趋化、聚集并与血管内皮细胞黏附,释放大量炎症介质,导致肺血管内皮损伤,通透性增加,水分、蛋白质聚集于肺间质和肺泡内,引起肺顺应性降低,通气/血流比例失调,低氧血症等改变。细胞因子的过度表达及其相互作用是发生ALI的重要原因,调控机体炎性反应是治疗ALI的根本手段,NF-КB参与许多细胞因子及炎性介质基因的转录调控,在炎性反应调节中起重要作用,与肺损伤的关系逐渐引起重视[1]。IL-8是一个促炎因子,是强有力的PMN趋化和激活剂,参与ALI炎性反应,与ALI的发生和进展密切相关[2]。黄芪在临床上已广泛应用于多种疾病的治疗,本课题组前期研究提示能减轻LPS所致ALI大鼠模型肺损伤[3]。
结合大鼠呼吸变化、紫绀情况、血气分析、肺W/D变化、肺脏大体标本改变及病理改变,ALI模型是成功的[1-3]。我们对ALI大鼠给予黄芪干预后,其病理学改变较模型组明显减轻,肺W/D明显下降,血气改善,证明黄芪能减轻ALI肺损伤,对ALI有明显治疗作用。NF-КB是一种转录核因子,一般表达于胞浆,当被内毒素、活性氧、细胞因子等激活后从胞浆转位于胞核,启动靶基因转录,调控多种基因表达,产生大量炎性介质及细胞因子参与ALI的炎性反应进程,在炎性反应基因调控过程和细胞因子级联反应中起重要作用[4-6]。有研究表明在急性呼吸窘迫综合征(acute respiratory disress syndrome,ARDS)高危患者和ARDS患者以及小鼠肺损伤模型中存在 NF- КB 活性增高[7-8],NF- КB 活化后,调控炎性介质和细胞因子,在上游调控ARDS炎性反应,成为炎症调节的枢纽和关键,亦有研究显示在ALI动物模型中,抑制NF-КB的活性可以减轻急性肺损伤[9]。笔者的研究显示对照组大鼠肺组织中NF-КB呈低表达于胞浆,而模型组肺组织胞浆及胞核内见分布均匀的棕色颗粒,大多数已进入细胞核,即胞浆和胞核均呈高表达状态,经黄芪干预后,NF-КBp65活化程度明显低于模型组,其在胞核的表达减少尤为明显。利用病理图象分析系统对NF-КBp65蛋白表达进行灰度扫描,对照组中NF-КBp65灰度值最高,NF-КBp65表达水平低,而模型组NF-КBp65表达的灰度值最低,与对照组比较差异有统计学意义(P<0.01),表明NF-КB存在异常激活,处于高度活化状态,较多细胞胞核呈阳性表达,其功能可异常增高,进而改变细胞信号转导,促进炎性反应,加重肺损伤。黄芪组NFКBp65表达的灰度值介于模型组和对照组之间,它们与对照组和模型组比较差异有显著统计学意义(P<0.01),说明黄芪可通过下调NF-КB的表达,减轻肺损伤,对ALI有治疗作用。IL-8为前炎性反应介质,它主要由单核细胞、内皮细胞和巨噬细胞产生,IL-8能促进PMN趋化和激活,促使PMN在肺部浸润、气道内聚集,导致细胞变形、脱颗粒、呼吸爆发、释放溶酶体、形成超氧化物,扩大炎性反应,增加肺泡-毛细血管损伤[10]。在我们的研究中发现正常大鼠肺组织中IL-8呈低表达于胞浆,而模型组大鼠肺组织胞浆内见分布均匀的棕色颗粒,呈高表达状态,黄芪组肺组织IL-8含量显著少于模型组,利用病理图象分析系统对IL-8蛋白表达进行灰度扫描后,对照组中IL-8灰度值最高,表达水平低,模型组IL-8表达的灰度值最低呈高表达状态,与对照组比较差异有统计学意义(P<0.01),黄芪组IL-8表达的灰度值介于模型组和对照组之间,它们与对照组和模型组比较差异均有统计学意义(P<0.01),提示黄芪可调控IL-8表达,其对肺的保护作用,与IL-8表达降低有一定关系。黄芪是我国的传统中药材,在体实验表明[11-12],黄芪有抑制损伤和炎性反应后脂质过氧化及增强免疫功能,我们的研究表明黄芪可抑制损伤后机体NF-KB的激活,减轻炎性反应。早有研究表明[13],ARDS患者BALF中IL-8显著升高,PMN明显增加,导致肺泡-毛细血管膜损伤,大量蛋白及细胞成分渗透到肺血管外,促进肺水肿,IL-8水平与PMN相对含量正相关,与ARDS的发生和死亡率正相关,这一结论与我们的动物实验相一致。
综上所述,防止NF-КB和IL-8的过度激活或抑制其活性已经成为治疗ALI的新途径之一,黄芪能下调NF-КB和IL-8的表达,对ALI的治疗有重要意义,但IL-8为NF-КB的下游因子[14],黄芪是通过下调NF-КB的表达从而降低IL-8的表达,还是对两者皆有抑制作用,倘不完全明了,有待进一步研究。
[1] 贺兼斌,杨 凯,向 志,等.NF- КBp65在实验性大鼠ALI肺组织中的表达及清开灵的干预研究[J].南华大学学报(医学版),2007,35(3):359.
[2] 张晓慧,常立文,夏世文.白介素8在新生鼠高氧肺损伤炎性反应中的作用[J].华中科技大学学报(医学版),2002,31(2):198.
[3] 张书杰,张 平,何平平,等.急性肺损伤大鼠肺组织白细胞介素1β和肿瘤坏死因子α表达及黄芪的干预效应[J].中国组织工程研究与临床康复,2007,11(21):4112.
[4] Muriel P.NF kappaB in liver diseases:a target for drug therapy[J].Journal of Applied Toxicology,2009,29(2):91.
[5] Chen X,Ji B,Han B,et al.NF kappaB activation in pancreas induees pancreatic and systemic in flammatory respnnse[J].Gastroentemlogy,2002,122(2):448.
[6] Abraham E.NF kappaB activation[J].Crit Care Med,2000,28(4SuPP1):Nl00.
[7] Matsuda N,Haitori Y,Jesmin S,et al.Nuelear FactorkappaB decoyoligodeoxy nucleotides prevent acute lung injury in mice with cecal ligation and puncture - induced sepsis[J].Molecular Pharmacology,2005,67(4):1018.
[8] Yu YM,Lin HC.Curcumin prevents human aortic smooth muscle cells migration by inhibiting of MMP -9 expression[J].Nutrition Metabolism and Cardiovascular Diseases,2O1O,20(2):125.
[9] Kang JL,Park W,Pack IS,et al.Inhaled nitric acide attenuates acute lung injury via inhibination of nuclear factor kappa B and inflammation[J].J Appl Phsiol,2002,92(2):795.
[10] Crooks S W,Bayley D L,Hill S L,et al.Bronchial inflammation in acute bacterial cxacerbatiord of chronic bronchitis:the role of leukotriene B4[J].Eur Respir J,2000,15(2):274.
[11] 于芹超,朱同玉,张永康.黄芪甲甙对大鼠肾缺血再灌注损伤的远期防护作用[J].中华医学杂志,2004,84(17):1412.
[12] 王梅芳.黄芪及其制剂的作用机制与临床应用[J].中医药导报,2006,12(1):83.
[13] Donnelly SC,MacGregor I,Zamani A,et al.Plasma elastase levels and the developmet of the adult respiratory distress syndrome[J].Am J Respir Crit Care Med,1995,15(5):1428.
[14] 王 进,杨光田,乔礼芬,等.醒脑静脉滴注射液对内毒素诱导大鼠肺泡巨噬细胞核转录因子КB激活和细胞因子产生的影响[J].中国中西医结合急救杂志,2008,15(4):212.
Meaning of expression of NF-К Bp65 and IL-8 on pulmonary tissue in ALI rat model and intervention effect of astragalus mongholicus
HE Jian - bin,LIAO Hui- zhong,XIANG Zhi,et al.(Department of Pneumology,the First Hospital of Huaihua City,Huaihua 418000,China)
Objective To study the expression of NF-К Bp65 and IL-8 on pulmonary tissue in ALI rat model induced by injectingLPS,and to use the astragalus mongholicus to carry on the intervention treatment to observe and discuss the treatment result of astragalus mongholicus to ALI and its function mechanism.Method 24 Wistar rats were randomized into 3 groups,each group was 8:the comparison group:706 substitute of blood plasma 2ml/kg tail intravenous injection(iv);the model group,LPS 6mg/kg dissolves into 706 substitute of blood plasma 2ml/kg tail iv;the astragalus mongholicus group,the LPS usage with the model group,after 2 hours astragalus mongholicus 2ml/kg iv;All rats were sacrificed by bloodletting after 2 hours after treatment.with the artery blood for blood gas analysis,took the right lung to call Wet weight,and set to the 90℃ drying oven 24 hours to the constant weight,called its dry weight,calculated the wet/dry weight ratio,Left lungs were processed for histological examination.the expression of NF- К Bp65 and IL-8 in the lung tissue were detected by immunhistochemical method and pathology image analysis system.Results 1,Astragalus mongholicus treatment group was able to reduce the breath poverty- stricken,the breathe frequency were44.2 ±3.5,112.7 ±6.1,71.8 ±4.3,respectively in the comparison group,the model group,the astragalus mongholicus group;2,Blood gas analysis:PaO2(kPa)were 12.51 ±0.38,9.01 ±0.72,11.27 ±0.51,respectively.PaCO2(kPa)were4.07 ±0.17,4.60 ±0.41,4.30 ±0.43,respectively;Ph were7.39 ±0.04,7.33 ±0.14,7.35 ±0.08,respectively;3,W/D were 5.1 ±4.3,11.3 ±3.8,7.8 ±3.6,respectively;4,lung tissue of model group had a typical ALI pathological change;astragalus mongholicus intervention group pathology change was lighter compared with the model group;5,the expression of NF - КBp65 grey respectively was 169.4±6.57,107.6 ±5.81,148.3 ±6.47,and the expression of IL -8 grey respectively was 181.6 ±7.18,122.4 ±5.27,154.1±6.39.Conclusion The expression of NF - КBp65 and IL -8 on lung tissue in ALI rats is obviously elevates,astragalus mongholicus has the obvious treatment works result to ALI rat,and it is possibly related to its effect of suppressing the expression of NF -КBp65 and IL-8.
Nuclear factor-kappaB;Interleukin 8;Acute lung injury;Acute respiratory distress syndrome;Astragalus mongholicus
衡阳市科委科研基金资助[项目编号:2005KS01-011]
2012-06-28 编校:潘宏竹]
