塞来昔布联合卡培他滨对H22肝癌移植瘤小鼠的抑制作用及机制
2013-11-08姚志华苑亚东刘艳艳郭宏强姚书娜杨树军
姚志华,苑亚东,刘艳艳,郭宏强,赵 燕,姚书娜,杨树军
1郑州大学附属肿瘤医院内科,郑州450008
2武警河南总队医院神经外科,郑州450052
肝癌是临床上最常见的恶性肿瘤之一,在全球恶性肿瘤中居第5位,严重危害人类生命健康。研究表明,环氧合酶2(cyclooxygenase-2,COX-2)的过表达与肿瘤的发生、发展密切相关,而COX-2抑制剂对多种肿瘤均有较强的抑制作用,且与其他常规化疗药物联用具有协同作用[1]。本研究采用选择性COX-2抑制剂塞来昔布与氟嘧啶类抗肿瘤药物卡培他滨联合用于H22肝癌细胞移植瘤小鼠,观察肿瘤抑制作用并探讨其作用机制,以期为临床应用提供理论依据。
材料和方法
材料人肝癌H22细胞株购自中国科学院上海细胞库,常规培养于含10%小牛血清的DMEM培养基中(37℃、5%CO2),采用0.25%的胰蛋白酶消化传代。BALB/c裸鼠,清洁级,体重 (20±2)g,雌雄各半,购自河南省实验动物中心,许可证号:SYXK(豫)2005-0012。塞来昔布胶囊 (西乐葆)购自美国辉瑞公司,卡培他滨 (希罗达)购自上海罗氏公司,小牛血清购自杭州四季青公司,DMEM培养基购自美国Sigma公司,兔抗小鼠COX-2、核转录因子kappa B(nuclear factor kappa B,NF-κB)p65 和β-actin多克隆抗体购自美国Santa Cruz公司,HRP标记的羊抗兔IgG购自上海康成生物科技有限公司,Trizol试剂购自美国Introvigen公司,PCR试剂盒购自深圳晶美生物工程有限公司。
小鼠皮下移植瘤模型无菌环境下,吸取处于对数生长期的H22细胞制备单细胞悬液,无菌生理盐水调整至细胞浓度为1×107/ml,接种于BALB/c小鼠右前肢腋窝皮下,每只小鼠的接种量为0.2 ml,制备小鼠H22移植瘤模型。
动物分组及给药40只模型小鼠随机分为对照组、塞来昔布组、卡培他滨组和联合干预组4组,每组10只。塞来昔布以100 mg/kg灌胃[2],卡培他滨以755 mg/kg(相当于最大耐受量2.1 mmol/kg)灌胃[3],联合干预组同时给予塞来昔布和卡培他滨,给药剂量及途径与单独用药组相同。对照组灌胃等量生理盐水。从接种后第3天起,每天给药1次,连续15 d。
指标检测末次给药24 h后,脱颈处死小鼠,剥离完整肿瘤组织,生理盐水漂洗干净,吸水纸吸干水分后于电子天平称重,记录肿瘤重量 (瘤重)并计算抑瘤率。抑瘤率=(对照组瘤重-给药组瘤重)/对照组瘤重×100%。采用荧光定量PCR和Western blotting分别检测瘤组织中NF-κB p65和COX-2的mRNA及蛋白表达水平。
荧光定量PCR取新鲜瘤组织,采用Trizol试剂提取总RNA,反转录合成cDNA。采用荧光定量PCR方法检测 NF-κB p65和 COX-2的 mRNA表达水平。NF-κB p65 上游引物:5’-ACCCCTTTCAAGTTCCCATAGA-3’,下游引物:5’-ACCTCAATGTCTTCTTTCTGCAC-3’;COX-2 上游引物:5’-GTCTGATGATGTATGCCACAATCTG-3’,下游引物:5’-GATGCCAGTGATAGAGG GTGTTAAA-3’;内参 β-actin 上游引物:5’-TGTGCCCATCTACGAGGGGTATGC-3’,下游引物:5’-GGTA CATGGTGGTGCCGCCAGACA-3’。引物由生兴生物技术(南京)有限公司合成。采用 2-ΔΔCT法分析结果[4]。
Western blotting取瘤组织约100 mg,加入10倍体积的RIPA组织蛋白裂解液,匀浆机匀浆后,于12 000×g离心20 min,吸取上清液,弃沉淀。采用BCA蛋白定量试剂盒测定蛋白含量。总蛋白 (约50 μg)经SDS-聚丙烯酰胺凝胶电泳分离目的蛋白,并转移至PVDF膜,5%脱脂奶粉于室温下封闭2 h,分别加入兔抗小鼠NF-κB p65和COX-2的一抗,按照体积比1∶1000稀释,4℃孵育过夜,TBST漂洗3次,每次5 min,加入HRP标记的二抗,室温下孵育4 h,TBST漂洗3次,每次5 min。采用ECL法显影并压片。采用Quantity One v4.62软件分析条带灰度值,结果以目的条带与内参β-actin的相对灰度值表示。
统计学处理采用SPSS 18.0统计软件,结果以±s表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
结 果
对抑瘤率的影响塞来昔布和卡培他滨组的平均瘤重均较对照组显著降低 (P<0.01,P<0.001),两组抑瘤率分别为30.2%和49.9%。联合干预组的抑瘤率高达75.4%,平均瘤重明显低于塞来昔布组和卡培他滨组 (P<0.01,P<0.05)(表1)。
对NF-κB和COX-2的mRNA表达的影响NF-κB p65的mRNA表达水平在各组间差异无统计学意义(P>0.05)。塞来昔布和联合干预组显著抑制了COX-2的mRNA表达,与对照组相比差异有统计学意义 (P均<0.001),卡培他滨对COX-2的mRNA表达无明显影响 (图1)。
对NF-κB p65和COX-2蛋白表达的影响塞来昔布组和联合干预组NF-κB和COX-2的蛋白表达水平较对照组均显著下降 (P<0.05);卡培他滨亦可减少NF-κB和COX-2的表达,但与对照组相比差异无统计学意义 (P>0.05)(图2)。
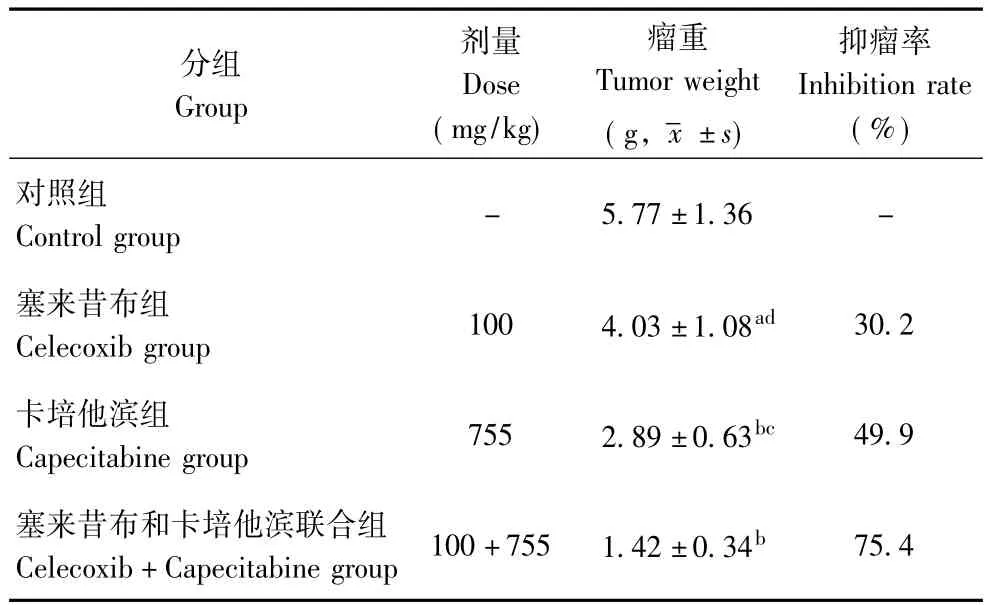
表1 塞来昔布和卡培他滨对抑瘤率的影响 (n=10)Table 1 Effects of celecoxib and capecitabine on tumor inhibition rate(n=10)
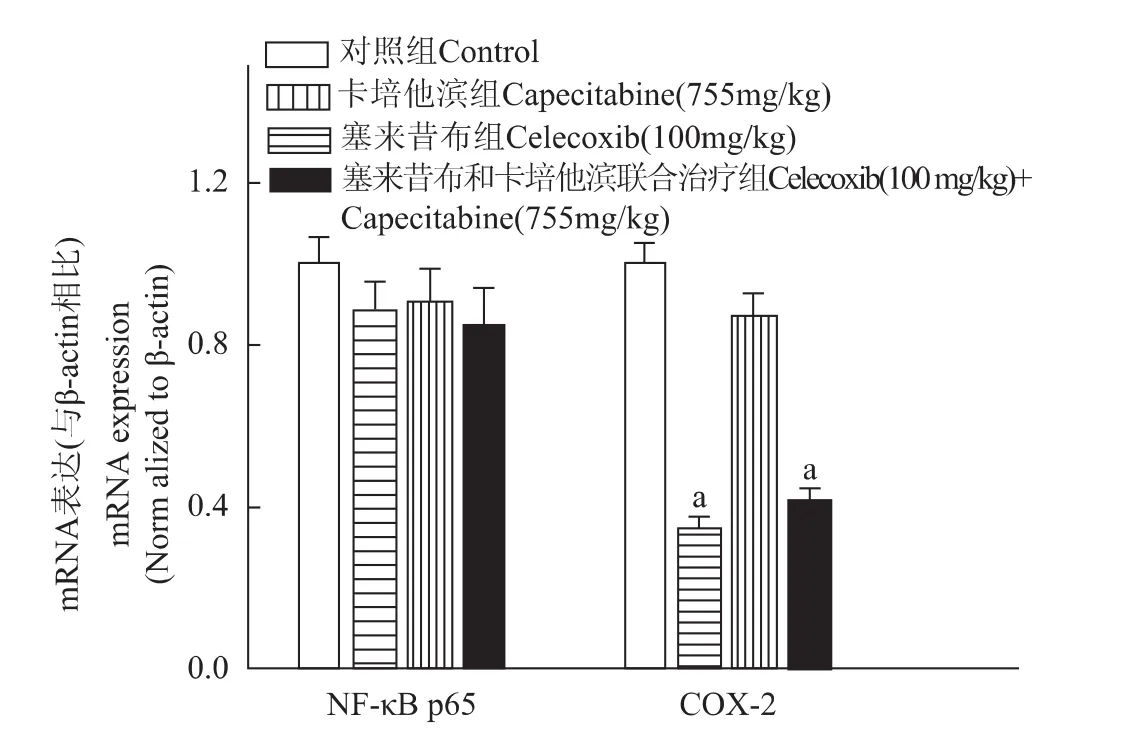
图1 塞来昔布和卡培他滨对NF-κB p65和COX-2的mRNA表达的影响Fig 1 Effects of celecoxib and capecitabine on mRNA expression of NF-κB p65 and COX-2
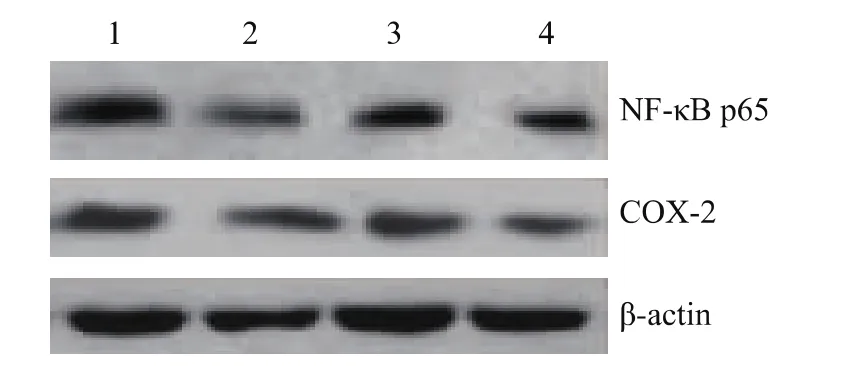
图2 塞来昔布和卡培他滨对NF-κB p65和COX-2蛋白表达的影响Fig 2 Effects of celecoxib and capecitabine on protein expression of NF-κB p65 and COX-2
讨 论
COX-2是催化花生四烯酸合成前列腺素的关键限速酶,众多研究表明,COX-2在多种癌组织中高度表达[5],与肿瘤的发生、发展过程密切相关。COX-2抑制剂塞来昔布具有广泛的抗肿瘤效应[6-7],临床研究显示,塞来昔布与5-氟尿嘧啶联合用于治疗多耐药性肝细胞癌可显著增强抑瘤效果[8],提示塞来昔布用于联合化疗具有巨大的应用前景。卡培他滨是一种新型的抗肿瘤药物,在体内可转化为5-氟尿嘧啶后发挥抗肿瘤效应,临床常用于治疗乳腺癌、结肠癌、直肠癌、胃癌、食管癌等,近来发现卡培他滨对肝癌亦有良好的治疗作用[9]。既往研究表明,卡培他滨与塞来昔布联合化疗晚期结直肠癌可有效控制疾病进展并减轻不良反应[10],但两药联合用于肝癌则鲜有报道。本研究结果显示,塞来昔布和卡培他滨两药单用均可抑制肝癌H22小鼠瘤组织的生长,抑瘤率分别为30.2%和49.9%,而联合干预组抑瘤率高达75.4%,疗效显著优于单药治疗,提示塞来昔布和卡培他滨两药联用治疗肝癌H22小鼠具有协同效应。
NF-κB是COX-2的重要上游调节因子,在炎症、肿瘤等过程中发挥关键作用。多种致癌因子均可通过上调NF-κB的表达,刺激细胞增殖,抑制细胞凋亡,促进肿瘤的浸润转移。生理状况下,NF-κB是由p65和p50两个亚基以及抑制性蛋白IκB结合为三聚体形式存在,当被白细胞介素-1、内毒素等激活后,IκB脱离下来,活化的二聚体进入细胞核内,与DNA特定识别序列结合,调节靶基因转录,刺激肿瘤细胞大量增殖,其中p65是起关键作用的催化亚基。抑制NF-κB可促进肿瘤细胞凋亡,增强肿瘤细胞对化疗药物的敏感性。研究发现,塞来昔布作为COX-2选择性抑制剂,可抑制人肝癌细胞 HeG2中 NF-κB和COX-2表达[11]。本研究结果表明,塞来昔布和联合干预组NF-κB p65和COX-2的蛋白表达水平均较对照组显著下降,而卡培他滨组NF-κB p65和COX-2的表达则无明显变化,提示塞来昔布与卡培他滨具有不同的抗肿瘤机制,两药联用可通过不同的途径在抑制肿瘤生长方面发挥协同作用。
综上,本研究结果提示,塞来昔布可通过抑制NF-κB p65和COX-2的表达,增强卡培他滨的抗肿瘤效应,两药联用具有良好的协同增效作用,为临床治疗肝癌提供了理论依据。
[1]刘智豪,刘叔文,余乐.COX-2抑制剂联合抗肿瘤的研究进展[J].中国药理学通报,2012,28(12):1651-1654.
[2]徐志刚,陈立,吕晓艳,等.塞来昔布对H22肝癌组织环氧合酶2及磷脂酶A2抑制作用 [J].中国实验诊断学,2010,14(2):174-176.
[3]潘烨,郑起,艾开兴,等.α干扰素和卡培他滨对肝癌根治性切除术后转移复发抑制作用的实验研究[J].肿瘤,2005,25(5):439-441.
[4]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method [J].Methods,2001,25(4):402-408.
[5]Hida T,Yatabe Y,Achiwa H,et al.Increased expression of cyclooxygenase 2 occurs frequently in human lung cancers,specifically in adenocarcinomas [J].Cancer Res,1998,58(17):3761-3764.
[6]Tanaka T,Delong PA,Amin K,et al.Treatment of lung cancer using clinically relevant oral doses of the cyclooxygenase-2 inhibitor rofecoxib potential value as adjuvant therapy after surgery [J].Ann Surg,2005,241(1):168-178.
[7]Wick M,Hurteau G,Dessev C,et al.Peroxisome proliferator-activated receptor-gamma is a target of nonsteroidal anti-inflammatory,drugs mediating cyclooxygenase-independent inhibition of lung cancer cell growth [J].Mol Pharmacol,2002,62(5):1207-1214.
[8]Bassiouny AR,Zaky A,Neenaa HM.Synergistic effect of celecoxib on 5-fluorouracil-induced apoptosis in hepatocellular carcinoma patients[J].Ann Hepatol,2010,9(4):410-418.
[9]隋忠国,薛宏伟,荆凡波,等.索拉非尼联合卡培他滨治疗肝细胞癌患者的临床研究 [J].中国药房,2008,19(11):848-849.
[10]邓立春,沈伟生,张瑶,等.卡培他滨节拍化疗联合塞来昔布治疗晚期结直肠癌的临床疗效观察 [J].现代医学,2011,39(4):434-436.
[11]卢栋,李永华,纪龙,等.塞来昔布对人肝癌细胞株HepG2细胞核转录因子-κB活性及蛋白表达的抑制 [J].世界华人消化杂志,2008,16(16):1793-1796.
